由生成热计算反应热
- 格式:ppt
- 大小:116.00 KB
- 文档页数:4

反应热的计算公式反应物减生成物自古以来,反应热就是许多化学过程的重要参数。
它既可以描述化学反应的活力,也可以预测反应的最终产物。
反应热可以用一个简单的计算公式来表示,其中反应物明确表示出来,而生成物则经过计算获得。
今天,我们着重来讨论这个计算公式如何用来计算反应物中应减少哪些物质以得到反应最终产物。
反应热计算公式说明,可以用反应物减去生成物来计算反应热。
首先,我们必须确定反应物和生成物的分子量,并确定反应的终点温度。
然后,将反应物的分子量乘以反应的最终温度,并减去生成物的分子量乘以反应的最终温度,就可以得到反应的热量。
可以将这个热量乘以反应的物质的总量即可得到反应的热量。
例如,当碱性氰化物反应时,反应物氰化物和氢氧化钠的分子量分别为62.03和40.02,反应的终点温度为25℃。
此时可以计算出反应的热量:62.03×25 - 40.02×25 = 1562.75J/mol。
这就是反应的热量。
这个计算公式也可以用来计算加热的量,如果有足够的反应物,反应的热量将会改变反应的最终产物,反应物中需要减少的物质也就清楚了。
可以将反应物中需要减少的物质乘以反应物的热量来计算需要减去的物质量。
例如,一个反应物中氯氧化钠的分子量为58.44,碱性氰化物的分子量为62.03,反应的最终温度为52℃,根据上述计算公式,可以计算出反应热量为-4381.12J/mol。
那么,如果将此反应中的氯氧化钠减少1 mol,则反应热量将减少58.44×(-4381.12)=-255.99kJ。
这样一来,就可以知道反应物中应减少多少物质以得到反应最终产物。
反应热的计算公式是一个强有力的工具,它能够帮助我们更加准确地预测化学反应的结果,还可以确定反应物中应减少哪些物质以得到反应最终产物。
它对预测反应产物的积极作用,也有助于调节反应的活性。
因此,反应热的计算公式受到化学工程师的高度重视,在许多反应中都得到了广泛的应用,从而让反应过程更加安全、精确、有效。



化学反应热的计算公式1.根据反应物与生成物的生成焓之差计算反应热:热力学第一定律表明,在恒定压力下,化学反应的反应热与化学反应物与生成物的焓变有关。
如果我们可以精确测量反应物与生成物的生成焓,就可以通过它们的差值计算反应热。
生成焓(也称为摩尔生成焓)是指在标准状态下,物质生成的过程中所吸收或放出的热量。
通常使用反应热的标准状态为298 K和1 atm的压力。
反应热(ΔH)的计算可以通过化学方程式中物质的化学键能和生成焓之间的关系来进行。
计算公式如下:ΔH=Σ(生成物的摩尔生成焓)-Σ(反应物的摩尔生成焓)其中,Σ表示对所有物质求和,生成焓为正值当物质吸热,为负值当物质放热。
例如,对于以下反应:2H2(g)+O2(g)→2H2O(g)可以通过查阅化学数据手册获得反应物和生成物的生成焓值:ΔH=2ΔHf(H2O)-2ΔHf(H2)-ΔHf(O2)2.根据燃烧热计算反应热:燃烧热(也称为标准燃烧焓)是指物质完全燃烧所释放的热量。
对于燃烧反应,反应热可以直接通过燃烧热进行计算。
燃烧热是物质在燃烧过程中生成的水和二氧化碳释放的热量。
计算公式如下:燃烧热=(燃烧生成的水的摩尔数)×ΔHf(H2O)+(燃烧生成的二氧化碳的摩尔数)×ΔHf(CO2)其中,ΔHf(H2O)和ΔHf(CO2)为水和二氧化碳的摩尔生成焓,可以从化学数据手册中获取。
需要注意的是,计算反应热时必须考虑反应物和生成物之间的摩尔比例关系。
在上述计算燃烧热的公式中,根据燃烧反应的化学方程式确定了生成水和二氧化碳的摩尔比例。
总之,计算化学反应热可以通过求取反应物与生成物的生成焓差异或利用燃烧热进行。
这两种方法都需要了解化学反应方程式和化学数据手册中提供的物质摩尔生成焓。
通过计算化学反应热,我们可以更全面地了解化学反应的热力学性质,对于化学反应的研究和工业应用具有重要意义。
![[工学]AspenPlus应用基础-反应器](https://uimg.taocdn.com/3b6687a018e8b8f67c1cfad6195f312b3069eb7a.webp)


物理化学卡片(一) 热力学第一定律一、理想气体状态方程 pV = nRT 混合理想气体 p i V = n i RT (分压) pV i = n i RT(分体积)二、热力学第一定律 ∆U = Q + W辅助函数焓H H = U + PV热容P p T H C ⎪⎭⎫ ⎝⎛∂∂= VV T U C ⎪⎭⎫⎝⎛∂∂=理想气体热容C p, m – C v, m = R 单原子 C v, m = 3/2RC p, m / C v, m = γ 双原子 C v, m = 5/2R非线性多原子 C v, m = 3R1、理想气体∆U 、Q V 计算 ∆U = Q V =⎰) T -(T C ndT C n 12m V, 常数 m V,C m V,∆H 、Q P 计算 ∆H = Q P =⎰) T -(T C ndT C n 12m P, 常数 m P,C m P,膨胀功计算 W = ⎰⎰PdVdV P可逆 外等温可逆 2112P P lnnRT V V lnnRT W -=-=恒外压 W = -p 外 ( V 2 – V 1 )真空膨胀、等容 W = 0 绝热 W =∆U 终态温度计算绝热可逆pV γ = 常数TV γ-1 = 常数 常数Tp-1=γγ绝热恒外压 )T p p T R()T T (C 112212m V,--=-2、非理想气体节流膨胀 焦-汤系数 Hp T ⎪⎪⎭⎫⎝⎛∂∂=μ ∆U 计算 ∆U =⎰⎰⎰⎪⎭⎫⎝⎛∂∂+ dT C dV V U dT C V TV 恒容∆H 计算∆H =⎰⎰⎰⎪⎭⎫⎝⎛∂∂+ dT CdP P H dT C P TP 恒压 C p,m = a + bT + cT 2 或 C p,m = a + bT + c/T 2 (查表 )三、热化学1、∆r H 、∆r U 关系 ∆r H m = ∆r U m + ∆(pV) 凝聚体系 ∆r H m ≈ ∆r U m 有气体存在 ∆r H m = ∆r U m + ∆nRT ∆n = ∑n 产物 – ∑n 反应物Q P = Q V + ∆nRT (只计算气体)2、反应进度ii n ν∆=ξ3、反应热∆r H m 计算由生成热计算 ∆r H ︒m =∑ν∆f H ︒m (ν:计量系数,反应物为负) 由燃烧热计算 ∆r H ︒m =–∑ν∆ c H ︒m由键焓估算 ∆r H ︒m =∑(n ∆H ︒键焓, m ) 反应物–∑(n ∆H ︒键焓, m ) 产物 4、温度对反应热的影响 微分式 P Pm r C T )H ( ∆=⎥⎦⎤⎢⎣⎡∂∆∂定积分 ∆r H m,2 = ∆r H m,1+⎰∆C P dT∆C P =∑νi C p, m∆C P 为常数∆H 2 = ∆H 1 + ∆C P ( T 2 – T 1 )∆C P 不为常数 查表积分。

《无机化学》期中试卷-参考答案一.简答题:(40分)1. 下列四种水溶液(1)0.2 mol·dm --3KCl ;(2)0.1 mol·dm -3C 12H 22O 11;(3)0.25 mol·dm -3NH 3;(4)0.04 mol·dm -3BaCl 2 按凝固点由高到低应该如何排列?答:(2)(4)(3)(1)分子或离子(质点)浓度越大,凝固点越低2.下列两个反应在298K 和标准态时均为非自发反应,哪一个在高温时仍为非自发反应?(1) HgO (s) === Hg (l) +21O 2 (g) (2) 2 N 2 (g) + O 2 (g) === 2 N 2O (g)答:反应 (2) 在高温时仍为非自发反应,因为该反应为熵减反应。
3.试举例说明在什么情况下θr m H ∆、θf m H ∆ 和θc m H ∆的数值相等。
答:符号θf m H ∆ 表示的是某温度下,由处于标准状态的各种元素的指定单质生成标准状态的1mol 某纯物质时的热效应。
符号θc m H ∆表示的是在100 kPa 的压强下1mol 物质完全燃烧时的热效应。
完全燃烧在热力学上有严格的规定,碳的燃烧产物为CO 2 (g),氢的燃烧产物是H 2O (l),氮、硫、氯的燃烧产物分别为N 2 (g),SO 2 (g) 和HCl (aq)。
如:1mol H 2(g)完全燃烧反应H 2 (g) +21O 2 (g) === H 2O (l) 的θr m H ∆、θf m H ∆ 和θc m H ∆在数值上相等,即该反应的焓变等于H 2 (g)的标准摩尔燃烧焓,也等于H 2O (l)的标准摩尔生成焓,即2θc m ,H (g)H ∆= 2θf m,H O (l)H ∆ = θr m H ∆注意:如果上述反应的产物是H 2O (g),则2θc m ,H (g)H ∆≠2θfm,H O (l)H ∆ 因为H 2 (g) 完全燃烧的产物应是液态H 2O ,而不是气态H 2O 。
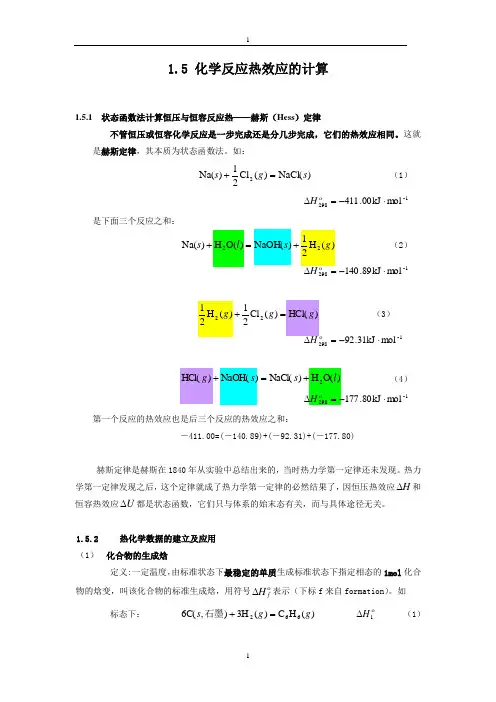
1.5 化学反应热效应的计算1.5.1 状态函数法计算恒压与恒容反应热——赫斯(Hess )定律不管恒压或恒容化学反应是一步完成还是分几步完成,它们的热效应相同。
这就是赫斯定律,其本质为状态函数法。
如:)NaCl()(Cl 21)Na(2s g s =+(1)-1298mol kJ 00.411⋅-=∆ H是下面三个反应之和:)NaOH()O(H )Na(2s l s =+ (2)-1298mol kJ 89.140⋅-)HCl()(Cl 212g g =+ (3)-1298mol kJ 31.92⋅-=∆H)O(H)NaCl()NaOH()HCl(2l s s g +=+ (4)-1298mol kJ 80.177⋅-=∆ H第一个反应的热效应也是后三个反应的热效应之和:-411.00=(-140.89)+(-92.31)+(-177.80)赫斯定律是赫斯在1840年从实验中总结出来的,当时热力学第一定律还未发现。
热力学第一定律发现之后,这个定律就成了热力学第一定律的必然结果了,因恒压热效应H ∆和恒容热效应U ∆都是状态函数,它们只与体系的始末态有关,而与具体途径无关。
1.5.2 热化学数据的建立及应用 (1) 化合物的生成焓定义:一定温度,由标准状态下最稳定的单质生成标准状态下指定相态的1mol 化合物的焓变,叫该化合物的标准生成焓,用符号f H ∆表示(下标f 来自formation )。
如标态下:)(H C )(3H ),C(6662g g s =+石墨1H ∆ (1)标态下:)(H C )(H ),C(2222g g s =+石墨2H ∆ (2)那么)(H C ,66g f H ∆= 1H ∆)(H C ,22g f H ∆=2H ∆什么是最稳定的单质呢?如25℃,1atm.下,碳有石墨、无定型及金刚石三种相态,其中只有石墨是最稳定的相态,故生成反应中当涉及到最稳定的单质碳时必须是石墨。


高中反应热的公式高中反应热的公式是热反应物质间发生化学反应时所释放或吸收的热量。
反应热的计算对于理解化学反应的能量变化非常重要,因为它可以告诉我们反应是否是放热或吸热的,以及反应的强度和方向。
在化学反应中,反应物会发生化学变化,生成新的产物。
在这个过程中,化学键会被打破和形成,从而释放或吸收能量。
反应热的公式可以通过测量反应前后的温度差来计算,或者根据已知的热值来推导。
一般情况下,反应热可以根据下面的公式来计算:反应热 = 生成物的热量 - 反应物的热量其中,生成物的热量是指反应产物形成时释放或吸收的能量,反应物的热量是指反应物发生化学变化时释放或吸收的能量。
反应热的计算需要知道反应物和生成物的热量。
这些热量可以通过实验测量得到,也可以根据已知的标准热量值来推导。
在实验中测量反应热时,可以使用热量计来测量反应前后的温度变化,从而计算出反应热。
反应热的符号表示也很重要。
如果反应热为正值,表示反应是吸热的,即反应物吸收了热量;如果反应热为负值,表示反应是放热的,即反应物释放了热量。
这个符号可以告诉我们反应的强度和方向。
如果反应热为正,表示反应是不利的,需要消耗能量才能进行;如果反应热为负,表示反应是有利的,能够自发进行。
反应热的计算可以帮助我们理解化学反应的能量变化。
例如,在燃烧反应中,燃料与氧气发生化学反应,产生二氧化碳和水。
这个过程是放热的,因为燃料释放了能量。
反应热的计算可以告诉我们燃烧反应的强度和方向,以及所释放的能量数量。
总结起来,高中反应热的公式是热反应物质间发生化学反应时所释放或吸收的热量。
通过计算反应热,我们可以了解化学反应的能量变化,判断反应的强度和方向。
反应热的计算需要知道反应物和生成物的热量,可以通过实验测量或者已知的标准热量值来得到。
符号表示反应热的正负,正值表示吸热反应,负值表示放热反应。
反应热的计算对于理解化学反应的能量变化非常重要,有助于我们深入研究化学反应的本质和特性。
第三节化学反应热的计算(2)二.反应热的计算⒈根据一定量的物质参加反应放出的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。
例1:25℃、101KPa时,将1.0g钠与足量氯气反应生成氯化钠晶体并放出17.87KJ的热量,求生成1mol NaCl 的反应热。
解:设生成1mol NaCl 的反应热为xNa(s) + Cl2(g) = NaCl (s) △H23g/mol x1.0g -17.87kJx=23g/mol×(-17.87kJ)÷ 1.0g=-411kJ/mol答:生成1mol NaCl 的反应热为-411kJ/mol练习1:乙醇的燃烧热为-1366.8kJ/mol,在 25℃、101KPa时, 1kg乙醇充分燃烧后放出多少热量?2.已知一定量的物质参加反应放出的热量,计算反应热,写出其热化学反应方程式。
例2、将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____________。
又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
[随堂练习]已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2b kJ / molB. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=2b kJ / molC. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-4b kJ / molD. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=b kJ / mol3.利用键能计算反应热方法:ΔH=∑E(反应物)-∑E(生成物),即反应热等于反应物的键能总和跟生成物的键能总和之差。