镁与水反应报告单
- 格式:doc
- 大小:37.50 KB
- 文档页数:1

水总硬度的测定实验报告
《水总硬度的测定实验报告》
实验目的:通过测定水样的总硬度,了解水质的硬度水平,为水质的评估和改
善提供依据。
实验原理:水的硬度是指水中含有的钙、镁离子的总量。
通常用钙离子浓度的
单位来表示,单位为mg/L或ppm。
硬度水平分为软水、中硬水、硬水和超硬
水四个等级。
硬度水平高低直接影响着水的使用和饮用安全。
实验方法:采集不同来源的水样,使用EDTA滴定法测定水样的总硬度。
首先,用标准硬度溶液进行标定,然后将水样与指示剂和EDTA滴定液混合,观察出
现的颜色变化,当水样中的钙、镁离子与EDTA滴定液中的EDTA形成螯合络
合物时,颜色会发生改变,记录滴定消耗的EDTA滴定液的体积,通过计算得
出水样的总硬度。
实验结果:经过实验测定,得出不同来源水样的总硬度如下:自来水样A为
80mg/L,井水样B为150mg/L,河水样C为200mg/L。
实验结论:通过实验测定,可以看出自来水样A为中硬水,井水样B为硬水,
河水样C为超硬水。
水样的硬度水平直接影响着水的使用和饮用安全,超硬水
会影响人体健康,因此需要对水质进行改善处理。
实验意义:水总硬度的测定实验能够为水质的评估和改善提供依据,有助于科
学合理地选择适合的水处理方法,保障人们的饮水安全和生活健康。
综上所述,水总硬度的测定实验报告为我们提供了对水质硬度水平的了解,对
于改善水质和保障人们的饮水安全具有积极的意义。
希望通过不断的科学研究
和实验探索,能够为改善水质和保障人们的生活健康贡献更多的力量。

镁和钠与水反应现象不同的原因
镁和钠是两种金属元素,它们与水反应的现象却有着明显的不同。
这种差异主要是由于两种金属元素的化学性质和反应机制不同
所致。
首先,我们来看镁与水的反应。
镁是一种较活泼的金属,但它
与水反应并不剧烈。
当镁与水接触时,会产生氢气气泡,同时生成
氢氧化镁。
这是因为镁的电负性较高,它与水中的氢离子发生置换
反应,生成氢气和氢氧化镁。
相比之下,钠与水的反应则要剧烈得多。
钠是一种非常活泼的
金属,它与水反应时会迅速放出大量的氢气,并且会产生火花和火焰。
这是因为钠的活性非常高,它与水反应时会非常迅速地释放出
氢气,并且会产生大量的热量,从而引燃氢气。
这种差异的原因主要在于镁和钠的原子结构和化学性质不同。
镁的原子结构稳定,它与水反应时释放的能量较少,因此反应相对
温和。
而钠的原子结构非常活泼,它与水反应时释放的能量非常大,因此反应非常剧烈。
总的来说,镁和钠与水反应现象不同的原因主要在于它们的原子结构和化学性质不同。
这种差异导致了它们与水反应时释放能量的差异,从而产生了不同的反应现象。

水硬度的测定实验报告水硬度的测定实验报告引言:水是人类生活中不可或缺的重要资源,而水的硬度是衡量水质的一个重要指标。
水硬度主要由水中的钙、镁离子所致,对人体健康和工业生产都有一定的影响。
本实验旨在通过测定不同水样的硬度,了解水质的差异,并探讨不同因素对水硬度的影响。
实验方法:1. 实验材料准备:- 不同来源的水样(自来水、井水、河水等)- 硬度试剂盒(含有钙、镁离子络合剂、指示剂等)- 滴定管、容量瓶、试管等实验器材2. 实验步骤:1) 取一定量的不同来源的水样,分别装入试管中。
2) 依次向试管中滴加硬度试剂盒中的试剂,每滴加一滴后轻轻摇晃试管,直至试管中出现颜色变化。
3) 记录每种水样的滴加试剂的滴数,以及颜色变化的终点。
实验结果:经过实验测定,我们得到了以下结果:- 自来水样品:滴加试剂的滴数为10滴,颜色变化终点为红色。
- 井水样品:滴加试剂的滴数为20滴,颜色变化终点为蓝色。
- 河水样品:滴加试剂的滴数为15滴,颜色变化终点为绿色。
实验讨论:通过对不同来源水样的测定,我们可以看出不同水样的硬度存在差异。
根据实验结果,自来水的硬度较低,井水的硬度较高,而河水的硬度居中。
这是因为自来水经过处理,其中的钙、镁离子含量较低,而井水则可能受到地下水中的矿物质溶解而含有较高的钙、镁离子。
河水则受到来自地表的溶解物质的影响,硬度介于自来水和井水之间。
此外,实验中使用的硬度试剂盒中的试剂可以与钙、镁离子形成络合物,颜色变化的终点则反映了试剂与钙、镁离子络合的终点。
不同水样的硬度不同,对应的终点颜色也不同,这为我们提供了一种简单、直观的测定水硬度的方法。
实验结论:通过本实验的测定,我们得出了以下结论:1. 不同来源的水样具有不同的硬度,自来水的硬度较低,井水的硬度较高,河水的硬度居中。
2. 硬度试剂盒中的试剂可以与钙、镁离子形成络合物,颜色变化的终点可以作为测定水硬度的指标。
实验的局限性和改进方向:本实验中仅选取了少数水样进行测定,样本数量较少,因此不能代表所有水样的硬度情况。

电解质报告单电解质是维持人体正常生理功能的重要成分,它们在细胞内外维持着水和电解质的平衡,参与着神经传导、肌肉收缩、酸碱平衡等多种生理活动。
因此,电解质的浓度和平衡状态对人体健康至关重要。
本报告单将对电解质的相关指标进行分析,以帮助您了解自身身体状况。
1. 血钠(Na+),正常范围为135-145mmol/L。
血钠是维持细胞外液渗透压和酸碱平衡的重要离子,也是神经肌肉兴奋性的调节因子。
低血钠(低钠血症)常见于失水过多、肾上腺皮质功能不全等情况,而高血钠(高钠血症)则可能是由失水不足、肾脏功能障碍等引起。
请结合临床症状进行进一步检查。
2. 血钾(K+),正常范围为3.5-5.5mmol/L。
血钾是维持细胞内外电位差和肌肉、神经功能的重要离子。
低血钾(低钾血症)常见于饥饿、腹泻、利尿剂使用等情况,而高血钾(高钾血症)可能是由肾脏功能障碍、酸中毒等引起。
及时调整饮食结构,避免过量摄入钾离子。
3. 血钙(Ca2+),正常范围为2.2-2.6mmol/L。
血钙是维持骨骼、神经、肌肉等组织正常功能的重要离子。
低血钙(低钙血症)常见于维生素D缺乏、甲状旁腺功能减退等情况,而高血钙(高钙血症)可能是由甲状旁腺功能亢进、骨骼恶性肿瘤等引起。
请及时就医,进行相关检查和治疗。
4. 血镁(Mg2+),正常范围为0.65-1.05mmol/L。
血镁是细胞内重要的离子,参与多种酶系统的激活和细胞内外的离子平衡。
低血镁(低镁血症)常见于长期饥饿、酒精滥用等情况,而高血镁(高镁血症)可能是由肾脏功能障碍、肾上腺功能亢进等引起。
请避免过量摄入镁离子,保持饮食均衡。
5. 血氯(Cl-),正常范围为96-106mmol/L。
血氯是维持体液渗透压和酸碱平衡的重要离子,与血钠协同调节酸碱平衡。
低血氯(低氯血症)常见于呕吐、腹泻、肾小管酸中毒等情况,而高血氯(高氯血症)可能是由脱水、肾脏功能障碍等引起。
请及时调整饮食结构,保持水电解质平衡。

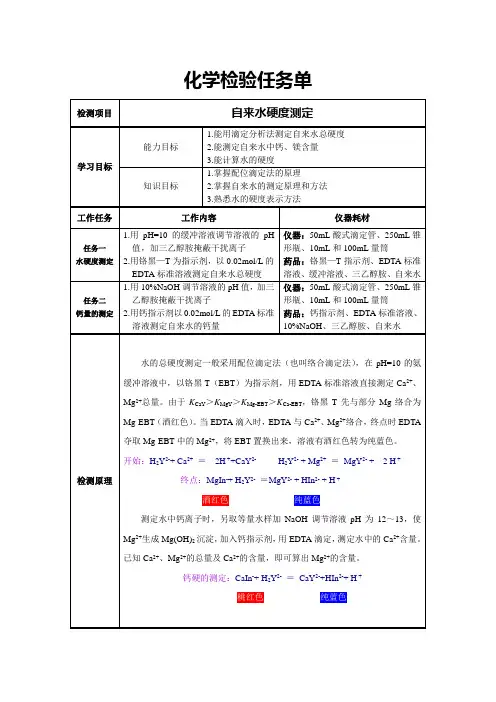
第1篇一、实验目的1. 了解水的总硬度的概念和测定意义;2. 掌握EDTA滴定法测定水样总硬度的原理和方法;3. 熟悉铬黑T指示剂的使用和终点判断;4. 提高实验操作技能和数据分析能力。
二、实验原理水的总硬度是指水中钙、镁离子的总浓度,通常以每升水中含有的碳酸钙的毫克数(mg/L)表示。
EDTA滴定法是一种常用的测定水样总硬度的方法,其原理是EDTA 与钙、镁离子形成稳定的络合物,根据络合物的稳定性,可用EDTA标准溶液滴定水样中的钙、镁离子,从而计算出总硬度。
三、实验器材与试剂1. 器材:- 电子天平- 移液管- 滴定管- 锥形瓶- 烧杯- 玻璃棒- pH计- 恒温水浴锅2. 试剂:- 乙二胺四乙酸二钠(EDTA)标准溶液(0.01mol/L)- 铬黑T指示剂- 盐酸- 碳酸钠- 碳酸氢钠- 水样四、实验步骤1. 标准溶液的配制- 称取0.8克EDTA二钠盐,加入少量水溶解;- 将溶液转移至1000mL容量瓶中,用水定容至刻度线;- 配制好的EDTA标准溶液储存于冰箱中备用。
2. 水样预处理- 取一定量的水样,用碳酸钠和碳酸氢钠调节pH至8.5-9.5;- 用移液管取50mL水样于锥形瓶中,加入适量的铬黑T指示剂;- 用盐酸滴定至溶液由酒红色变为纯蓝色,记录消耗的盐酸体积。
3. 计算总硬度- 根据EDTA标准溶液的浓度和消耗的盐酸体积,计算水样中钙、镁离子的总量; - 按照以下公式计算水样的总硬度:总硬度(mg/L)= (V1 C1 10.67) / V2其中,V1为消耗的EDTA标准溶液体积(mL),C1为EDTA标准溶液的浓度(mol/L),V2为水样的体积(mL),10.67为碳酸钙的摩尔质量与钙离子的摩尔质量之比。
五、实验结果与分析1. 实验结果- 本实验测得水样的总硬度为XXX mg/L。
- 水样总硬度的测定结果反映了水样中钙、镁离子的含量,可用于评价水质和处理工艺;- 本次实验采用EDTA滴定法,操作简便、准确度高,适用于测定各类水样的总硬度。

饮水硬度检测实验报告1. 引言水硬度是衡量水中溶解的钙和镁离子含量的指标,也是评估水质的重要参数之一。
本次实验旨在通过使用盐酸与标准EDTA溶液的滴定法检测水的硬度。
2. 实验设备和试剂2.1 实验设备- 滴定管- 酸碱滴定管- 烧杯- 取样瓶- 加热板- 称量器2.2 试剂- 0.01 mol/L 盐酸溶液- 0.01 mol/L EDTA四钠盐溶液3. 实验步骤3.1 样品准备从自来水管道中取得约500毫升水样,放入取样瓶中备用。
3.2 滴定前的处理取25毫升水样加入烧杯中,在加热板上加热至水样沸腾,持续加热3分钟。
加热目的是驱除溶解在水中的二氧化碳。
3.3 酸化将加热后的水样置于室温下冷却,然后加入2~3滴盐酸,用滴定管搅拌均匀。
3.4 滴定取约50毫升酸化后的水样倒入滴定瓶中,加入几滴甲基橙指示剂。
然后用0.01 mol/L EDTA四钠盐溶液滴定。
3.5 滴定的判定在滴定过程中,溶液变色由橙色变为玫瑰红色。
当滴加EDTA溶液时,出现终点颜色由玫瑰红变为蓝色。
蓝色的出现代表EDTA与金属离子形成了螯合物。
滴定过程中必须维持溶液的pH为8-10。
3.6 实验重复以上实验步骤需要至少重复3次,取平均值作为最后的结果。
4. 实验结果与数据处理经过三次实验,测得滴定所需的EDTA四钠盐溶液的体积如下:第一次实验:32.1 mL第二次实验:31.9 mL第三次实验:32.2 mL计算平均体积:(32.1 + 31.9 + 32.2) / 3 = 32.07 mL据此可计算出水样中钙和镁离子的含量。
5. 讨论与结论通过滴定实验我们得出了水样中钙和镁离子的含量。
根据国家标准,水硬度的分级为:0-60 mg/L 软水,61-120 mg/L 中硬水,121-180 mg/L 较硬水,181-240 mg/L 硬水,>240 mg/L 非常硬水。
根据我们的实验结果,我们可以对水的硬度进行正确的评估和分级。

第1篇一、实验目的1. 了解元素的基本性质,包括物理性质和化学性质。
2. 掌握元素性质的实验方法和观察技巧。
3. 分析实验结果,加深对元素性质的理解。
二、实验原理元素是构成物质的基本单元,具有独特的物理和化学性质。
本实验通过对不同元素的物理和化学性质进行观察和实验,验证元素性质的特点和规律。
三、实验用品1. 试剂:金属钠、钾、镁、铝、铁、铜、锌、硫、磷、氯、溴、碘等。
2. 仪器:试管、烧杯、酒精灯、镊子、滴管、滤纸、玻璃棒、天平等。
四、实验步骤1. 物理性质实验(1)观察金属钠、钾、镁、铝、铁、铜、锌的密度、熔点、硬度等物理性质。
(2)观察硫、磷、氯、溴、碘的熔点、沸点、颜色等物理性质。
2. 化学性质实验(1)金属钠、钾与水反应实验:将金属钠、钾分别放入水中,观察反应现象。
(2)金属镁、铝与稀盐酸反应实验:将镁、铝分别放入稀盐酸中,观察反应现象。
(3)硫、磷与氧气反应实验:将硫、磷分别与氧气反应,观察反应现象。
(4)氯、溴、碘与氢氧化钠溶液反应实验:将氯、溴、碘分别与氢氧化钠溶液反应,观察反应现象。
五、实验结果与分析1. 物理性质实验结果金属钠、钾的密度较大,熔点低,硬度小;镁、铝的密度较小,熔点较高,硬度较大;铁、铜、锌的密度较大,熔点较高,硬度较大;硫、磷的熔点较低,颜色分别为黄色、红色;氯、溴、碘的沸点较高,颜色分别为黄绿色、红棕色、紫黑色。
2. 化学性质实验结果金属钠、钾与水反应剧烈,产生氢气;镁、铝与稀盐酸反应产生氢气;硫、磷与氧气反应生成相应的氧化物;氯、溴、碘与氢氧化钠溶液反应生成相应的盐。
六、实验结论1. 元素具有独特的物理性质,如密度、熔点、硬度等。
2. 元素具有独特的化学性质,如与水、酸、氧气等反应。
3. 同一主族元素性质具有相似性,同周期元素性质具有递变规律。
七、实验注意事项1. 实验过程中,注意安全,避免烫伤、割伤等事故。
2. 实验操作要规范,确保实验结果的准确性。
3. 实验过程中,注意观察实验现象,做好记录。

天然水总硬度的测定实验报告天然水是指没有受到任何人为处理或污染的地下或自然水源。
人们常常认为地下水比自来水更纯净,更健康,也更自然。
然而,即使是天然水也含有一定的矿物质,如钙、镁等,这些矿物质与水中的碳酸盐反应,会导致水的硬度。
本实验将探究如何测定天然水中的总硬度。
实验器材:1. 烧杯或准确瓶2. 滴定管3. 玻璃棒4. 毛细管5. 基质溶液:硬度为5mmol/L,用于标定6. EDTA溶液:0.01mol/L,用于测定7. 酚酞指示剂:用于标定和测定实验步骤:1. 实验前准备洗净所有仪器和试剂瓶,并用去离子水冲洗。
将基质溶液放入烧杯或准确瓶中,并标定其体积。
2. 标定将一滴酚酞指示剂滴入基质溶液中,溶液会变成深粉色。
用EDTA溶液通过滴定的方式将溶液变成无色。
第一次滴定时不需要立即停止,而是快速滴入,直到将溶液变成粉色,然后再逐渐滴入EDTA直到溶液变色。
用同样的方法进行三次滴定,并记录EDTA溶液的浓度。
将数据平均化。
3. 测定将准确的天然水样品(约50ml)倒入烧杯中,并加入1滴酚酞指示剂。
用滴定管逐渐加入EDTA溶液,并用玻璃棒搅拌溶液,直到其颜色从粉色变为无色。
记录EDTA溶液的体积。
4. 计算在这个实验中,总硬度指的是钙和镁的浓度和。
因为EDTA可以与钙和镁反应,所以我们可以通过滴定EDTA溶液来测定天然水中钙和镁的浓度和,然后将浓度相加,从而得出总硬度。
总硬度的单位是毫摩尔/升。
例如,当用EDTA溶液滴到25ml时,EDTA的浓度为0.0125mol/L,且天然水样品需要5ml的EDTA溶液达到无色。
那么天然水中的总硬度为:总硬度=EDTA的浓度*EDTA的体积/样品的体积=(0.0125mol/L)*(5ml/50ml)=0.00125mol/L总结:总硬度是衡量天然水质量的重要指标之一。
通过本实验,我们了解了如何测量总硬度,并且知道EDTA溶液是如何将钙和镁与水反应的。
在现实生活中,我们可以使用这个实验来测量饮用水中的总硬度,以保证水的安全和健康。

原子吸收法测定自来水中钙、镁含量实验综述报告摘要:本实验综述报告旨在探究利用原子吸收法测定自来水中钙和镁含量的方法和原理,并总结分析不同实验条件下的实验结果。
实验结果表明,原子吸收法是一种可靠、准确度高的测定自来水中钙和镁含量的方法。
1. 引言钙和镁是人体所必需的微量元素,在自来水中含量的测定对于了解水质的安全和适用性至关重要。
本报告将详细介绍利用原子吸收法测定自来水中钙和镁含量的实验方法和原理,以及实验结果的分析。
2. 实验方法2.1 仪器设备本实验使用的原子吸收光谱仪包括空心阴极灯、光栅单色仪、电感耦合等离子体发射光谱仪、汞灯等。
2.2 实验原理原子吸收法是基于物质中吸收电磁辐射的原理进行测定的。
在本实验中,利用钙和镁原子在吸收电磁波时的特定谱线进行测量,通过比较标样和待测样的吸光度差值计算得到钙和镁的含量。
2.3 实验步骤(1)收集自来水样品并进行预处理,如过滤除去杂质。
(2)根据预处理后的水样,确定适当的工作条件,包括光源选择、光谱仪设置等。
(3)测定标样,得出标样中钙和镁的吸光度。
(4)测定待测样,通过比较其吸光度与标样的差值计算出钙和镁的含量。
3. 结果分析本实验通过测定多个自来水样品,得到了相应的测量结果。
实验结果表明,不同样品中钙和镁的含量存在一定差异,其中钙的含量范围为25-60 mg/L,镁的含量范围为5-30 mg/L。
通过与相关标准的对比,发现样品中钙和镁的含量均在合理范围内。
4. 实验误差分析在实验过程中,可能会出现一些误差,并影响到测量结果的准确性。
其中主要包括仪器误差、预处理误差以及实验操作误差等。
为减小误差,可以通过增加标样的重复测量、提高实验操作的精度以及合理设置实验条件等方式进行改进。
5. 结论本实验采用原子吸收法成功测定了自来水中钙和镁的含量,实验结果表明该方法简便、准确度高。
然而,在进行实际应用时还需考虑到实验误差的存在,通过合理的实验设计和操作,可以提高测量结果的准确性和可靠性。
水硬度的测定实验报告
实验目的:
测定给定水样的硬度。
实验原理:
水的硬度是指水中含有的钙和镁离子的浓度,主要来源于地下水与某些岩石中溶解的矿物质。
常见的硬度单位是毫克/升(mg/L)或国际石碱度(°dH)。
测定水样的硬度主要通过滴定来实现。
硬度滴定主要分为两个步骤:第一步是用氧化钠溶液与水样中的镁离子反应,生成沉淀;第二步是用乙二胺四乙酸(EDTA)溶液与镁、钙离子形成络合物,在外滴定过程中,水样中的镁、钙离子与EDTA 络合物生成的斑点逐渐消失。
滴定终点即是滴定液颜色由酒红色到蓝色的瞬间,此时EDTA的摩尔数与水样中的镁、钙离子的摩尔数相等,从而可以计算出水样中的硬度。
实验步骤:
1. 准备样品:将待测水样放入滴定瓶中。
2. 加试剂:用移液器加入适量的氧化钠溶液。
3. 摇匀:轻轻摇匀,并注意溶液的颜色变化。
4. 滴定:用具有PH值指示作用的指示剂滴入少量滴定液,颜色变化由酒红色变为蓝色。
5. 滴定终点:滴定液颜色突然从酒红色变为蓝色时,记录已滴定的体积。
6. 计算硬度:根据水样中所滴定液的体积和EDTA的浓度,计算出水样的硬度。
实验结果:
根据滴定液的体积和EDTA的浓度计算出水样的硬度为XX mg/L。
实验结论:
通过本实验测定出了给定水样的硬度,对于水质评价和水处理过程中的优化具有一定的指导意义。
进一步的分析和研究可以提供更详细的水质信息。
水质钙和镁的测定方法确认报告一、方法依据GB11905-1989 火焰原子吸收分光光度法。
二、方法原理将试液喷入火焰中,使钙、镁原子化,在火焰中形成的基态原子对特征谱线产生选择性吸收。
由测得的样品吸光度和校准溶液的吸光度进行比较,确定样品中被测元素的浓度。
选用422.7nm共振线的吸收测定钙,用285.2nm共振线的吸收测定镁。
三、.仪器原子吸收分光光度计:仪器性能指标应符合GB/T 21191的规定。
元素灯(钙、镁)。
采样容器:硬质玻璃瓶或聚乙烯瓶(桶)。
实验室常用器皿:符合国家标准的A级玻璃量器和玻璃器皿。
四、.试剂和材料除非另有说明,分析时均使用符合国家标准的优级纯化学试剂,实验用水为新制备的去离子水或蒸馏水。
硝酸(GR)、高氯酸、氧化镧;钙、镁标准溶液各1支(1000μg/mL);高纯乙炔(≥99%)。
五、分析方法步骤1、样品预处理1.1可滤态钙、镁时,如水样有大量泥沙,悬浮物,应通过0.45um滤膜过滤,滤液加硝酸酸化PH到1-2.`1.2分析不可滤态总量时,采集后立即加硝酸酸化PH为1-2.,如果样品需要消解,则校准溶液空白溶液也要消解,消解步骤详见标准。
2、样品测定标准曲线制定绘制标准曲线,计算回归方程,以所测样品的吸光强度,从标准曲线或回归方程中查得样品溶液中各元素的质量浓度(mg/L) 。
六、讨论1、适用范围:该标准适用于地下水、废水和地面水中钙和镁的测定。
2、检出限评定按照样品分析的全部步骤,平行测定空白11次,并按下列公式计算标准偏差,同时计算出方法的检出限:S t MDL n ⨯=-)99.0,1(式中:MDL ——方法检出限; n —— 样品的平行测定次数;t ——自由度为n -1,置信度为99%时的t 分布(单侧); S —— n 次平行测定的标准偏差。
其中,当自由度为n -1=10,置信度为99% 时的t 值为2.764。
3、准确度和精密度检测3.2准确度(具体数据附检测记录表) 3.3加标回收率(具体数据附检测记录表) 对加标回收样进行回收试验结果如下:七、结论通过对以上指标的测试,结果均符合标准方法要求,所得检出限低于方法给定检出限,精密度和准确度的测试均达到标准方法的范围,所以对此方法予以确认。
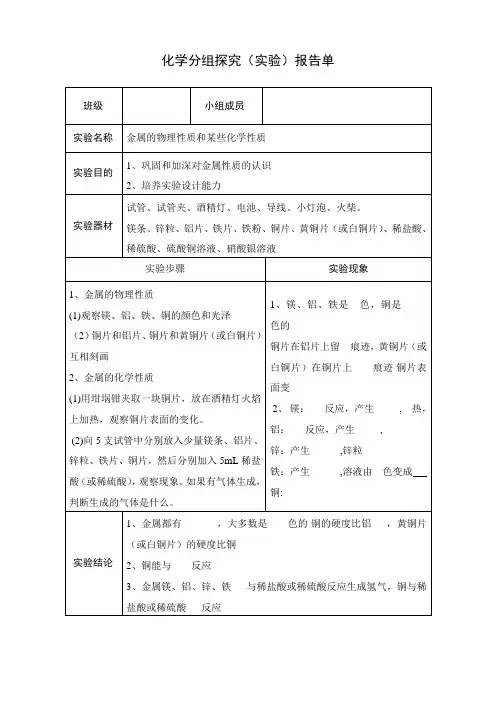
高中化学实验报告单高中化学实验报告单篇一钠、镁、铝单质的金属性强弱通过实验,探究钠、镁、铝单质的金属性强弱。
金属钠、镁条、铝片、砂纸、滤纸、水、酚酞溶液、镊子、烧杯、试管、剪刀、酒精灯、火柴。
1、实验步骤对比实验1(1)切取绿豆般大小的'一块金属钠,用滤纸吸干表面的煤油。
在一只250ml烧杯中加入少量的水,在水中滴加两滴酚酞溶液,将金属钠投入烧杯中。
现象:。
有关化学反应方程式:。
(2)将已用砂纸打磨除去氧化膜的一小段镁条放入试管中,向试管中加入适量的水,再向水中滴加两滴酚酞溶液。
现象:。
然后加热试管,现象:。
有关反应的化学方程式:。
对比实验2在两支试管中,分别放入已用砂纸打磨除去氧化膜的一小段镁条和一小块铝片,再向试管中各加入2mol/l盐酸2ml。
现象:。
有关反应的化学方程式。
2、实验结论:1、元素金属性强弱的判断依据有哪些?2、元素金属性强弱与元素原子结构有什么关系?高中化学实验报告单篇二1、掌握溶解、过滤、蒸发等实验的操作技能。
2、理解过滤法分离混合物的化学原理。
3、体会过滤的原理在生活生产等社会实际中的应用。
粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:ca2+,mg2+,so42―等.不溶性杂质可以用过滤的方法除去,然后蒸发水分得到较纯净的精盐。
托盘天平,量筒,烧杯,玻璃棒,药匙,普通漏斗,铁架台(带铁圈),蒸发皿,酒精灯,火柴,蒸发皿。
试剂:粗盐、蒸馏水。
1、溶解:①称取约4g粗盐②用量筒量取约12ml蒸馏水③把蒸馏水倒入烧杯中,用药匙取一匙粗盐放入烧杯中边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止。
观察溶液是否浑浊。
2、过滤:将滤纸折叠后用水润湿使其紧贴漏斗内壁并使滤纸上沿低于漏斗口,溶液液面低于滤纸上沿,倾倒液体的烧杯口要紧靠玻璃棒,玻璃棒的末端紧靠有三层滤纸的一边,漏斗末端紧靠承接滤液的烧杯的内壁。
慢慢倾倒液体,待滤纸内无水时,仔细观察滤纸上的剩余物及滤液的颜色.滤液仍浑浊时,应该再过滤一次。
水的硬度测定实验报告
实验名称:水的硬度测定
实验原理:
水的硬度是指水中可溶解的含钙、镁等离子的总量。
水的硬度可以影响水的化学反应、洗涤效果等。
水的硬度分为临界硬度、碳酸盐硬度、非碳酸盐硬度以及总硬度。
在实验中,我们采用EDTA(乙二胺四乙酸)复合物滴定法对水的总硬度进行测定。
实验材料:
1.硬度标准溶液
2.橙II指示剂
3.0.01mol/L EDTA滴定液
4.水样
5.实验器材:容量瓶、滴定管、比色皿、洗涤瓶、取样瓶等
实验步骤:
1.取一定量的水样,并将水样转移到容量瓶中。
2.加入5mL橙II指示剂使其变为粉色。
3.打开龙头滴定液,缓慢滴入EDTA滴定液,并不断翻动容量瓶,直至指示剂颜色由粉色变成蓝色。
4.重复实验3,直至两次滴定体积差小于0.5mL,计算出水样的EDTA滴定液体积。
5.以硬度标准溶液为对照,按照上述实验方法重复测定,根据标准溶液的体积与EDTA滴定液的体积比值计算出所测水样的硬度。
实验结果:
本次实验测得水样的EDTA滴定液体积为31.40mL,相应的硬度值为298.24mg/L CaCO3。
实验结论:
本次实验采用EDTA滴定法,成功测定了水样的总硬度。
实验结果表明所测水样的硬度值在标准范围内,符合生活用水标准。
该实验方法简单、快速而且准确,适用于水的硬度测量分析。
自来水硬度的测定实验报告一、实验目的1、了解水硬度的概念及其表示方法。
2、掌握 EDTA 滴定法测定自来水硬度的原理和操作方法。
3、学会正确使用移液管、滴定管等仪器。
二、实验原理水的硬度主要由钙、镁离子的含量决定。
硬度通常表示为以碳酸钙(CaCO₃)计的浓度,单位为 mg/L 或 mmol/L。
在 pH 约为 10 的条件下,以铬黑 T 为指示剂,用乙二胺四乙酸二钠盐(EDTA)标准溶液滴定水中的钙、镁离子。
EDTA 与钙、镁离子形成稳定的配合物,当溶液中的钙、镁离子全部与 EDTA 结合时,铬黑T 指示剂由酒红色变为蓝色,即为滴定终点。
反应式如下:Ca²⁺+EDTA → CaEDTAMg²⁺+EDTA → MgEDTA三、实验仪器和试剂1、仪器酸式滴定管(50 mL)移液管(25 mL)锥形瓶(250 mL)容量瓶(100 mL)烧杯(100 mL、500 mL)玻璃棒电子天平pH 计2、试剂乙二胺四乙酸二钠盐(EDTA)氯化铵(NH₄Cl)氨水(NH₃·H₂O)镁溶液(含镁 1000 g/L)铬黑 T 指示剂自来水样四、实验步骤1、 001 mol/L EDTA 标准溶液的配制与标定(1)配制:称取约 4 g EDTA 二钠盐于 500 mL 烧杯中,加入约200 mL 水,温热溶解后,转入容量瓶中,用水稀释至1000 mL,摇匀。
(2)标定:准确称取 025 g 基准物质碳酸钙(CaCO₃)于 250 mL烧杯中,用少量水润湿,盖上表面皿,从杯嘴边逐滴加入 1:1 盐酸至碳酸钙完全溶解,加热煮沸,除去二氧化碳。
冷却后,加入 100 mL 水,滴加 10%氨水至溶液呈微碱性(pH 约为 8),再加入 10 mL 氨氯化铵缓冲溶液(pH = 10),加入 3 滴铬黑 T 指示剂,用配制好的 EDTA溶液滴定至溶液由酒红色变为蓝色,即为终点。
记录消耗 EDTA 溶液的体积,平行标定三份,计算 EDTA 标准溶液的浓度。
镁条与水反应方程式
镁条与水反应的化学方程式如下所示:
Mg + 2H2O → Mg(OH)2 + H2。
这个方程式描述了镁条与水发生反应的过程。
在这个反应中,镁条与水发生置换反应,产生了氢气和氢氧化镁。
镁条被氢氧化镁和氢气所代替。
这个方程式中的系数表明了反应物和生成物的摩尔比。
反应式中的2H2O表示有2个水分子参与反应,Mg(OH)2表示生成的氢氧化镁,H2表示生成的氢气。
这个方程式是通过实验验证得出的,它描述了镁与水反应的化学变化过程。
通过这个方程式,我们可以了解到镁与水反应的产物以及摩尔比,从而更好地理解这一化学反应。