高中化学必修一-碳酸钠碳酸氢钠与酸碱盐反应第四课时
- 格式:pdf
- 大小:110.73 KB
- 文档页数:4




第三章第二节几种重要的金属化合物碳酸钠和碳酸氢钠一、教材分析钠的化合物是本章教材的重点之一,它贯穿整个无机化学的教学过程中。
通过钠的化合物的学习,可以加深巩固对钠这一节知识理解与应用,并为下一节学习碱金属的性质奠定基础,所以本节课具有承上启下的作用;并且通过过氧化钠强氧化性的学习还能进一步巩固氧化还原反应的知识以及对氧化还原反应的认识与理解;钠的化合物碳酸钠和碳酸钠等又与日常生活息息相关。
通过本节课的学习使学生能理论联系实际,达到学以致用的目的,所以学好本节内容还有着重要的实际意义。
二、学情分析在本节课之前,学生已经学习了氧化还原反应、离子反应、以及钠单质的性质等知识,能够对化学反应的得失电子情况及离子反应的本质做出正确的判断。
在能力上,学生已经初步具备观察能力、实验能力、思维能力,喜欢通过实验探究的方式来研究物质的性质,可以通过对实验现象的分析、对比、归纳出实验结论。
三、设计理念根据建构主义理论,创设一定的任务情景,通过问题线索引发学生在原有认知基础上主动建构新知识。
充分体现学生是信息加工的主体、是意义的主动建构者,促进学生主动发展。
本节课的设计思路是创设情境→提出问题→探究性质→总结性质→解决问题。
本节课的设置了五个教学环节,激发学生的学习兴趣和求知欲,充分运用探究精神,层层推进,坚持以人为本的宗旨,注重对学生进行科学方法的训练和科学思维的培养,提高学生的逻辑推理能力以及分析问题、解决问题、总结规律的能力。
四、教学目标1.掌握碳酸钠和碳酸氢钠的物理、化学性质及鉴别方法。
2.通过演示实验,培养学生的观察能力、以及分析总结的能力。
3.通过演示实验,启发、诱导使学生体验实验的作用,认识碳酸钠和碳酸氢钠的物理性质和化学性质。
4.采用实验探究、列表比较的对比分析和讨论归纳,突破教学重难点,让学生掌握碳酸钠和碳酸氢钠的性质五、教学重难点教学重点:Na2CO3和NaHCO3的化学性质及鉴别方法。
教学难点:对实验现象的观察和分析:探究能力的培养提高。




碳酸钠的性质与应用牟奎华一学习目标:1)通过实验的方法了解碳酸钠和碳酸氢钠的性质2)通过阅读的方法了解碳酸钠和碳酸氢钠在生产生活中的应用3)通过对比的方法了解碳酸钠和碳酸氢钠的异同点及其原因二课前导学:1)温故知新:①写出碳酸钠和碳酸氢钠的电离方程式:Na2CO3__________________________NaHCO3_____________________________②复分解反应的条件是:_____________________________________________________________________________________________________________________________2课前自学:先阅读教材,然后再阅读下列文字,回答下列问题:碳酸钠是一种非常重要的化工原料,在玻璃,肥皂,合成洗涤剂,造纸,防治等工业有着广泛的应用,人们最早使用的碱是天然碱。
18世纪后半叶,由于纺织业的发展,促使纯碱的需求量大增,原始的方法对于工业需求简直是杯水车薪,为此,1775年法国科学院悬赏10万元征求工业化的制碱方法。
后来分别发明了吕布兰制碱法,索尔维制碱法。
当时中国一穷二白,工业需要碳酸钠只能进口,那时钠碳酸钠叫“洋碱”1917年世界大战期间,因交通中断导致碳酸钠奇缺,靠进口的中国化学工业遭遇灭顶之灾。
1917年我们实业家范旭东和陈调莆创办了永利制碱公司,他们邀请了当时在美国攻读博士学位的侯德榜主持技术工作。
为了名族工业,侯德榜放弃了美国优厚的物质条件,然后回国创业。
当时外国工业垄断了制碱技术和市场,当时中国想买他们的技术,但是外国厂商百般刁难,漫天要价,怎么办,只能自力更生,于是侯德榜带领职工长期努力,终于解决了一些技术难题,与1924年生产出了一批纯碱,但是纯碱成暗红色,后来发现因为铁锈所导致的,经过努力,侯德榜终于找到了除去铁锈的方法,至此侯德榜终于掌握了索尔维制碱法的全部技术。

第四课时碳酸钠、碳酸氢钠与酸、碱、盐溶液的反应【明确学习目标】1.掌握碳酸钠、碳酸氢钠与酸、碱、盐的反应规律;2.能分析归纳碳酸铵、碳酸氢钠的鉴别方法及相互转化规律。
课前预习案【知识回顾】1.焰色反应是部分元素的性质,是变化;钠元素呈,钾元素的观察时必须用以,焰色呈。
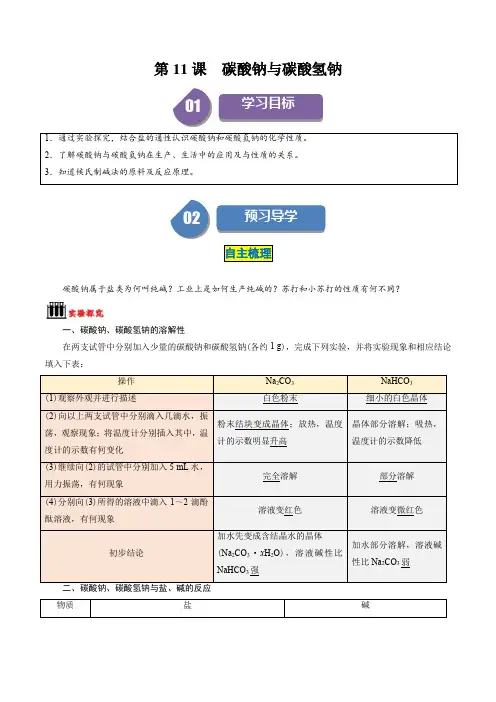
2. Na2CO3的水溶液碱性比NaHCO3;溶解性,固体溶于水放热明显的是。
受热易分解的是。
【新课预习】Na2CO3、NaHCO3的溶液1.各加入足量的HCl的化学和离子方程式2.各加入Ca(OH)2溶液的化学和离子方程式3.各加入CaCl2溶液的化学和离子方程式课堂探究案【实验探究一】与酸的反应在甲、乙两支试管中分别加入足量稀盐酸,将两个分别装有Na2CO3或NaHCO3粉末的小气球分别套在两支试管口。
将气球内的Na2CO3或NaHCO3倒入试管中(如图).(1)为使实验结果具有说服力,该对比实验要求控制的条件是、、等;(2)该实验看到的现象是、,乙试管中发生反应的离子方程式是;(3)泡沫灭火器是利用碳酸盐在酸性条件下反应生成CO2.由上述现象分析,若选用Na2CO3或NaHCO3中的一种作为泡沫灭火器中的一种反应物,应选,理由是。
【思考】1.Na2CO3溶液中滴加稀盐酸,现象是,反应的离子方程式是;稀盐酸溶液中滴加Na2CO3溶液,现象是:,反应的离子方程式是。
NaHCO3溶液中滴加稀盐酸,现象是:,离子方程式是。
2.等质量的上述两种盐,与足量的盐酸反应,产生气体多的是;一定量的盐酸与足量的两种盐反应,产生气体多的是。
3.NaOH和Na2CO3溶液中滴加稀盐酸,画出气体产生与盐酸的滴加关系曲线:总结:(1)碳酸盐和酸的反应分步进行,首先生成酸式根,最后生成相应的酸或其对应氧化物。
(2) Na2CO3溶液中滴加稀盐酸,现象是,稀盐酸溶液中滴加Na2CO3溶液,现象是:,可用于区分两无色溶液。
(3) NaHCO3与酸反应比Na2CO3;等质量的两种盐,耗酸多的是,产生CO2多的是。
(4)向含有OH—和CO32—溶液中加入酸,H+ 优先和反应。
例1.现有120ml含有0.2mol的Na2CO3溶液和200ml未知浓度的稀盐酸,不管将前者滴加入后者,还是后者滴加入前者,都有气体生成,但最终生成的气体体积相同,则稀盐酸的浓度合理范围是;若都有气体生成,产生的气体体积最终不同,则稀盐酸的浓度合理范是。
【探究二】与碱、盐的反应1.把NaOH分别加入到 Na2CO3、NaHCO3的溶液中,现象是,发生反应的是,离子反应方程式。
若把NaOH换成Ca(OH)2或Ba(OH)2,分析现象并写出离子反应方程式?2.把CaCl2或BaCl2溶液滴入Na2CO3、NaHCO3的溶液中,发生反应的是,离子反应方程式、。
【思维提升】1.Na2CO3和NaHCO3相互转化2.碳酸钠和碳酸氢钠的鉴别⑴都为固体时,你能想到哪些方法来鉴别?⑵都是溶液时,你能想到哪些方法来鉴别?例2.某碳酸钠溶液中可能含有碳酸氢钠,如何证明是否含有碳酸氢钠,用流程图表示:课后练习案1.老师在课堂上出示两瓶失去标签的Na2CO3和NaHCO3无色饱和溶液,希望班里同学提出简便的鉴别方法,该班同学踊跃提出看法,其中不合理的是()①用干燥的pH试纸检验,pH大的是Na2CO3②取同量的溶液于两支试管中,各滴入酚酞试液,红色较深的是Na2CO3③取同量的溶液于两支试管中,加热,有气泡产生的是NaHCO3④取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3⑤取同量的溶液于两支试管中,滴加BaCl2溶液,生成白色沉淀的是Na2CO3⑥取同量的溶液于两支试管中,滴加Ba(OH)2溶液,生成白色沉淀的是Na2CO3A.①② B.③⑥ C.④⑤ D.②⑤2.为除去括号中的杂质,所用的试剂或方法不正确的是()A.Na2CO3 溶液(NaHCO3),加入适量的NaOH溶液B.NaHCO3溶液(Na2CO3),通入过量的CO2气体C.Na2O2 粉末(Na2O),将混合物在空气中加热D.Na2CO3 溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤3.下列方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3的质量分数的()A.取ag混合物充分加热,减少bgB.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体C.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bgD.取ag混合物与足量稀氢氧化钡溶液反应,过滤、洗涤、烘干,得bg固体4.在标准状况下进行下列实验:甲、乙各取30.0ml同浓度的盐酸,加入同一镁-铝合金粉末产生气体,有关数据列表如下:实验序号甲乙丙合金质量/mg 255 385 510气体体积/ml 280 336 336(1)盐酸的物质的量浓度为______ mol/L,在表中可作为计算依据的是______ (填实验序号,符合要求的全部写出)(2)据_____(填实验序号)中的数据,可计算此镁-铝合金中镁与铝的物质的量之比_____。
(3)在乙实验中,可以判断______A、金属过量B、恰好反应C、金属不足D、无法判断(4)在丙实验之后,向容器中加入一定量的 1.00mol/l的NaOH溶液能使合金中的铝粉恰好完全溶解,再过滤出不溶性的固体,请填下表:滤液中的溶质NaCl NaAlO2对应物质的量/mol加入NaOH溶液的体积/ml5.某学生拟用50mL N aOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量而生成NaHCO3,他设计了如下实验步骤:①取25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;②小心煮沸溶液1~2分钟排出溶液中溶解的二氧化碳气体;③在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
(1)他能否制得较纯净的Na2CO3?______.理由是_______________________________。
按它的设计,第①步实验装置如图所示:(2)装置A使用的试剂是石灰石和盐酸溶液.可否使用纯碱代替石灰石?______,原因是_____________________________________________________________。
(3)装置B使用的试剂是______,作用是_________________________________________。
(4)有人认为实验步骤②③的顺序对调,即先混合,再煮沸,更合理,你认为对吗?为什么?____________________________________________________________。
6.实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物 5.0g,溶于水中,配成250mL溶液。
方案一:沉淀法.利用化学反应把HCO3-、CO32-完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中w(Na2CO3).(1)量取100mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选用的试剂是______(填编号).A.CaCl2溶液 B.MgSO4溶液 C.NaCl溶液 D.Ba(OH)2溶液(2)简述证明HCO3-、CO32-已完全沉淀的实验操作_______________________________。
(3)过滤,提取沉淀,则过滤操作所需要的玻璃仪器除烧杯外,还有______.(4)将沉淀洗涤,并充分干燥,称量沉淀的质量为mg,由此可以计算w(Na2CO3).如果此步中,沉淀未干燥充分就称量,则测得w(Na2CO3)______(填偏大或偏小、无影响)。
方案二:量气法.量取10.00mL配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积,由此计算混合物中w(Na2CO3).(1)装置中导管a的作用是____________________________________。
(2)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:①__________________,②_________________,③眼睛视线与液面最低处相平。
(3)实验前后碱式滴定管中液面读数分别为V1mL、V2mL.则产生CO2的体积为_____mL。
方案三:质量法,按如下图所示的实验流程进行实验:(1)实验时,蒸发结晶操作中,除了酒精灯外,还要用到的仪器是_________________ (2)有同学认为“加入适量盐酸”不好操控,应改为“过量盐酸”,便于操作且不影响测定的准确性,你认为对或错_____,为什么________________________________________ (3)若实验中测得样品质量为46.4g,固体质量为40.95g,则碳酸钠的质量分数为________.(保留3位有效数字)(4)蒸发结晶过程中若有固体飞溅,测得碳酸钠的质量分数________(填偏大偏小无影响).7.为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下,请回答:(1)仪器a的名称是___(2)装置B中冰水的作用是___(3)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是___A.样品分解不完全B.装置B、C之间缺少CO2的干燥装置C.产生CO2气体的速率太快,没有被碱石灰完全吸收D.反应完全后停止加热,通入过量的空气.8.实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。
为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:①取25mL甲溶液,向其中缓慢滴入乙溶液15mL,共收集到112mL(标准状况)气体。
②取15mL乙溶液,向其中缓慢滴入甲溶液25mL,共收集到56mL(标准状况)气体。
(1)判断:甲是_______________溶液,乙是____________溶液;(均填化学式)(2)②实验中所发生反应的离子方程式为:____________________________________ ;(3)甲溶液的物质的量浓度为_________mol/L,乙溶液的物质的量浓度为______mol/L。