碳酸钠与碳酸氢钠稳定性装置图
- 格式:docx
- 大小:35.82 KB
- 文档页数:1

碳酸钠碳酸氢钠热稳定性实验的改进何亦飞浙江省龙游县湖镇中学(324401) 现行高中化学第一册(必修)第104页,在[实验4-6]验证碳酸钠和碳酸氢钠受热变化的实验时,通常按教材中的装置分步进行。
笔者认为运用该装置进行实验,操作不大方便,实验时间长,且对比不很明显。
据此,我们对该实验装置作如下改进。
a.实验装置如图1。
b.操作过程如下。
①按图1装置好仪器,并检查装置的气密性。
②取下该装置,在具支试管及小试管内分别加入等量的(2~3g)碳酸钠和碳酸氢钠粉末,并在干燥管内加入适量的无水硫酸铜粉末,管口处放入一小团脱脂棉,然后在烧杯1和烧杯2内倒入澄清的石灰水,重新搭好装置。
③用酒精灯在具支试管下部加热,约2~3min,随之观察到烧杯1中出现少量气泡(空气膨胀缘故),石灰水无变化;与此同时,在烧杯2内有较多的气泡出现,石灰水明显变浑浊。
同时干燥管内的硫酸铜粉末变成蓝色。
由此证明,碳酸钠受热很稳定,没有变化,而碳酸氢钠不稳定,受热易分解生成二氧化碳和水。
改进后的演示实验装置将装有碳酸氢钠粉末的小试管插入具支试管内,同时加热,使碳酸钠直接受热,而碳酸氢钠间接受热,对比效果更好,现象明显、直观,学生印象加深;实验装置简单易行。
图1 碳酸钠和碳酸氢钠热稳定性实验装置解决此问题时,就会产生探究新规律的强烈欲望,变被动学习为主动探索,学生很自然的进入探索情境。
又如在讲解大气压强时,除做课本P126图11-24,图11-25演示实验外,适当增加演示实验“空杯吸水”(图2)。
取一盘,装水(不要太满),点燃蜡烛扣上空杯,盘中水少了,何故?演示“小试管向上爬行”(图3),大试管内的水徐徐流出小试管自动上升,何故?这样使教学过程成为一种渴望以及不断探索真理的带有情景色彩的意向活动,强烈地激发了学生求知欲望,教师教的得法,学生学得有味,轻松地进入探索创新的高潮。
苏联心理学家列・符・赞可夫经过20年的教改实践得出结论:“教学法一旦触及学生的情绪和意向领域,触及学生的精神需要,这种教学法就能发挥高度有效的作用”。




借助传感器探究碳酸钠与碳酸氢钠的热稳定性作者:徐建菊吴晓红来源:《化学教学》2019年第04期摘要:对酒精灯加热条件下碳酸钠与碳酸氢钠时导管插入澄清石灰水均出现浑浊的现象,进行理论分析并设计实验进行探究。
用二氧化碳传感器测定在酒精灯加热条件下,碳酸钠、碳酸氢钠试样及灼烧约1小时的碳酸氢钠密闭体系内二氧化碳浓度的变化情况。
结果表明,用酒精灯加热时,碳酸氢钠不稳定易分解,而碳酸钠很稳定不易分解。
通过分析此现象,有助于深化学生对碳酸钠与碳酸氢钠热稳定性的理解。
关键词:碳酸钠; 碳酸氢钠; 热稳定性; 二氧化碳传感器; 实验探究文章编号: 10056629(2019)4006304中图分类号: G633.8文献标识码: B1 问题的提出《普通高中化学课程标准(2017年版)》在对素养4“科学探究与创新意识”划分的水平4中指出“能用数据、图表、符号等处理实验信息;能对实验中的‘异常’现象和已有结论进行反思、提出质疑和新的实验设想,并进一步付诸实施”[1]。
由此可知实验过程中出现的“异常现象”隐含着可挖掘的潜在知识和价值。
笔者在进行碳酸钠与碳酸氢钠热稳定性区别的实验时发现了“异常现象”,即酒精灯在加热碳酸钠和碳酸氢钠固体时,将导管插入澄清石灰水中,澄清石灰水都变浑浊了。
对于碳酸钠和碳酸氢钠热稳定性的比较,人教版高中化学教材安排在“科学探究”栏目中,进行套管实验,实验过程中师生一起得出关于碳酸钠和碳酸氢钠的热稳定性,即碳酸钠加热不分解,碳酸氢钠加热易分解[2];鲁科版高中化学教材安排在“活动·探究”栏目中,得出的结论是:“实验表明,在酒精灯加热的条件下,碳酸钠不能分解,而碳酸氢钠能分解生成碳酸钠、水和二氧化碳”[3];苏教版高中化学教材安排在“活动与探究”栏目中,通过实验得出关于碳酸钠和碳酸氢钠的化学性质对比的表格,表格中关于二者热稳定性是这样描述的:“碳酸钠稳定、碳酸氢钠不稳定”[4]。
三个版本教材在对于二者热稳定性的描述中都能得出碳酸钠稳定而碳酸氢钠不稳定这一说法,可见笔者所得实验现象与教材描述不相符。

细说碳酸氢钠与碳酸钠的鉴别《实验教学与仪器》(长沙)2007年6期34页上,有“用CaCl2溶液区分NaHCO3和Na2CO3溶液”为题的一篇文章。
我的基本观点认为,用CaCl2溶液作为NaHCO3和Na2CO3的区分试剂的方法欠妥。
1.Na2CO3和NaHCO3的一般鉴别方法(1)如果两种试样都是固体——用加热法量多(如有数克或更多)能受热分解,放出的气体能使澄清石灰水变混浊的是NaHCO3,不能受热分解的是Na2CO3.量少,甚至是微量(如米粒、绿豆、芝麻量大小)按图l所示装置,微微加热样品4s~5s,稍稍用力挤压乳胶头,让滴管尖端悬上一滴饱和石灰水,几秒钟之后,又让石灰水滴回吸到滴管内,可形成一段白色浑浊的液柱的是NaHCO3,没有这种现象发生的是Na2CO3.(2)如果两种试样都是溶液试样浓度较大:两个试管各取1mL~2m1.样液,分别加入l~2滴酚酞试液,溶液显粉红色的是NaHCO3,色泽呈深红色的是Na2CO3。
试样浓度较小:两个试管各取1mL~2mL样液,各加入1~2滴酚酞试液,溶液都呈不易分辨的浅红色。
当把两种溶液都加热煮沸,色泽由浅(红)变深(红)的是NaHCO3,没有色泽变化的是Na2CO3. 2NaHCO3=Na2CO3 + H2O+CO2↑2.细说NaHCO3与Na2CO3的鉴别大家知道,比较NaHCO3和Na2CO3的性质,有两个最显著的差别:一是NaHCO3有对热的不稳定性,受热极易分解(在空气中会缓慢分解,65℃以上迅速分解),而Na2CO3则有极高的热稳定性;二是NaHCO3水解仅显极弱的碱性(0.1mol/L NaHCO3溶液的pH=8.31),刚好在酚酞的变色范围(酚酞的变色范围是pH=8.1~10.0),仅显极浅的粉红色,而Na2CO3水解则显较强的碱性(0.1mol/LNa2CO3,溶液的pH=11.63),遇酚酞显鲜艳的红色。
显然,NaHCO3与Na2CO3这种性质上的差别,就成为这两种物质鉴别(区分)的最为可靠的理论支持和方法依据。




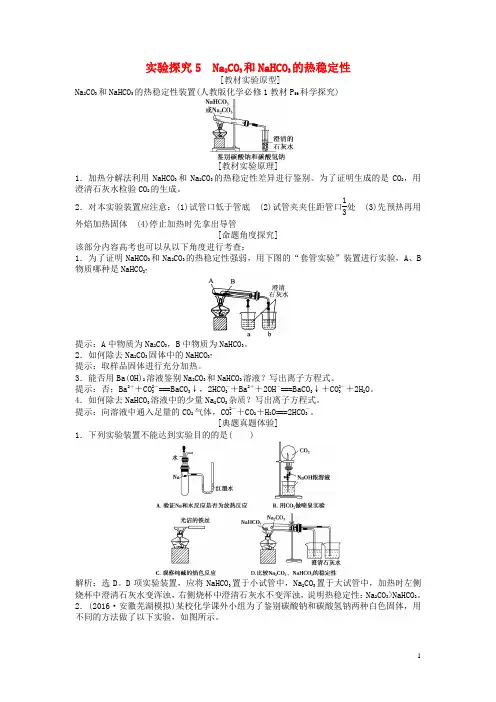
实验探究5 Na 2CO 3和NaHCO 3的热稳定性[教材实验原型]Na 2CO 3和NaHCO 3的热稳定性装置(人教版化学必修1教材P 56科学探究)[教材实验原理]1.加热分解法利用NaHCO 3和Na 2CO 3的热稳定性差异进行鉴别。
为了证明生成的是CO 2,用澄清石灰水检验CO 2的生成。
2.对本实验装置应注意:(1)试管口低于管底 (2)试管夹夹住距管口13处 (3)先预热再用外焰加热固体 (4)停止加热时先拿出导管[命题角度探究]该部分内容高考也可以从以下角度进行考查:1.为了证明NaHCO 3和Na 2CO 3的热稳定性强弱,用下图的“套管实验”装置进行实验,A 、B 物质哪种是NaHCO 3?提示:A 中物质为Na 2CO 3,B 中物质为NaHCO 3。
2.如何除去Na 2CO 3固体中的NaHCO 3?提示:取样品固体进行充分加热。
3.能否用Ba(OH)2溶液鉴别Na 2CO 3和NaHCO 3溶液?写出离子方程式。
提示:否;Ba 2++CO 2-3===BaCO 3↓,2HCO -3+Ba 2++2OH -===BaCO 3↓+CO 2-3+2H 2O 。
4.如何除去NaHCO 3溶液中的少量Na 2CO 3杂质?写出离子方程式。
提示:向溶液中通入足量的CO 2气体,CO 2-3+CO 2+H 2O===2HCO -3。
[典题真题体验]1.下列实验装置不能达到实验目的的是( )解析:选D 。
D 项实验装置,应将NaHCO 3置于小试管中,Na 2CO 3置于大试管中,加热时左侧烧杯中澄清石灰水变浑浊,右侧烧杯中澄清石灰水不变浑浊,说明热稳定性:Na 2CO 3>NaHCO 3。
2.(2016·安徽芜湖模拟)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________。
中教学参考ZH O N (;M E H l'A M 'E JIA O X I'E C ANKAO』2020年第1 1期 (总第530期〉-实验园地mKKKKtKKmmmmmmmmmmm磷酸物和礞酸氢納热稳定性实验改进蔡志武(贵州省瓮安中学贵州瓮安550400)文章编号:1002-2201 (2020) 114X )70^02人教版化学必修1,第三章金属及其化合物的第二 节“几种重要的金属化合物”中,碳酸钠和碳酸氢钠的性 质比较实验(2)中,教材用相同的装置分别对碳酸钠和 碳酸氢钠进行热稳定性实验,耗时、繁琐,并且不能保证 两次实验的条件完全相同。
为此,不少教师对碳酸钠和 碳酸氢钠热稳定性的实验装置进行了改进,最常见的就 是采用内外双导管实验,但是该装置因为需要将配套的 大小橡皮塞固定在同一根导管上而使实验的准备工作 量大大增加,组装不简便,拆卸时试管、导管易损坏,也 不利于连续进行课题演示。
―、提出的问题有关的期刊、教参和网络等介绍了很多碳酸钠和碳 酸氢钠热稳定性实验改进的方案,下面是最近几年的几 种改进实验。
1.重庆市清华中学文继明和于玲玲两位老师利用双试管实验[2],对碳酸钠和碳酸氢钠热稳定性实验进行 了改进,实验装置如图1所示。
中图分类号:G 633.8文献标识码:B橡皮筋.澄清石灰水图1实验装置12.安徽淮南二中王开华和周彦两位老师设计U 形管改进实验[2],对碳酸钠和碳酸氢钠热稳定性实验进行 了改进,实验装置如图2所示。
3.江苏徐州市鼓楼区教研室徐立铭老师和江苏徐 州市西苑中学李德前老师设计了 V 型管实验,对碳酸 钠和碳酸氢钠热稳定性实验进行了改进,实验装置如图 3所示。
以上这几种碳酸钠和碳酸氢钠热稳定性的实验改 进,都存在问题或不足:第一,以上改进装置都需要酒精 灯直接加热,由于酒精灯火焰面积受限和火焰摆动等原 因,会导致两个仪器或两个部位受热条件不好控制,受 热环境可能还是不相同,同时由于是酒精灯直接加热, 加热或拆卸装置时处理不当就可能使玻璃仪器损坏或 受热发生炸裂。