化学平衡移动第二课时资料
- 格式:ppt
- 大小:734.00 KB
- 文档页数:8



化学平衡的移动教案(第二课时)教学目标:1.知道化学平衡移动的概念;理解影响化学平衡的条件及勒夏特列原理2.通过活动与探究掌握条件对化学平衡的影响,并提高归纳思维能力。
3.通过化学平衡的学习,使学生进一步了解化学反应的实质,加强对化学理论的学习,培养正确的化学思维和科学态度。
教学重点: 化学平衡移动原理,理解影响化学平衡的条件及勒夏特列原理 教学难点:化学平衡移动原理的应用教学方法:实验探究、交流与讨论、归纳总结、练习教学过程:复习化学平衡的移动的概念,原因,及浓度和压强对平衡移动的影响1、概念:改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程。
2、移动的原因:外界条件发生变化。
3影响化学平衡移动的条件一、浓度变化对化学平衡的影响:增大浓度,加快反应速率;减小浓度,减慢反应速率①增大反应物浓度或减小生成物浓度,平衡向正方向移动 ②增大生成物浓度或减小反应物浓度,平衡向逆方向移动二、压强变化对化学平衡的影响(对于有气体参加的反应)增大压强,可以加快反应速率①增大压强,化学平衡向着气体分子数目减少的方向移动;②减小压强,化学平衡向着气体分子数目增多的方向移动。
③对于反应前后气体分子数目不变的反应,改变压强平衡不移动三、温度变化对化学平衡的影响 【讲解】:温度的改变对正逆反应速率都会产生影响,但影响的程度不同,温度的变化对吸热反应的速率比放热反应的速率影响大。
旧平衡 V 正=V 逆条件改变v 正≠v 逆一段时间后 新平衡V '正=V '逆温度的变化对化学平衡的影响:学生完成课本P54活动与探究:学生说【结论】:具体表现在:升高温度,正逆反应速率都增大,但增大的倍数不一样,吸热反应增大的倍数大。
降低温度,正逆反应速率都减小,但降低的倍数不一样,吸热反应降低的倍数大。
结论:在其他条件不变时,温度升高,会使化学平衡向吸热反应的方向移动, 温度降低会使化学平衡向放热的方向移动。
注意: 温度的变化一定会影响化学平衡,使平衡发生移动 【练习】在高温下,反应2HBr H 2+Br 2(正反应为吸热反应)要使混合气体颜色加深,可采取的方法是( ) A 、保持容积不变,加入HBr(g) B 、降低温度 C 、升高温度D 、保持容积不变,加入H 2(g)四、催化剂对化学平衡的影响t 时间加入正催化剂V速率V 正V 逆V 逆= V 正′′❖催化剂同等程度的改变正、逆反应速率(V 正=V 逆)❖使用催化剂,对化学平衡无影响。


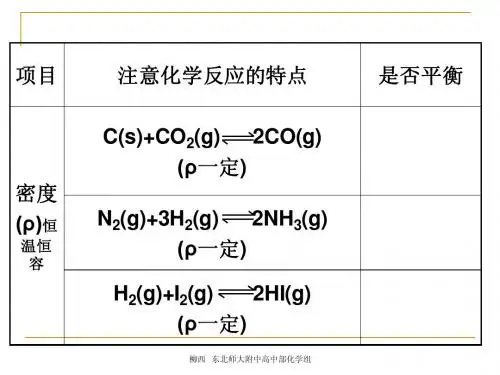
高中化学选修4专题二学案(8)HNO(g) +CO(g)NO(g) + CO(g) 1/2N练习(8)化学平衡的移动(二)1.某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)2C(g)达到平衡时,各物质的物质的量之比是n(A)∶n(B) ∶n(C)=2∶2∶l 。
保持温度不变,以2∶2∶1的物质的量之比再充入A ,B ,C ,则 ( ) A .平衡向正方向移动 B .平衡不发生移动C .C 的体积分数减小D .C 的体积分数不变2.对于反应2SO 2+O22SO 3,下列判断正确的是( )A 、2体积SO 2与足量O 2反应,必定生成2体积SO 3B 、其它条件不变,增大压强,平衡必定向右移动C 、平衡时,SO 2消耗速率必定等于O 2生成速率的两倍D 、平衡时,SO 2浓度必定等于O 2浓度的两倍 3.某温度下,反应H 2(g)+I 2(g)2HI(g);△H>0(正反应为吸热反应)。
在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是( ) A .恒温,压缩体积,平衡不移动,混合气体颜色加深 B .恒压,充入HI (g ),开始时逆反应速率变大 C .恒容,升高温度,正反应速率减小D .恒容,充入H 2,I 2(g )的体积分数降低 4.化学反应C(s)+H 22(g) △H>0达到平衡,下列叙述正确的是( )A .升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动B .加入固体炭,平衡向正反应方向移动C .加入水蒸气使容器内压强增大,平衡向逆反应方向移动D .扩大容器的容积,平衡向正反应方向移动 5.乙酸蒸气能形成二聚分子: 2CH 3COOH(气3COOH)2(气) △H<0。
现欲测定乙酸的分子量,应采用的反应条件是( )A.低温高压B.高温低压C.低温低压D.高温高压 6.反应 X(气)+ Y(气气) △H<0,在一定条件下,反应物Y 的转化率与反应时间(t )的关系如右图所示。
![高二化学最新课件-新人教[整理]化学平衡移动(第二课时](https://uimg.taocdn.com/4835951ede80d4d8d15a4f84.webp)

