一步酶法生产 7-ACA
- 格式:doc
- 大小:76.00 KB
- 文档页数:4

7-aca生产工艺7-ACA(7-氨基己酸)是一种合成药物中的重要原料,广泛应用于抗生素、激素和维生素等领域。
以下是关于7-ACA生产工艺的简要介绍。
7-ACA的生产工艺主要包括发酵法和化学合成法两种方法。
其中,发酵法是目前应用较广泛的一种方法,下面将重点介绍发酵法的生产工艺。
发酵法生产7-ACA的基本流程如下:1. 选取适宜的微生物菌种。
常用的微生物菌种包括放线菌和真菌等,如链霉菌属、芽孢杆菌属和链格孢菌属等。
2. 制备发酵种子。
将选定的菌种接种到合适的培养基中进行预培养,然后将预培养的菌种移植到大规模发酵罐中进行培养,制备发酵种子。
3. 进行大规模发酵。
将制备好的发酵种子转移到大规模发酵罐中,套用一定的发酵工艺参数,包括温度、pH、气体的流速和进料的配比等。
发酵过程中要控制好氧化还原电位,避免杂质的产生。
4. 提取和纯化。
发酵结束后,将发酵液进行提取和纯化。
一般采用浓缩、萃取、结晶、过滤和干燥等工艺步骤,获得7-ACA的初步产品。
5. 最后的纯化和精制。
利用溶剂萃取、结晶、吸附等工艺步骤对初步产品进行纯化和精制,获得高纯度的7-ACA。
发酵法生产7-ACA的优点是通过微生物的发酵作用,不仅可以合成目标化合物,还可以在发酵过程中产生辅助代谢产物,从而提高药物的产率和质量。
此外,发酵法也具有环境友好、无毒副作用等优势。
需要注意的是,7-ACA的发酵工艺受到多个因素的影响,包括微生物菌种的选择、培养基的组成和工艺参数的调节等。
因此,在实际生产中需要进行有效的工艺优化和控制,以提高产量和质量。
总结起来,7-ACA的生产工艺主要包括发酵法和化学合成法两种方法,其中发酵法是较为常用的一种方法。
该方法通过选取适宜的微生物菌种,进行发酵和提取纯化等步骤,最终获得高纯度的7-ACA产品。
发酵法具有优点如高产率、环境友好等,但在实际生产中需要进行工艺优化和控制。

酶法合成7—ACA及头孢菌素类抗生素的研究进展作者:王俏来源:《中国科技博览》2015年第04期[摘要]在当前的抗生素药物市场中,头孢是一类较为常见的药物,应用范围也十分广泛。
为了能够提高头孢菌素类抗生素生产效益,人们也在不断的研发新的生产工艺。
最初的头孢类抗生素制备工艺主要是化学合成法,近些年,酶法合成工艺的应用也越来越广泛,已经逐渐成为主流的制备工艺。
现本文通过详细分析酶法合成7-ACA的工艺方法,来探究酶法合成工艺在不同头孢菌素类抗生素制备中的应用。
[关键词]酶法;7-ACA;头孢菌素类;抗生素;制备工艺中图分类号:P314 文献标识码:A 文章编号:1009-914X(2015)04-0348-01与传统的化学合成方法相比,采用酶法合成头孢类抗生素药物更为高效环保。
这是因为在酶法制备的过程中,无需使用有毒试剂,也减少了各种有毒废液的排放,并且其工艺操作更加简单,能够极大的提高生产效率。
事实上,酶法自从上世纪70年代起就已经开始被应用在抗生素药物制备中,但最初并未得到大规模的推广应用。
近些年,酶法合成工艺逐渐备受人们的重视,并逐渐开始进行大规模工业生产,成为未来头孢类抗生素工业生产的主要工艺方法。
而7-ACA作为头孢类抗生素的母核,在其生产合成过程中发挥了非常重要的作用,具有典型的代表意义,因此本文决定通过探析酶法合成7-ACA的工艺,来探讨其在头孢类抗生素生产中的研究进展。
1、酶法合成7-ACA的工艺分析7-ACA,即7-氨基头孢烷酸,是头孢菌素类抗生素的关键中间体,在其合成工艺中占有关键地位。
其合成工艺主要有化学合成法与酶法合成法两种。
其中前者的工业应用较为成熟,但是其合成的周期过长,反应步骤较多,且会产生污染环境的三废,而后者则不会出现这些问题,酶法合成不但周期短,反应温和,更重要是其不会产生污染物,在当前各行业都在提倡环保节能的社会发展形势下,酶法合成无疑更符合持续发展的要求。
目前酶法合成头孢菌素类抗生素可以采用两步酶法制备工艺,也可以采用一步酶法制备工艺。


7—ACA细菌内毒素检查方法探析作者:杨帅来源:《东方食疗与保健》2016年第10期[摘要]要建立药用的中间体7-ACA细菌内毒素检查方法。
本文是按照2010年的中国药典中的附录进行的本次试验分析,根据分析判定相应的结果。
研究结果表明了供试品溶液的浓度,如果浓度是1.25mg/ml的时候,就说明对细菌内毒素的检查是没有任何的干扰的,使用药用中间体7-ACA的检查方法是可行的。
[关键词]7-ACA;细菌内毒素;检查方法药用中间体7-ACA是一种头孢类的抗生素前身,这种头孢类的抗生素是合成的,没有将细菌内的毒素进行有效的去除。
内毒素就是一种威胁着人体生命安全的一种致病的因子,只要很少的内毒素就会引起生物或者是病理作用,因此现在7-ACA细菌内毒素的检查并且进行有效的控制,已经成为了研究的重点。
本文的研究中,考虑到7-ACA的PH比较低,仅仅在3.0-5.0之间,但是细菌内毒素比较适合的PH值是在6.0-8.0之间,因此就需要进行供试品的调节,需要调节到6.0-8.0之间,之后才能够开始进行检测。
一、材料药用中间体7-ACA,这一药品的批号分别是691312017、691312018和691312019。
鲎试剂1,这一试剂是TAL1,批号是1302130,是由湛江博康海洋生物有限责任公司制造的。
鲎试剂2,TAL2,湛江安度斯生物有限公司。
细菌内毒素工作标准品(CSE,中国食品药品生物检定院,批号为150601-201176,规格为100EU/支)。
细菌内毒素检测用水和碳酸钠。
二、方法和结果(一)鲎试剂的灵敏度复核在本次试验中使用的是2010年版本的中国药典中的第二部的附录进行的7-ACA细菌内毒素检查方法的研究,在试验的过程中,要求灵敏度要在0.5-2.0λ之间,具体的试验结果如表1所示:(二)供试品中细菌内毒素限制的确定在本次产品中使用的是药用中间体,从成品的注射剂上来说,使用的是通用量,通用量是在1h内输入的药量不能够超过1.2g,在计算的过程中使用的是通用的量,也就是说M=1.2g/(60kg·h)=20mg,(kg·h)。

一步酶法制备药物中间体7-氨基头孢烷酸赵玉新;户巧芬;刘治林【摘要】目的主要介绍一步酶法制备7-ACA较两步酶法的优势,重点探讨一步酶法制备7-ACA的酶解条件、纯化技术、结晶工艺.方法 7-ACA一步酶法和两步酶法的优势对比分析,酶的选择、一步酶法酶解反应条件、裂解液纯化技术、裂解液结晶技术的筛选.结果确定了酶解条件一反应温度20~25℃、PH8.5、时间60min,烷烃类萃取纯化条件、结晶条件.结论该方法制备的7-ACA质量好,收率高.【期刊名称】《中国抗生素杂志》【年(卷),期】2010(035)006【总页数】4页(P435-438)【关键词】7-氨基头孢烷酸(7-ACA);头孢菌素C;一步酶法;酶解条件;纯化技术;结晶工艺【作者】赵玉新;户巧芬;刘治林【作者单位】哈药集团制药总厂科研开发中心,哈尔滨,150046;哈药集团制药总厂科研开发中心,哈尔滨,150046;哈药集团制药总厂科研开发中心,哈尔滨,150046【正文语种】中文【中图分类】R978.1酶法制备7-ACA生产技术由于具备安全、环保和低成本优势,在当前国内应用十分广泛,而该技术中主要在产业化应用的是两步酶法技术,即通过D-氨基酸氧化酶、GL-7ACA酰化酶两步酶法实现酶法7-ACA的工业化制备,但存在酶解路线长、氧化条件控制难度大、设备条件高的缺点。
本文主要研究一步酶法的控制参数,并优化出最佳技术条件,见表1。
1 仪器与材料1.1 仪器与试药BIOTECH-2M生物酶反应器 (上海保兴生物设备工程有限公司);SHB-ⅢA循环水式多用真空泵(郑州长城科工贸有限公司);氨水(工业级)、EDTA-2Na(试剂) 、结晶助剂等。
1.2 酶的选择及活力检测方法1.2.1 酶的选择经过查阅国内外文献资料[1-3]及大量的试验筛选,采用头孢菌素C酰基转移酶(NRB-103)可以直接把CPC转换为7-ACA,不必进行GL-7-ACA转换的中间过程,反应效率相当于化学法,而且能得到质量良好7-ACA。

酶法合成7—ACA及头孢菌素类抗生素的研究进展作者:李秀娟申雪皎来源:《科学与财富》2016年第11期摘要:酶法合成7-ACA近年来不断的完善,合成的效率大大提高了,而且废气、废物以及废水的排放有效的减少了。
头孢菌素类抗生素在医药行业比较常见,这是一种常用的抗生素,在合成制备的过程中,需要保证安全性以及药效。
本文对酶法合成7-ACA及头孢菌素类抗生素的研究进展进行了分析与介绍,还介绍了几种常见的合成方法,希望对相关工作人员提供一定参考与帮助,从而促进我国医药行业更快的发展。
关键词:酶法合成;7-ACA;头孢菌素;抗生素;研究酶法合成是医药行业传统的合成方法,其最早出现在20世纪60年代末,迄今已发展了50余年,在20世纪90年代,研究出了酶缩合反应技术以及固定化酶技术,相关技术人员对配套技术也进行了完善,这位大规模药物工业生产创造了良好的条件,使得酶法合成头孢氨苄、阿莫西林有了突破性进展。
我国在酶法合成的研究上也取得了一定成绩,虽然与国外先进单位有着一定差距,但是也研究出了很多有效的大规模工业生产技术,促进了我国医药事业的发展,下面笔者对酶法合成7-ACA以及头孢菌素类抗生素进行简单介绍。
1 酶法合成7-ACA的酶法合成7-ACA是头孢菌素类抗生素生产过程中重要的母核,头孢菌素的结构如图1所示,其可以抑制肽转肽酶催化产生的转肽反应,从而保证线性高聚物无法交联形成网状结构,阻止了细胞壁的合成,会导致大量的细胞死亡。
7-ACA即7-氨基头孢烷酸,采用化学法进行工业生产时,多采用的是头孢菌素C钠盐进行生产,由于这种方法的工艺比较复杂,而且生产的成本也比较高,还会对周围环境造成污染,所以,相关工作人员会选用酶法裂解简化生产过程,在优化的过程中,有效提高了回收率,还提高了产品的质量,减少了成本以及对周围环境的影响。
1.1 酶法合成7-ACA在工业生产中,7-ACA多采用的是两步酶法制备法,头孢菌素C会在通氧的环境下与D-氨基酸氧化酶反应,发生催化反应,生成了一种具有酮基的中间体以及H2O2,由于中间体并不稳定,容易发生化学氧化从而出现脱羧,生成戊二酰基-7-氨基头孢烷酸,在酰化酶的作用下,还会脱去侧链,最终生成7-ACA。

7-ACA(7-氨基头孢烷酸)
7-ACA:7-氨基头孢烷酸,成品为白色结晶粉末,不溶于水及一般有机溶剂,为医药中间体,是许多半合成头孢菌素的起始原料。
7-氨基头孢烷酸是头孢菌素关键性中间体,是头孢菌素中最常用的母核,7-ACA有两个活性基团,3-位的乙酰氧基和7-位的氨基,在这两个活性基团上连接不同的侧链,就构成不同性质的头孢类抗生素。
头孢菌素C(CPC)是由头孢菌在玉米浆、淀粉、糊精、蛋氨酸、葡萄糖、豆油、CaCO3、MgSO4、(NH4)2SO4、FeSO4、MnSO4、ZnSO4、CuSO4组成的培养基中发酵得到。
7-ACA(7-氨基头孢烷酸)是通过头孢菌素C(CPC)裂解而成,按裂解方法的不同分为化学法和酶法。
化学法需要在极端条件下进行,而且使用大量有毒害的化学物品,给环境和人体带来很大的危害。
酶法分为一步法和两步法,酶法生产不含溶剂和重金属,质量高,生产占地面积小,但国内不具备酶的生产能力,依靠进口,价格较高。
大致流程:菌种发酵微滤超滤离子交换
脱色柱纳滤浓缩结晶干燥离心
酶水解7-ACA。

7-ACA7-ACA作为生产头孢类半合抗产品的重要中间体,近几年国内市场发展相当迅速。
从2001年起,国内7-ACA市场已经由三年前的80%依赖进口变为2003年的80%实现自供(见表1),其中15%出口国外。
去年下半年国内7-ACA价格大战使国外药企退却,充分显示出7-ACA 已成为国内继青钾盐、6-APA之后崛起的可以与国外抗衡的规模型强势原料品种。
国内外合成7-ACA的主要方法有四种:一是亚硝酰氯法,二是亚胺酸酯法,三是酶裂解法,四是青霉素合成法。
上述四种方法应用最为广泛的是利用头C原料进行亚胺酸酯法裂解和酶裂解法生产。
头C锌盐法因污染较大,收率较低,国外已淘汰。
鲁抗从1995年最早开始以头C锌盐法生产7-ACA,现阶段国内生产厂家大多采用头C钠盐化学裂解法生产7-ACA,该法也是国外生产7-ACA的主要方式,相比于头C锌盐,收率较高,质量较好。
国内7-ACA市场发展历程虽然较短,但生产集中度已经较高,主要集中在石药、福抗、鲁抗和哈药几家,2003年产量比重占国内总量的97%。
按照2003年国内7-ACA下游头孢链产品产量计算,7-ACA年需求量在1500吨左右,国产7-ACA已基本满足市场需求。
近一段时间,市场传闻部分厂家又在大规模上马7-ACA项目,加之早在去年就已传开有些企业已具备千吨7-ACA产能,可以预见7-ACA产能已超过实际需求,随之而来的很有可能是重复2003年下半年的低价倾销竞争。
经过几年的市场挤压,化学法生产7-ACA的利润空间已经微乎其微。
由于7-ACA属于深冷裂解合成,生产过程毒性大、污染大、危险性大、过敏严重,防火、防爆、防毒等要求极高,一旦投产则需要承担较多的人力和物力管理风险。
尽管国内化学法生产7-ACA的产量越来越大,2003年国内产量已达1157吨,然而仍旧需要进口300余吨7-ACA来满足三代以上头孢合成的高质量需求。
由此看来,高含量(大于98%)、低残媒残留、低前体残留的高质量7-ACA还是有较好市场空间的。

第26卷 第1期中 南 林 学 院 学 报V o l.26 N o.1 2006年2月JOU RNAL O F CEN TRAL SOU TH FOR ESTR Y UN I V ER S IT Y Feb.2006 Ξ[文章编号]1000-2502(2006)01-0044-04国产固定化GL272A CA酰化酶制备72A CA的工艺优化莫章桦,刘友全,张小飞(中南林业科技大学生命科学与技术学院,湖南长沙410004)[摘 要] 通过对国产固定化GL272A CA酰化酶和游离酶的表观米氏常数(K m)及最大反应速度(V m)的测定.结果表明:固定化GL272A CA酰化酶的K m和V m值分别为8.69mmo l・L-1和76Λmo l・g-1m in-1,均较游离酶高;在对酶促反应的关键参数底物质量浓度、转化温度、转化pH进行优化后,用固定化GL272A CA酰化酶在底物GL272A CA质量浓度30g・L-1、转化温度25℃、转化pH8.0的条件下转化GL272A CA制备72A CA可连续操作150批以上,转化率和收率均达95%以上.[关键词] GL272A CA酰化酶;固定化酶;72A CA;酶促反应[中图分类号] Q978 [文献标识码] Opti m iza tion of Na tive I mm ob il ized G L-7-ACA Acyla se for7-ACAM O Zhang2hua,L I U You2quan,ZHAN G X iao2fei(Schoo l of L ife Science and T echno logy,Central South U niversity of Fo resty”T echno logy,Changsha410004,H unan,Ch ina)Abstract:T h is paper has deter m ined the K m and V m ax of native i m mobilized GL272A CA acylase and free enzym es.T he K m and V m ax ofi m mobilized GL272A CA acylase are8.69mmo l・L-1and76Λmo l・g-1m in-1respectively that are h igher than the free enzym es.T hekey param eters of enzym atic reacti on such as substrate concentrati on,temperature and pH value w ere investigated.U nder op ti m al conditi ons,native i m mobilized GL272A CA acylase fo r GL272A CA to72A CA can be used over150cycles at GL272A CA(30g・L-1, 25℃,pH8.0).T he conversi on rate and yield w ere all over95%.Key words:GL272A CA acylase;i m mobilized enzym e;72A CA;enzym atic reacti onΒ2内酰胺抗生素是广泛使用的最有效的抗菌药物,但随着这些抗菌素的使用,细菌对它们的耐药性日趋严重[1].抗生素改性——半合成青霉素(SSP)和半合成头孢菌素(SSC)的开发与生产是解决这一问题的主要途径[2].临床应用证明,半合成头孢菌素是一类抗菌谱广、抗菌活性强、疗效高、毒性低的抗生素[3],72氨基头孢烷酸(72Am inocep halo spo ran ic acid,72A CA)作为半合成头孢菌素的关键中间体,其生产工艺也成为近年来的研究热点[4].目前,72A CA的生产方法主要采用化学法,但是化学法生产72A CA须在超低温条件下进行,而且涉及到大量有毒有害的有机溶剂如三甲基氯硅烷、五氯化磷等的使用[5],因此化学法生产72A CA条件苛刻、过程复杂且污染环境,缺乏可持续发展的前景,而酶法生产条件温和、过程简单、污染小已使其有逐渐取代化学法之势.目前人们研究较多的是如图1所示的两步酶法制备72A CA,首先,D2氨基酸氧化酶(D2am ino acid ox idase, DAAO)催化氧化CPC产生酮酸中间体(ketoadi p yl72am inocephalo spo ran ic acid,keto272A CA)和双氧水,在双氧水存在下,中间体自发变成戊二酸单酰基272氨基头孢烷酸(glu taryl72am inocep halo spo ran ic acid,GL272 A CA),再由GL272A CA酰化酶(GL272A CA acylase)催化脱去侧链,生成72A CA[6].GL272A CA酰化酶是双酶法制备72A CA的第二步用酶,Sh ibuya等人在P seudom onas p u tida和P seudom onas SY27721中发现了GL272A CA酰化酶,并对该酶进行了分离纯化及酶学性质的研究[7].湖南福Ξ[收稿日期]2005207215[基金项目]2002年湖南省引导资金项目,2003年国家发改委高新技术产业化示范工程项目.[作者简介]莫章桦(1965-),男,湖南长沙人,高级工程师,博士研究生,主要从事微生物工程和酶工程研究工作.来格生物技术有限公司从国外引进了GL 272A CA 酰化酶产生菌——大肠杆菌基因工程菌并对其进行了培养和酶的分离、纯化与固定化.本文中对游离GL 272A CA 酰化酶和固定化GL 272A CA 酰化酶的表观米氏常数和最大反应速度进行了研究和比较,并对用固定化GL 272A CA 酰化酶制备72A CA 的几个关键参数(底物质量浓度、温度、pH 值等)进行优化,提供了较好的工艺线路,确保了酶的转化批次和提高了转化收率,为双酶法制备图1 两步酶法制备72A CA 的合成路线F ig .1 Enzy matic process to produce 7-ACA72A CA 全面实现产业化奠定了坚实的技术基础.1 材料与方法1.1 材料大肠杆菌基因工程菌GL 272A CA 酰化酶酶液和固定化GL 272A CA 酰化酶以及底物GL 272A CA 由湖南福来格生物技术有限公司提供;GL 272A CA 标准品和72A CA 标准品由石家庄制药集团中润有限公司提供;其余试剂均为国产市售分析纯商品.1.2 方法1.2.1 酶活力的测定精确量取一定量酶液或称取一定量固定化酶至50mL 烧杯中,加入预热到25℃的10mL 质量浓度为20g ・L -1的GL 272A CA 溶液,以500r ・m in -1的速度搅拌,并用0.1m o l LN aOH 溶液调酶-底物混合液pH 至8.0,使pH 为8.0保持3~5m in ,记录加碱量和反应时间.活力计算:单位酶量每分钟消耗1Λm o l N aOH 为一个单位;设25℃活力为W (Λm o l ・L -1m in -1或Λm o l ・g -1m in -1),则 W =(V 2-V 1)×C ×103(M in +S ÷60)×V 样G 样.式中:V 2为滴定完后滴定仪读数(mL );V 1为滴定前滴定仪读数(mL );C 为N aOH 溶液的浓度,为0.1mm o l ・mL -1;M in 为分时;S 为秒时;V 样为酶液样品体积(mL );G 样为固定化酶样品重量(g ).1.2.2 72A CA 含量测定及转化率、收率计算(1)H PL C 分析条件柱子:H ypersil BD S C 18,5u ,200×4.6;流动相:10%乙腈和pH 3.0缓冲液(V V )(3.4g 磷酸二氢钾溶于850mL 水,用85%磷酸调pH 至3.0,加100mL 乙腈,再用水加至1L );流速:1mL m in ;检测:UV 检测,254nm ;标准液:称12.5m gGL 272A CA 和72A CA ,分别加入到25mL 容量瓶中,加入20ΛL 85%磷酸,用流动相加至刻度,注射20ΛL 标准液,H PL C 测定3次,计算平均值;样品测定:取转化液0.5mL ,用流动相稀释至50mL ,注射20ΛL 进行H PL C 分析,根据标准液含量和峰面积以及样品峰面积计算样品含量;保留时间:GL 272A CA 12~13m in ,72A CA 2~3m in .(2)转化率及收率计算 转化率=转化后GL 272A CA 减少量(m o l )转化前GL 272A CA 初始量(m o l )×100%,收率=转化后72A CA 生成量(m o l )72A CA 理论生成量(m o l )×100%.1.2.3 转化反应将称量好的固定化GL 272A CA 酰化酶装入酶反应器中(酶投入量按5k Λ L 加入),加入1L 用去离子水配制好的质量浓度为20~40g L 的GL 272A CA 溶液,开启搅拌,控制温度15~35℃,滴加3m o l L 氨水,维持pH 7.0~9.0,至反应速度为初始速度的2%以下(或pH 3分钟内不再变化),停止反应,过滤.取起始样和终止样各0.5mL ,分别用流动相稀释至50mL ,进行H PL C 分析,计算转化率和收率.2 结果与分析2.1 GL 272A CA 酰化酶游离酶和固定化酶表观米氏常数及最大反应速度比较用不同质量浓度的GL 272A CA 溶液为底物,分别测定游离酶和固定化酶的酶活力(反应初速度),结果见54第1期莫章桦等:国产固定化GL 272A CA 酰化酶制备72A CA 的工艺优化表1、表2.用L inew eaver 2B u rk 双倒数法作图(见图1),分别求出表观米氏常数(K m )和最大反应速度(V m ).表1 固定化酶在不同GL 272A CA 底物质量浓度下测定的反应初速度Table 1 I n iti al reaction rate of i m m obilized enzy m e i n differen t substrate concen tration S G L 272ACA 质量浓度 (g ・L -1)20151052.51.250.625V 反应初速度 (Λmo l ・g -1m in -1)59.958.455.145.834.821.511.7根据图2回归直线方程计算(1 V =I V m +K m V m ×1 S ):固定化酶最大反应速度为76Λm o l ・g -1m in -1,表观米氏常数为8.69mm o l ・L -1;游离酶的最大反应速度为27.1Λm o l ・mL -1m in -1,表观米氏常数为4.57图2 固定化酶及游离酶表观米氏常数及最大反应速度测定F ig .2 K m and V m of i m m obilized G L -7-ACA Acylase and free enzy m e mm o l ・L -1.结果表明,游离酶固定化后表观米氏常数增大,这是固定化酶由于空间位阻和构象改变等原因所致.但并不是一般认为K m 越小越有利于反应,因为酶与底物亲和力的减少也是改善酶促反应的一个重要因素[8],因此采用固定化酶更能有效地催化反应.2.2 底物质量浓度对转化率和收率的影响将GL 272A CA 配成质量浓度为20、25、30、35、40g ・L -1的底物溶液,在pH 8.0、25℃条件下分别进行转化反应,表2 游离酶在不同GL 272A CA 底物质量浓度下测定的反应初速度 Table 2 I n iti al reaction rate of free enzy m e i ndifferen t substrate concen tration S G L 272ACA 质量浓度 (g・L -1)20151052.51.250.625V 反应初速度 (Λmo l ・g -1m in -1)24.724.023.119.716.211.37.1H PL C 分析计算转化率和收率(见图3).从图3可以看出,随着底物质量浓度的增加,转化率降低同步造成收率降低,这是由于随着反应的进行,较高质量浓度的底物将产生高浓度的产物抑制作用而不利于转化;而较低的底物质量浓度虽有利于转化,但由于会影响转化结束后的提取操作及结晶收率.因此,综合考虑底物质量浓度图3 底物浓度对转化率和收率的影响 F ig .3 Effects of substrate concen tration onconversion rate and y ield 控制在30g ・L -1左右为佳.2.3 转化温度对转化率和收率的影响在底物质量浓度30g ・L -1,pH 8.0条件下,分别控制温度为15、20、25、30、35℃进行转化反应,H PL C 分析计算转化率和收率(见图4).从图4可知,过低的转化温度会造成转化率偏低同步造成收率偏低,而且会使转化时间过长;相对较高的温度有利于转化率的提高,但温度较高同样会加速GL 272A CA 和72A CA 的降解从而使收率降低,而且较高的温度会影响酶的稳定性,不利于重复性多批次转化反应.因此综合分析,转化温度控图4 转化温度对转化率和收率的影响F ig .4 Effects of te m perature on conversion rate and y ield制25℃左右有利于酶促反应.2.4 转化pH 对转化率和收率的影响在底物质量浓度30g ・L -1,25℃条件下,分别控制转化pH 7.0、7.5、8.0、8.5、9.0进行转化反应,H PL C 分析计算转化率和收率(见图5)从图5可以看出,过低的pH 转化率和收率均明显偏低;相对较高的pH 有利于转化率的提高,但过高的pH 加速了GL 272A CA 和72A CA的降解,特别是pH 达到了9.0时将使收率明显64中 南 林 学 院 学 报第26卷降低,而且过高的pH 将影响酶的稳定性.因此综合考虑,转化pH 控制在8.0左右较好.图5 转化pH 对转化率和收率的影响F ig .5 Effects of pH on conversion rate and y ield 2.5 多批次转化反应中酶活力衰减及转化率、收率情况在优化转化条件下(GL 272A CA 质量浓度30g ・L -1,pH 8.0,25℃),按5k Λ・L -1加入固定化GL 272A CA 酰化酶进行多批次转化反应,记录每批H PL C 分析计算每批转化率和收率(见图6).从图6可知,整个转化反应重复进行了152批,在初始转化时间为90分钟左右时,固定化酶半衰期在152批以后,每批的转化率和收率均在95%以上,保持了较高的水平.结果充分表明:固定化GL 272A CA 酰化酶在优化转化条件下制备72A CA 具有较好的稳定性和较高的收率水平.图6 多批次转化酶活力衰减及转化率、收率情况F ig .6 Operational st ability of i m m obilized G L -7-ACA acylase for 7-ACA3 结 论固定化GL 272A CA 酰化酶米氏常数为8.69mm o l ・L -1,较游离酶为高,由于使用固定化酶进行转化有利于改善酶促反应,同时具有转化率高,副产品少,能重复多次使用以及后提取简单、产品质量好等优点,因此有利于大规模生产72A CA .用固定化GL 272A CA 酰化酶转化制备72A CA 过程中,反应转化率和收率受底物浓度、pH 值、温度的影响,控制底物质量浓度30g ・L -1左右、pH 8.0左右、温度25℃左右进行转化反应,转化率和收率均保持较高水平,可达95%以上.在优化转化条件下用固定化GL 272A CA 酰化酶转化制备72A CA ,在保证收率的前提下可连续重复转化152批以上,这和德国ROCH E 公司的水平相当,由于国产固定化酶的成本远远低于进口酶,因此用国产固定化GL 272A CA 酰化酶生产72A CA 已具备较充分的产业化条件.[参 考 文 献][1] 姜学军,张雨华,曲洪琴.世界青霉素工业的现状和发展趋势[J ].中国医药情报,1999,5(2):105.[2] 吴星佳,杨 晟,王 峥,等.Β-内酰胺抗生素工业中的酶工程[J ].世界科技研究发展,2001,23(1):8.[3] 罗 晖,李 强,童亿舟,等.酶法生产7-氨基头孢烷酸的研究进展[J ].现代化工,2002,22(12):18.[4] Chen J T ,L in S Y ,T sai H .Enzym atic and chem ical conversi ons of cephalo spo rin 2C to 72(glutarylam ido )cephalo spo ranic acid [J ].B i o techno logy,1991,19:234.[5] D aniela M onti,Giacomo Carrea,Sergi o R iva,et al .Characterizati on of an Industrial B i ocatalyst:I mmobilized Glutaryl 272A CA A cylase [J ]B i o techno logy and B i oengineering,2000,70(2):239.[6] 陈少欣,吴文琼,刘 晨,等.三角酵母D -氨基酸氧化酶的固定化研究[J ].中国医药工业杂志,2003,34(2):69.[7] 周宏伟,魏中荻,杨蕴刘,等.GL 272A CA 酰化酶的分离纯化及性质研究[J ].微生物学报,1997,37(3):196.[8] Shw etu S ,Bhat T K ,Gup ta M N ,et al .B i oaffinity i m mobilizati on of tannase from A spergillus niger on concanvalin A Sepharo se CL 24B [J ].B i o techno l.A pp l .B i ochem .,2002,35(3):165-169.[本文编校:谢荣秀]74第1期莫章桦等:国产固定化GL 272A CA 酰化酶制备72A CA 的工艺优化。
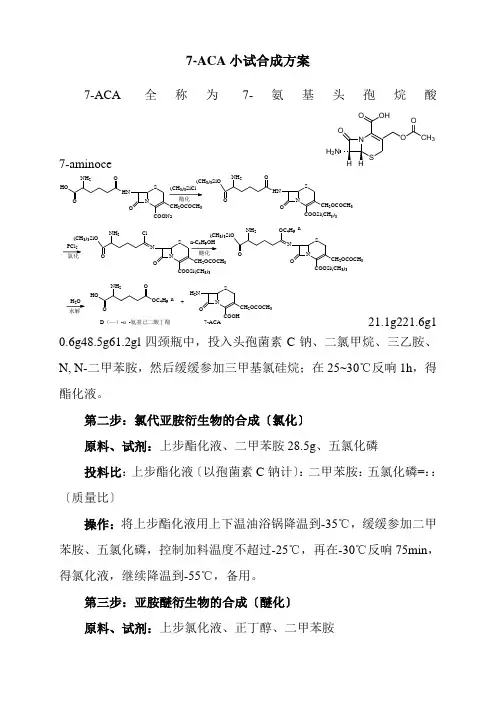
7-ACA 小试合成方案7-ACA 全称为7-氨基头孢烷酸7-aminoceH 2OCH 3OOO HONH 2NSOHNCH 2OCOCH 3COOSi(CH 3)3OO (CH 3)3SiONH 253O(CH 3)3SiO NH 2Cl NSONCH 2OCOCH 3COOSi(CH 3)3O(CH 3)3SiONH 2OC 4H 9-n 2NSO H 2N CH 2OCOCH 3COOH OOHONH 2OC 4H 9-n+D (—)-α-氨基己二酸丁酯7-ACA21.1g221.6g10.6g48.5g61.2gl 四颈瓶中,投入头孢菌素C 钠、二氯甲烷、三乙胺、N, N-二甲苯胺,然后缓缓参加三甲基氯硅烷;在25~30℃反响1h ,得酯化液。
第二步:氯代亚胺衍生物的合成〔氯化〕原料、试剂:上步酯化液、二甲苯胺28.5g 、五氯化磷投料比:上步酯化液〔以孢菌素C 钠计〕:二甲苯胺:五氯化磷=::〔质量比〕操作:将上步酯化液用上下温油浴锅降温到-35℃,缓缓参加二甲苯胺、五氯化磷,控制加料温度不超过-25℃,再在-30℃反响75min ,得氯化液,继续降温到-55℃,备用。
第三步:亚胺醚衍生物的合成〔醚化〕原料、试剂:上步氯化液、正丁醇、二甲苯胺投料比:上步氯化液〔以孢菌素C钠计〕:正丁醇=1:8:〔质量比〕操作:将正丁醇和二甲苯胺加到250ml圆底烧瓶中,降温至-55℃,缓缓加至降温到-55℃的氯化液中,控制加料温度在-25~-2021再在-30℃反响75min,得醚化液。
第四步:7-ACA的合成〔水解〕原料、试剂:上步醚化液、甲醇、水、浓氨水适量投料比:上步醚化液〔以孢菌素C钠计〕:甲醇:水:氨水=1:4:5:适量〔质量比〕操作:向醚化液中参加甲醇和水,于-10℃水解5min,加浓氨水调节in,放置结晶1h,抽滤,晶体分别用5%的甲醇水溶液、%的柠檬酸水溶液和丙酮洗涤,抽干,结晶转入培养皿,置真空枯燥器中,50℃枯燥8h,得7-ACA白色结晶。

7aca发酵工艺-回复什么是7aca发酵工艺?7aca发酵工艺是指利用微生物发酵过程生产7-氨基羟基丙酸(7aca)的技术。
7aca是一种重要的合成中间体,广泛用于制药、化妆品和农药等领域。
通过7aca发酵工艺,可以将廉价的酮酸底物转化为高附加值的7aca 产物,具有经济效益和环境友好性。
发酵工艺流程7aca发酵工艺包括发酵液的制备、发酵过程控制和分离纯化等步骤。
以下是7aca发酵工艺的详细流程。
1. 发酵菌种的选取:选择适合7aca生产的菌株,常用的菌株包括亚稳耐热链球菌和亚稳耐酸链球菌等。
2. 发酵基质的准备:酮酸为最常用的发酵底物,需要通过生化过程提取或化学合成获取。
甘油和其他有机底物也可作为基质。
3. 发酵液的制备:将选定的发酵菌株接种到含有酮酸基质的发酵培养基中,并进行适当的培养条件控制。
包括pH值、温度、氧气供应和营养成分的调节。
4. 发酵过程控制:通过调控发酵条件来提高7aca的产率和纯度。
优化pH 控制、氧气供应和营养成分的添加量等因素。
5. 发酵反应的监测:对发酵过程中的关键指标进行实时监测,如酮酸浓度、细胞密度和产物产量等。
6. 发酵液的分离纯化:将发酵液经过离心、超滤和蒸发等步骤进行固液分离,得到高纯度的7aca产物。
7. 产品的检测和分析:通过高效液相色谱(HPLC)、气相色谱(GC)和质谱等技术对7aca产物进行检测和纯度分析。
发酵工艺的关键因素在7aca发酵工艺中,有几个关键因素需要特别关注:1. 菌株的选择:不同的菌株对酮酸基质的利用能力和7aca产量有差异。
因此,选择适宜的菌株对工艺的成功与否至关重要。
2. 发酵条件的控制:pH值、温度和营养成分等发酵条件对菌株的生长和代谢过程起着重要调节作用。
通过优化这些参数,可以提高7aca的产量和纯度。
3. 氧合条件的控制:提供足够的氧气供应是7aca发酵过程中另一个关键因素。
合理的氧气供应可以提高酮酸的利用效率和7aca的产量。
7-ACA(7-氨基头孢烷酸)
7-ACA:7-氨基头孢烷酸,成品为白色结晶粉末,不溶于水及一般有机溶剂,为医药中间体,是许多半合成头孢菌素的起始原料。
7-氨基头孢烷酸是头孢菌素关键性中间体,是头孢菌素中最常用的母核,7-ACA有两个活性基团,3-位的乙酰氧基和7-位的氨基,在这两个活性基团上连接不同的侧链,就构成不同性质的头孢类抗生素。
头孢菌素C(CPC)是由头孢菌在玉米浆、淀粉、糊精、蛋氨酸、葡萄糖、豆油、CaCO3、MgSO4、(NH4)2SO4、FeSO4、MnSO4、ZnSO4、CuSO4组成的培养基中发酵得到。
7-ACA(7-氨基头孢烷酸)是通过头孢菌素C(CPC)裂解而成,按裂解方法的不同分为化学法和酶法。
化学法需要在极端条件下进行,而且使用大量有毒害的化学物品,给环境和人体带来很大的危害。
酶法分为一步法和两步法,酶法生产不含溶剂和重金属,质量高,生产占地面积小,但国内不具备酶的生产能力,依靠进口,价格较高。
大致流程:菌种发酵微滤超滤离子交换
脱色柱纳滤浓缩结晶干燥离心
酶水解7-ACA。
两步酶法生产 7-ACA 项目7-氨基头孢烷酸,简称7-ACA。
主要用于合成头孢唑啉、头孢噻肟、头孢哌酮、头孢曲松、头孢呋辛、头孢替安、头孢地嗉、头孢尼西、头孢噻吩等,其中以头孢唑啉用量最大。
项目内容泛球生物与国外合作伙伴开展两步酶法生产7-ACA 的技术研发工作, 完成了产D-氨基酸氧化酶和 GL-7-ACA 酰化酶基因工程菌的构建,发酵过程的优化,酶的提取和固定化,以及固定化酶催化头孢菌素 C 生产 7-ACA 工艺的优化等一系列基础工作,并完成了双酶法生产 7—ACA 的工业化试验,氧化酶和酰化酶发酵单位分别达到120U 和120U 以上, 固定化酶使用批次分别达到 200 批和300批以上, 7-ACA 收率达到 80%, 经过核算,不仅酶法成本大大项目低于现有化学法,而且产品质量也优于化学法.核心技术具有生物基因遗传育种技术、酶工程技术、膜技术、色谱层析技术、双酶法7-ACA 技术、二步发酵技术、直通工艺技术、流化床干燥技术等核心技术。
市场前景由于半合成抗生素具有较少副反应,较小毒性,较大抗病原专一性, 较宽抗菌谱和较好的药理学性能,已使其成为解决病菌抗药性的一种有效手段,正主导着目前的世界抗生素市场.在半合成抗生素中,半合成头孢菌素的比例占70%,而7-氨基头孢烷酸(7-ACA)是半合成头孢菌素的母核.近年来,亚洲(尤其是印度和中国)对头孢菌素生产开发的势头很猛, 全世界 7-ACA 的产量呈逐年上升的趋势,据统计,我国 7-ACA 的产量 2000 年为 237 吨,2001 年为 361 吨.而 2002 年至 2004 年的三年间分别为 868 吨,1130 吨,1480 吨,三年的年产量增长率高达 30.6%.因此,建设一条酶法年产500吨 7-ACA 的生产线是非常有竞争力的,具有非常好的市场前景.主要生产商健康元,华北制药,中润制药,福抗、鲁抗、哈药、浙江海正药业、山西威奇达药业、山东睿鹰制药,鲁南制药,齐鲁制药等。
一步酶法生产7-ACA的优点
7-氨基头孢烷酸(7-ACA)是生产头孢菌素类抗生素的重要母核,头孢菌素分子中由于都含有β-内酰胺结构。
它能抑制肽转肽酶所催化的转肽反应,使线性高聚物不能交联成网状结构,抑制粘肽的台成,从而阻止细胞壁的形成,导致细胞的死亡。
目前7-ACA生产采用新型酶法工艺,国内已成功开发出新型酶法7-ACA生产技术,打破国外对一步酶法生产
7-ACA技术的垄断。
而目前国内的生产厂家采用的双酶大多数是从国外进口的,成本与化学法不相上下。
通过本项目技术的使用大大降低7-ACA的成本,从而获得成本优势。
新型酶法较好解决了旧酶法技术生产7-ACA在质量、色泽上劣于化学法的问题,同时在生产上的使用批次也大幅度增加,从而也降低了生产成本。
7-ACA和头孢菌素的合成工艺主要有化学法和酶法两种。
化学半合成技术主要包括酰氯法和混酐法,化学法合成存在着活化、缩合、保护和去保护的过程;合成过程长、步骤多反应条件苛刻产生大量的三废等弊端,而酶法合成工艺与化学法相比,由于具有许多优点,如:生产工艺简单,周期短;反应条件温和,pH接近中性;高度的区域和立体选择性以及无需保护和去保护过程,割除了化学合成中所需的毒害物质;劳动环境得到改善,减少了三废的排放。
因此,
用酶法实现7-ACA及头孢菌素的半合成体现了绿色环保工艺的各种优势。
一步酶法工艺技术指标:
底物浓度:2.0-3.0%
转化率:不低于98%
得率:不低于95%
反应时间: 90 分钟
固定化头孢菌素酰化酶( immoblized CPC acylase) 酶活:80-100U/g
使用寿命:100 次
一步酶法制备7—ACA技术具备安全、环保和低成本优势。
通过D—氨基酸氧化酶、GL—7ACA酰化酶两步酶法实现酶法7—ACA的工业化生产,酶解路线长、氧化条件控制难度大、设备条件高的缺点。
一步酶法制备7—ACA技术是未来7—ACA生产的主流生产技术。
代表本领域行业的发展方向。
目前国内7—ACA 市场竞争激烈,诸如健康元、石药、鲁抗等大型医药企业都在生产,另外国家政策调整也使市场竞争加剧。
在当前形势下,谁能最先在7—ACA制备技术上取得突破,获得技术优势,提高生产水平和产品质量,节能降耗减排,谁就能在日益激烈的竞争中占得先机。
同时这也是国家政策的要求,本行业的发展趋势。