611《综合化学》考试大纲
- 格式:pdf
- 大小:307.82 KB
- 文档页数:6

赣南医学院2020年硕士研究生入学考试《611生物综合》考试大纲Ⅰ考查目标生物综合考试范围为生物化学、细胞生物学和生理学。
要求考生系统掌握上述与医学密切相关的生物学课程的基本理论、基本知识和基本技能,能够运用所学的基本理论、基本知识和基本技能综合分析、判断和解决有关理论问题和实际问题。
Ⅱ考试形式和试卷结构一、试卷满分及考试时间本试卷满分为300分,考试时间为180分钟。
二、答题方式答题方式为闭卷、笔试。
三、试卷内容结构生物化学100分细胞生物学100分生理学100分Ⅲ考查内容一、生物化学(一)生物大分子的结构和功能1.组成蛋白质的氨基酸化学结构和分类。
2.氨基酸的理化性质。
3.肽键和肽。
4.蛋白质的一级结构及高级结构。
5.蛋白质结构与功能的关系。
6.蛋白质的理化性质。
7.分离、纯化蛋白质的一般原理和方法。
8.核酸分子的组成,主要嘌呤、嘧啶碱的化学结构,核苷酸。
9.核酸的一级结构。
核酸的空间结构与功能,其他非编码RNA 的分类与功能。
10.核酸的理化性质及应用。
11.酶的基本概念,全酶,辅助因子,参与组成辅酶的维生素,酶的活性中心。
12.酶的作用机制,酶反应动力学,酶抑制的类型和特点。
13.酶的调节。
14.酶在医学上的应用。
(二)物质代谢及其调节1.糖酵解过程、意义及调节。
2.糖有氧氧化过程、意义及调节,能量的产生。
糖有氧氧化与无氧酵解的关系。
3.磷酸戊糖旁路的意义。
4.糖原合成和分解过程及其调节机制。
5.糖异生过程、意义及调节。
乳酸循环。
6.血糖的来源和去路,维持血糖恒定的机制及其临床意义。
7.脂肪酸分解代谢过程及能量的生成。
8.酮体的生成、利用和意义。
9.脂肪酸的合成过程,不饱和脂肪酸的生成。
10.多不饱和脂肪酸的生理作用。
11.磷脂的合成和分解。
12.胆固醇的主要合成途径及调控。
胆固醇的转化。
胆固醇酯的生成。
13.血浆脂蛋白的分类、组成、生理功能及代谢。
高脂血症的类型和特点。
14.生物氧化的特点。

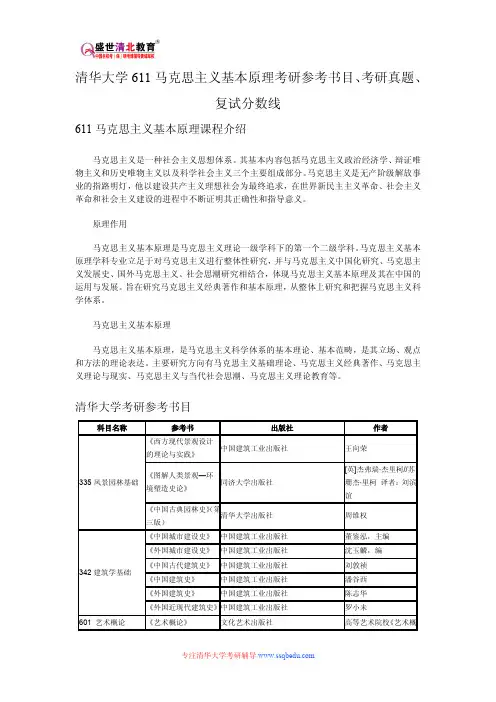
611 综合化学《普通化学》,同济大学普通化学及无机化学教研室编,高等教育出版社,2004版,2010年以后印刷的该教材。
可结合"普通化学"国家精品资源共享课网上资源进行复习,网址为:/jpk/getCourseDetail .action?courseId=2198 /jpk/getCourseDetail.action?courseId=2198一、范围:1. 化学反应的基本规律1、热力学主要解决两大问题:一是定性判断和定量计算某一化学反应自发进行的方向,二是化学平衡常数的相关计算及平衡移动的判断。
其核心在于两大基本公式:吉布斯-赫姆霍兹公式和化学等温方程式。
前者常用于判断和计算标准状态下自发反应的方向,而后者不仅适用于非标准状态下自发反应的方向,还可用于平衡移动的定性判断。
教师教学重点应围绕这两大基本问题和两大基本公式。
通过学习,教师应教会学生将热力学的重要内容全部涵盖在吉布斯-赫姆霍兹公式和化学等温方程式中。
第1、2节基本概念的学习是为了引入与反应方向相关的反应热以及熵、焓、吉布斯自由能等新的状态函数。
第3节应明确最终判断化学反应的方向是ΔrGm (T)以及与ΔrGm 、J与 K (T)的关系,教会学生定性判断和定量计算某一化学反应自发进行的方向。
第4节让学生明确化学平衡的意义和特征,学习有关化学平衡常数的计算及利用化学等温方程式进行平衡移动的判断。
通过本章前4节的学习,学生应明确学习热力学的意义与方法。
2、动力学的核心在于化学反应的反应速率的定量计算和定性解释,包含三部分内容:1. 反应速率的定量表达;2. 反应速率的影响因素------浓度、温度、催化剂,是怎样改变反应速率的。
3. 反应速率的定性解释:根据反应速率理论定性解释浓度、温度、催化剂对反应速率的影响。
教会学生将动力学的主要内容围绕质量守恒定律和阿伦尼乌斯公式展开。
明确热力学与动力学的关系。
知识点反应速率方程可逆反应平衡常数活化能环境途径功分压热力学标准态平衡转化率勒沙特列原理普通化学课程简介链化学反应质量作用定律催化剂反应级数熵增加原理吉布斯自由能相体系状态函数过程热理想气体状态方程气体分压定律热力学第一定律反应热盖斯定律自发过程热力学第二定律熵化学反应速率化学平衡质量守恒定律1.1 基本概念1.2 化学反应中的质量守恒与能量守恒1.3 化学反应方向--熵增加与吉布斯自由能减小1.4 化学反应限度--化学平衡1.5 化学反应速率2. 水基分散系2.1 分散体系2.2 稀溶液的依数性2.3 胶体分散体系3. 溶液中的化学平衡3.1 溶液中的酸碱平衡3.2 沉淀溶解平衡3.3 配位化合物及水溶液中的配位平衡3.4 溶液中的电化学平衡及其应用3.5 实际体系中的多重平衡4. 结构化学4.1 原子结构与元素周期律4.2 化学键和分子结构4.3 分子的极性、分子间的作用力和氢键4.4 晶体结构4.5 超分子作用与超分子化学简介5. 单质及无机化合物5.1 金属及其化合物5.2 非金属元素的分类、分布及其单质的制备5.3 非金属元素化合物6. 有机化合物7. 有机高分子化合物8. 生命与化学9. 环境与化学10.能源与化学11.材料与化学12.文献检索基本知识二、题型:选择题、填空题、简答题、计算题、设计题五种。

611 综合化学
一、范围:
1. 化学反应的基本规律
1.1 基本概念。
1.2 化学反应中的质量守恒与能量守恒。
1.3 化学反应方向--熵增加与吉布斯自由能减小。
1.4 化学反应限度--化学平衡。
1.5 化学反应速率及其理论;反应级数;催化剂与催化反应。
2. 水基分散系
2.1 分散体系。
2.2 稀溶液的依数性。
2.3 胶体分散体系。
3. 溶液中的化学平衡
3.1 酸碱理论与酸碱电离平衡。
3.2 溶度积与沉淀溶解平衡。
3.3 配位化合物及水溶液中的配位平衡。
3.4 氧化还原反应与电化学平衡。
3.5 实际体系中的多重平衡。
4. 结构化学
4.1 原子结构与元素周期律。
4.2 化学键与分子结构:离子键、离子极化;共价键:价键理论、。

2021同济大学611综合化学真题与解析2021同济大学611综合化学真题与解析科目代码:611 科目名称:综合化学满分分值:100答题要求:1、答题一律做在答题纸上,做在试卷上无效。
2、考试时间180分钟。
3、本试卷不可带出考场,违反者作零分处理。
一、选择题 (每空2分,共30分)1.化学反应速率常数k的物理意义()A.表示该化学反应本身在反应速率方面的特征,与反应物浓度无关B.表示该化学反应的反应速率与反应物浓度间的线性关系 C.表示了反应物的浓度间彼此的相关性2.如果说化学反应aA + bB →dD + eE的反应级数是(a+b),则其充分必要的前提是() A.该反应为基元反应 B.该反应为可逆反应 C.该反应为一元反应D.该反应中a=1,b=13.在恒温恒压下,某化学反应自发进行的充分必要条件是该反应的()A.ΔrHm?>0B. ΔrHm?<0C. ΔSm>0D. ΔSm<0E.ΔU>0F.ΔrHm?>0G. ΔrGm?<0H. ΔrGm?>0 4.若研究在盖有表面玻璃的玻璃杯中进行的溶液反应,则该反应体系为() A.封闭体系 B.孤立体系 C.敞开体系 5.下列溶液中渗透压最大的是()A.纯水B.1.0×10-3 mol・L-1的NaCl溶液C.1.0×10-3 mol・L-1的HAc溶液D. 1.0×10-3 mol・L-1的蔗糖溶液 6.下列体系中具有缓冲作用的是()A.1 mol・L-1的NaOH溶液和1 mol・L-1的HCl溶液等体积混合B.1 mol・L-1的NaOH溶液和2 mol・L-1的HAc溶液等体积混合 C.1 mol・L-1的NaOH溶液和2 mol・L-1的HAc溶液等体积混合7.胶体在外电场作用下,若分散介质不动而分散相在外电场作用下发生定向移动,这种现象称为;若分散相不动而分散介质作定向移动,则称为。

题号:913《化工综合》考试大纲化工原理(占比67%):第一部分流体流动1.掌握流体的密度、黏度的定义、单位、影响因素及数据的求取;2.掌握静压强的定义、单位及不同单位之间的换算;3.掌握流体流体静力学基本方程式、连续性方程式、柏努利方程式及其应用;4.掌握流体在管内的流动阻力及其计算;5.掌握简单管路设计计算及输送能力的核算;6.掌握测速管、孔板流量计及转子流量计等的工作原理、结构及计算;7.掌握简单管路的计算方法;8.掌握哈根-泊谡叶方程式。
第二部分流体输送机械1.掌握离心泵的结构、工作原理、性能参数、特性曲线、操作要点及应用、安装高度计算、流量调节原理及其方法、操作注意事项及选用原则;2.掌握离心式通风机的性能参数、特性曲线及其选用方法;3.掌握往复泵的结构、工作原理、性能参数、特性曲线、操作要点及应用;第三部分沉降与过滤1.掌握过滤操作的基本原理、恒压过滤方程式及其应用、过滤常数的测定方法;2.掌握板框压滤机、叶滤机的基本结构和操作、洗涤时间的计算;3.掌握重力沉降的基本原理、重力沉降速度的定义及计算、沉降室的工艺计算;4.掌握离心沉降的基本原理、离心沉降速度的定义及计算;5.了解旋风分离器操作原理、结构、分离性能及其选型依据;6.了解转筒过滤机的操作特点及其应用;7.掌握离心机的基本结构和应用。
第四部分传热1.掌握热传导的基本原理、付立叶定律、平壁及圆筒壁热传导的计算;2.掌握对流传热的基本原理、牛顿冷却定律、影响对流传热的主要因素,Nu、Re、Pr、Gr各准数的物理意义及其计算、无相变时对流传热系数关联式的用法、使用条件及注意事项等;3.掌握两流体间传热过程的计算方法;4.了解蒸汽冷凝和液体沸腾时对流传热系数的计算;5.掌握热辐射的基本概念及两固体间辐射传热量的计算;6.掌握常用换热器的结构特点及选型原则。
第五部分吸收1.掌握双组分溶液的气液相平衡的计算方法,包括平衡溶解度,亨利定律;2.掌握分子扩散与费克定律,扩散系数,双膜理论的要点,吸收速率方程式,气膜控制与液膜控制;3.掌握吸收塔的设计型与操作型计算方法,包括物料衡算与操作线方程式,吸收剂的用量与最小液气比,填料层高度的计算;4.掌握解吸塔的计算方法;5.掌握填料塔的结构及填料的作用、气液两相在填料层内的流动、液泛气速、塔径的计算、填料塔的附件。

考试科目:814综合化学一、复习要求:本《综合化学考试大纲》适用于上海大学化学专业硕士研究生入学综合化学考试。
综合化学考试的任务全面检查考生在化学一级学科范围内四大化学及其化学交叉、前沿学科课程的基础知识、基本理论和实验技能的掌握情况。
考试形式与试卷结构为:闭卷笔试;答题时间180分钟;题型全部为选择题。
各课程基础知识、基本理论的考题难易适中,不含单课程高难题。
试卷满分为150分。
各部分的比例:无机化学约占20%,分析化学约占20%,有机化学约占20%,物理化学约占20%,其它约占20%。
二、主要复习内容:(一)无机化学部分1、掌握s区元素、P区元素、ds区元素和第四周期d区元素及其化合物的基本性质、化学反应和常见离子的分离鉴定方法。
2、掌握元素周期表和元素性质的周期性。
3、熟悉化学热力学和化学平衡的基本知识与简单计算。
4、熟悉无机化学实验的基本操作技能和实验注意事项。
(二)有机化学部分1、有机化合物的同分异构、立体异构、命名及结构与物性之间关系。
分子的极性、对称性、氢键、亲水憎(疏)水性与有机化合物的偶极矩、熔点、沸点、溶解度等之间的关系。
2、有机化合物结构的各种效应(1)诱导效应、共轭效应、立体效应、氢键效应、芳香性等概念和应用。
(2)碳正离子、碳负离子、碳自由基等活性中间体的稳定性。
3、有机化学反应(1)重要官能团化合物的典型反应,包括:烷烃、烯烃、炔烃、卤代烃、芳烃、醇、酚、醚、醛、酮、胺、羧酸及其衍生物。
(2)主要有机反应:亲电、亲核加成反应、亲电、亲核取代反应、消除反应、氧化还原反应、自由基反应。
(3)重要有机人名反应。
4、有机化学反应机理。
包括S N1、S N2机理;E1、E2机理;碳正离子的重排;芳香族亲电取代反应历程;重氮化反应及其应用;羰基的亲核加成——消除历程。
5、有机合成。
官能团导入、转换、保护;碳碳键形成及断裂的基本方法;原料的选择,合成步骤的设计,选择性反应及保护基的应用。

2021年硕士研究生招生考试大纲003化学化工学院目录初试考试大纲 (2)619 分析化学 (2)815 物理化学A (10)971 化工原理 (14)复试考试大纲 (17)F0301综合化学 (17)F0302物理化学 (25)初试考试大纲619 分析化学一、考试性质全国硕士研究生入学考试是为高等学校招收硕士研究生而设置的。
其中,分析化学是化学专业、分析专业与海洋化学专业的专业基础课程,属我校命题的考试。
它的评价标准是高等学校优秀毕业生能达到及格或及格以上水平,以保证录取者具有较扎实的分析化学的基础知识。
考试对象为报考中国海洋大学硕士研究生入学考试的准考考生。
二、考查目标分析化学可分为定量分析化学和仪器分析两部分。
要求考生了解分析化学在科研及生产实际中的重要意义;能系统理解分析化学的基本概念和基本原理,提高定量处理水溶液中离子平衡关系的能力,准确树立“量”的概念;掌握常用仪器分析方法的基本原理、仪器构造和分析应用;能够根据具体问题选择合适的仪器分析方法。
正确掌握分析化学的基本操作,并初步具有解决某些实际分析化学问题的能力。
三、考试形式本考试为闭卷考试,满分为150分,考试时间为180分钟。
试卷结构:选择20-30%,填空20-30%,简答20-30%,计算20-30%。
四、考试内容《分析化学》部分:(40%)第一章概论1.分析化学的定义、任务、作用和分析方法的分类;分析化学发展简史和现代分析化学学科发展趋势及特点;2.定量分析过程和分析方法;3.滴定分析的方法;滴定分析对化学反应的要求和滴定方式及分类;基准物质和标准溶液;4.掌握滴定分析的基本计算,浓度换算。
第二章分析试样的采集与制备1.定量分析的基本过程及各步操作的主要目标;2.试样采集、制备、分解及预处理的基本操作。
第三章分析化学中的误差与数据处理1.总体和样本的统计学计算;2.随机误差的正态分布的特点及区间概率的概念;3.t分布曲线,置信度和平均值的置信区间;显著性检验:t检验和F检验;异常值的取舍方法;4.系统误差和随机误差的传递计算;5.提高分析结果准确度的方法。

2024哈工大化学考研大纲(实用版)目录1.2024 年哈尔滨工业大学化学考研大纲概述2.考试范围和内容3.考试重点4.参考书目和建议正文一、2024 年哈尔滨工业大学化学考研大纲概述2024 年哈尔滨工业大学化学考研大纲已经公布。
作为一名准备参加考研的学生,了解并熟悉这份大纲是非常重要的。
这份大纲主要包括了考试范围、考试内容、考试重点以及参考书目等方面的信息。
二、考试范围和内容哈尔滨工业大学化学考研的考试范围涵盖了无机化学、有机化学、物理化学和分析化学等四个方面。
具体来说,无机化学部分包括了化学原理、化学键、无机化合物的结构和性质等内容;有机化学部分包括了有机化合物的结构和性质、有机反应、有机合成等内容;物理化学部分包括了热力学、动力学、光谱学等内容;分析化学部分包括了化学分析的基本原理和方法、仪器分析等内容。
三、考试重点考试的重点内容包括了化学原理的基本概念和理论、无机化合物和有机化合物的结构和性质、化学反应的基本原理和规律、化学分析的基本原理和方法等。
在复习过程中,需要着重关注这些重点内容,并进行深入理解和掌握。
四、参考书目和建议为了更好地复习备考,以下是一些建议的参考书目:《无机化学》徐光宪著,高等教育出版社;《有机化学》杨振宁著,高等教育出版社;《物理化学》傅鹰著,高等教育出版社;《分析化学》陈国珍著,高等教育出版社。
此外,除了参考书目之外,还需要关注历年真题、学术论文等资料,以便更好地了解考试的规律和趋势。
总结起来,对于准备参加 2024 年哈尔滨工业大学化学考研的学生来说,熟悉并掌握这份考研大纲是非常重要的。
在复习过程中,要以大纲为指导,有的放矢,才能事半功倍。

山东中医药大学S handong University of Traditional Chinese Medicine 二〇一六年攻读硕士学位研究生招生简章山东中医药大学研究生处二○一五年九月学校概况山东中医药大学建于1958年,是山东省省属重点高校,也是山东省唯一一所独立设置的医药科大学,教育部本科教学工作水平评估优秀学校,山东省首批五所应用基础型人才培养特色名校之一。
学校办学条件优越。
长清新校区占地1829亩,建筑面积54.5万平方米,仪器设备总值17087.6万元,馆藏纸质图书110万册、电子图书47万册,有配置完善的计算机校园网和现代教育技术设施。
学校设13个二级学院,有3所直属附属医院和11所非直属附属医院、10家山东省研究生联合培养基地以及1个国家级实验教学示范中心、1个国家级大学生校外实践教育基地。
学校研究生教育层次完备。
拥有中医学、中西医结合、中药学3个一级博士学位授权学科,15个二级博士学位授权点;8个一级硕士学位授权学科,44个二级硕士学位授权点,并具有中医学博士专业学位授予权和中医学、中药学、药学、生物医学工程硕士专业学位授予权。
学校师资力量雄厚。
现有博士生导师110人,硕士生导师442人。
1人先后荣获国家“国医楷模”、“国医大师”荣誉称号,有国家“973”项目首席科学家1人,全国杰出专业技术人员1人,全国优秀教师8人,省部级有突出贡献的中青年专家12人,山东省“泰山学者”特聘教授8人,享受国务院特殊津贴43人。
山东省有突出贡献的名老中医药专家5人,山东省名中医药专家55人,1个团队入选山东省十大优秀创新团队。
学校科技创新能力强劲。
现有3个博士后科研流动站,8个山东省“泰山学者”岗位学科;有中医基础理论、中医医史文献2个国家级重点学科和中医内科学1个国家重点(培育)学科,1个教育部重点实验室,2个国家中医药管理局重点研究室。
有国家中医药管理局重点学科29个、重点专科(专病)3个、重点建设专科5个,山东省人文社科研究基地1个,省级重点学科、重点专科、重点实验室等48个。
科目代码:611科目名称:生物化学
考试范围:
一、生物化学课程内容简介
生物化学是研究生物体物质组成结构及其在生物体内主要的代谢过程和代谢规律,主要内容包括蛋白质化学、核酸化学、维生素与辅酶、酶化学、生物氧化、糖代谢、脂代谢、氨基酸代谢、核酸代谢以及DNARNA复制、RNA复制、转录及蛋白质的生物合成。
二、课程的性质、目的和要求
生物化学是生命科学学科体系中重要的专业基础课。
课程任务是使学生掌握生物体基本物质的化学组成及功能,从整体上掌握生物体内物质的代谢过程及代谢规律,并通过与实验课相结合,让学生系统地掌握生物化学基本的实验原理和技术方法。
三、课程的基本要求
1.掌握蛋白质、核酸、维生素与辅酶、酶、脂类等物质的结构、理化性质、生物学活性等。
2.掌握糖、蛋白质、脂类、氨基酸、核苷酸等代谢的基本途径,掌握酶促反应动力学的基本内容和影响酶促反应的因素及规律,掌握遗传信息传递的基本过程。
3.掌握生物化学的基本实验技术及其原理。
4.了解生物化学最新研究进展及其应用方面的相关知识。
四、考核内容
第一章绪论
生物化学的概念及其研究内容、生物化学的研究方法、生物化学发展简史及重要事件。
生物化学课程的特点及学习方法。
《综合化学》考试大纲
一、考试的基本要求
要求考生比较系统地理解和掌握《无机化学》、《分析化学》、《有机化学》和《物理化学》方面的基础理论、基本知识和基本技能,考察考生对《无机化学》、《分析化学》、《有机化学》和《物理化学》中基础实验结果和数据的分析及计算,培养学生实事求是的作风和科学思维等,能综合运用所学知识分析问题、解决问题以及考查考生知识面的广度。
二、考试方法和考试时间
闭卷考试,总分,考试时间为小时。
三、参考书目(仅供参考)
俞斌等.无机与分析化学(第三版).北京:化学工业出版社,.
朱红军等.有机化学(中文版).北京:化学工业出版社,.
刘建兰等.物理化学.北京:化学工业出版社,.
四、试题类型:
包括填空题、选择题、是非题、名词解析、简答题、计算题、论述题等类型,并根据每年的考试要求做相应调整。
五、考试内容及要求
涉及《无机化学》,《分析化学》,《有机化学》,《物理化学》,各占%。
具体考试内容如下:
第一部分无机化学
1.1无机化学基本理论
应掌握的知识点:原子和分子结构,化学反应速度和化学平衡,酸碱平衡和沉淀平衡,氧化还原和电化学,配合物及配位平衡等化学基本知识和基本定律。
1.2元素和化合物
应掌握的知识点:常见元素及其化合物的一般性质。
1.3综合应用和基本实验技能
应掌握的知识点:熟练掌握基础化学实验的基本操作、无机化学中常见的各种反应、分离和鉴定的方法,还需了解一般无机化学实验的注意事项。
第二部分分析化学
2.1分析化学实验基本技能
应掌握的知识点:天平称量基本知识,容量分析基本操作。
2.2误差与数据处理
应掌握的知识点:误差与偏差,准确度与精密度,有效数字及其运算规则。
2.3滴定分析法
应掌握的知识点:滴定基本术语,容量和浓度的有关计算,基准物质,标准溶液的配制,标定方式,酸碱滴定用标准溶液,配位滴定用标准溶液,氧化还原滴定用标准溶液,沉淀滴定用标准溶液,滴定分析法计算。
2.4酸碱滴定法
应掌握的知识点:溶液酸度的计算,缓冲溶液,酸碱滴定。
2.5络合滴定法
应掌握的知识点:二钠盐,混合离子的选择滴定,常见离子滴定条件。
2.6氧化还原滴定法
应掌握的知识点:氧化还原反应进行的方向与顺序,条件电位,氧化还原滴定法的应用实例。
2.7重量分析与沉淀滴定法
应掌握的知识点:重量分析,沉淀滴定法。
2.8定量分离
应掌握的知识点:常见分离方法及其分离效果的衡量,溶液中各种金属离子形成氢氧化物沉淀所需,萃取方法及其效率,交换亲和力,相对比移值。
第三部分有机化学
3.1有机化合物系统命名法
应掌握的知识点:带支链烷烃,单官能团化合物,多官能团化合物,顺反异构体,旋光异构体。
3.2异构现象和立体化学
应掌握的知识点:构造异构,立体异构,构象异构。
3.3结构特征与重要特性
应掌握的知识点:σ键与π键,键参数,电子效应,芳香性,酸碱性,分子间的作用力及其影响。
3.4有机反应历程
应掌握的知识点:有机反应类型,反应活性中间体,加成反应,芳环上的取代反应,饱和碳原子上的亲核取代反应,消除反应,自由基反应,分子重排,周环反应,氧化还原反应。
3.5各类有机物的检定鉴别
应掌握的知识点:化学分析,波谱分析。
3.6有机实验的基本知识及基本操作
应掌握的知识点:安全知识,常用的溶剂处理,基本操作。
第四部分物理化学
4.1化学热力学基础
应掌握的知识点:气体,热力学第一定律和第二定律,电解质溶液,相平衡及化学平衡原理。
4.2电化学与胶体化学
应掌握的知识点:平均活度系数,摩尔电导率,电解硫酸铜,电极反应及其
有关计算,氧化态转换,毛细现象。
4.3化学动力学及物化实验
应掌握的知识点:反应速率方程及其有关计算,气体吸收过程,气体反应碰撞理论,速率温度图,储气钢瓶颜色。
个人总结,仅供交流学习-----------------------------
-----------------------------
-----------------------------
-----------------------------。