化学选修五.醇和酚(知识点+配套例题)值得拥有
- 格式:ppt
- 大小:2.94 MB
- 文档页数:70
![高中化学【醇和酚]](https://uimg.taocdn.com/277527b4ddccda38366baf2f.webp)


醇酚知识点1 醇和酚的定义(1)醇:是羟基与烃基或苯环侧链上的碳原子相连形成的化合物,或者说醇是烃分子中饱和碳原子上的氢原子被羟基取代后形成的化合物。
(2)酚:羟基与苯环直接相连而形成的化合物称为酚,最简单的酚是苯酚。
易错点津:醇类的羟基必须要烃基或苯环侧链上的碳原子直接相连;酚类的羟基必须是直接与苯环相连。
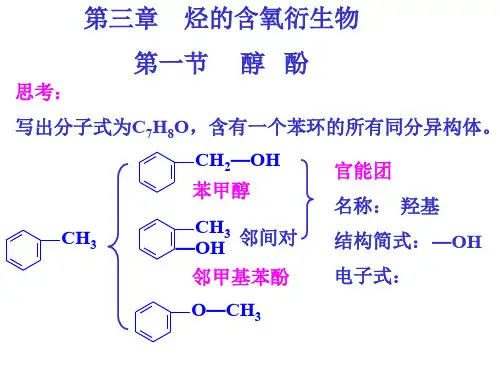
例1下列物质中,不属于醇类的是A.C3H7OH B.C5H5CH2OH C.C6H5OH D.CH2—CH—OHOH CH3例2 下列物质与互为同系物的是知识点2 醇类概述1.,醇的分类(1)根据分子里的羟基数目分:①一元醇:②二元醇:如:CH2—CH2OH OH③多元醇: 如:CH2—CH—CH2OH OH OH(2)根据醇分子里羟基是否饱和,醇可分为:①饱和醇:②不饱和醇:如:CH2==CH—CH2OH(3)根据醇分子里是否含有苯环,醇可以分为:①脂肪醇②芳香醇:2.常见的醇(1)甲醇(CH3OH)甲醇是一种常见的纯,最初来源于木材的干馏,俗称木精或木醇,是无色透明的液体,甲醇有剧毒,误饮少量可致眼睛失明,多量则可以致人死亡。
甲醇是一种重要的有机化工原料,在能源、工业领域应用广泛。
(2)乙二醇CH2OHCH2OH乙二醇是一种无色、粘稠、有甜味的液体,其水溶液的凝固点很低,可作汽车发动机的抗冻剂,乙二醇主要用于生产聚酯纤维。
(3)丙三醇丙三醇俗称甘油,是无色、粘稠、有甜味的液体,吸湿性强,有护肤作用,是重要的化工原料。
丙三醇与HNO3酯化形成的三硝酸甘油酯,俗称硝酸甘油,是一种烈性炸药。
例3(双选)下列说法中,正确的是A.甲醇、乙二醇、丙三醇互为同系物B.甲醇、乙二醇、丙三醇都易溶于水C.甲醇、乙二醇、丙三醇都有剧毒D.相同质量的甲醇、乙二醇、丙三醇完全燃烧时甲醇耗氧量最大。
例4 (双选)只用水就能鉴别的一组物质是A.苯乙醇四氯化碳B.乙醇乙酸乙烷C.乙二醇甘油溴乙烷D.碳化钙碳酸钙氯化钠知识点3 乙醇的性质(重点)1.乙醇的结构分子式:;结构式:结构简式:。

最新高考化学精品资料第三节醇和酚1.了解醇类、酚类物质的组成、结构特点、性质及与其他物质的联系。
(中频)2.了解官能团的概念,并能列举醇类、酚类物质的同分异构体。
3.能够举例说明有机分子中基团之间存在的相互影响。
(中频)醇1.醇及其分类羟基与烃基或苯环侧链上的碳原子相连的化合物,饱和一元醇的分子通式为C n H2n+1OH或R—OH。
2.醇类物理性质的变化规律沸点密度一元脂肪醇的密度一般小于1 g·cm -3水溶性低级脂肪醇易溶于水①直链饱和一元醇的沸点随着分子中碳原子数的递增而逐渐升高②醇分子间存在氢键,所以相对分子质量相 近的醇和烷烃相比,醇的沸点远高于烷烃 3.醇类的化学性质(以乙醇为例)条件断键位置 反应类型 化学方程式Na①2CH 3CH 2OH +2Na ―→2CH 3CH 2ONa +H 2↑HBr ,△ ② 取代CH 3CH 2OH +HBr ――→△ CH 3CH 2Br +H 2OO 2(Cu),△①③氧化2CH3CH2OH+O 2――→Cu△2CH3CHO+2H2O浓硫酸,170 ℃②④消去CH3CH2OH――→浓硫酸170 ℃CH2===CH2↑+H2O浓硫酸,140 ℃①②取代2CH3CH2OH――→浓硫酸140 ℃C2H5—O—C2H5+H2OCH3COOH (浓硫酸、△) ①取代(酯化)CH3CH2OH+CH3COOH浓硫酸△CH3COOC2H5+H2O4.几种常见的醇名称甲醇乙二醇丙三醇俗称木精、木醇甘油结构简式CH3OH状态液体液体液体溶解性易溶于水和乙醇苯酚1.组成与结构分子式为C6H6O,结构简式为或C6H5OH,结构特点:苯环与羟基直接相连。
2.物理性质3.化学性质(1)羟基中氢原子的反应 ①弱酸性电离方程式为C 6H 5OH C 6H 5O -+H +,苯酚俗称石炭酸,但酸性很弱,不能使石蕊试液变红。
②与活泼金属反应与Na 反应的化学方程式为:③与碱的反应苯酚的浑浊液中――→加入NaOH 溶液 液体变澄清――→再通入CO 2溶液又变浑浊该过程中发生反应的化学方程式分别为:。

第三章 烃的含氧衍生物 第一节 醇 酚一、进行乙醇的消去反应实验时应该注意哪些问题?1.配制体积比为1∶3的乙醇与浓硫酸混合液时,要注意在烧杯中先加入95%的乙醇,然后滴加浓硫酸,边滴加边搅拌,冷却备用(相当于浓硫酸的稀释);浓硫酸起催化剂和脱水剂的作用。
2.加热混合液时,温度要迅速上升到并稳定于170℃左右。
温度低,在140℃时主要产物是乙醚,反应的化学方程式为:2CH 3CH 2OH ――→浓H 2SO 4140℃CH 3CH 2OCH 2CH 3+H 2O 。
3.由于反应物都是液体而无固体,所以要向烧瓶中加入碎瓷片,以防液体受热时发生暴沸。
4.温度计要选择量程在200℃~300℃的为宜。
温度计的玻璃泡要置于反应液的中央位置,因为需要测量的是反应液的温度。
5.氢氧化钠溶液的作用是除去混在乙烯中的CO 2、SO 2等杂质,防止干扰乙烯与溴的四氯化碳溶液和高锰酸钾酸性溶液的反应。
二、醇的消去反应和氧化反应有哪些规律? 1.醇的消去反应规律 醇分子中,只有连有—OH 的碳原子的相邻的碳原子上连有氢原子时,才能发生消去反应而形成不饱和键。
若醇分子中只有一个碳原子或与—OH 相连碳原子的相邻碳原子上无氢原子[如CH 3OH 、(CH 3)3CCH 2OH 、],则不能发生消去反应。
2.醇的催化氧化规律(1)形如RCH 2OH 的醇,被催化氧化生成醛(或羧酸)。
R —CH 2OH ――→Cu 、O 2△R —CHO R —CH 2OH ――→KMnO 4、H+R —COOH(2)形如的醇,被催化氧化生成酮。
(3)形如的醇,一般不能被氧化。
三、苯酚又叫石炭酸,它是酸类物质吗?为什么显酸性?苯酚显酸性,是由于受苯环的影响,使酚羟基比醇羟基更活泼。
苯酚的羟基在水溶液中能够发生电离。
但是苯酚不属于酸类物质。
在应用苯酚的酸性时应注意以下几点:1.苯酚具有弱酸性,可以与活泼金属(如Na)发生反应。
2.苯酚的酸性极弱,不能使酸碱指示剂变色。

高二化学选修五醇酚习题与答案Corporation standardization office #QS8QHH-HHGX8Q8-GNHHJ8高二化学醇酚相对原子质量:H:1 O:16 C:12一、单项选择题(60分)1.与丁醇互为同分异构体的是A.乙醚B.甲醚C.乙醛D.甲醇2、丙三醇、乙二醇、甲醇中分别加入足量的金属钠产生等体积的氢气(相同条件),则述种醇的物质的量之比是∶3∶6∶2∶1 C.4∶3∶1∶3∶23、下列反应属于氧化反应的是A.乙醇和浓H2SO4加热到140 ℃B.乙醇与硫酸、溴化钠共热C.乙醇与乙酸发生酯化反应D.乙醇与O2发生催化氧化4、C2H5OH和C3H7OH的混合物与浓H2SO4共热,可能生成的有机物最多有种种种种5、一定量的乙醇在氧气不足的情况下燃烧,得到CO2、CO和H2O的总质量为27.6 g,其中H2O的质量为10.8 g,则CO2的质量是A.1.4. gB.2.2 gC.15.4 gD.在2.2 g和4.4 g之间6、化学式为C4H10O的醇,不被氧化,则该醇的结构简式是(CH3)3OH (OH)CH3 (CH3)CH2OH7、质量为ag的铜丝,在空气中灼烧变黑,趁热放入下列物质中,铜丝变为红色,而且质量不为a g的是A.氨气B. COC. 烧碱D.乙醇8、下列有关实验内容的叙述正确的是…A.苯酚沾到皮肤上应立即用酒精洗涤B.用溴水可区分甲苯、苯、四氯化碳C.分离苯酚和水的混合物,可用加氢氧化钠水溶液,再过滤。
D. 分离苯酚和苯的混合物.用溴水再过滤。
9、为检验某卤代烃(R-X)中的X元素,下列操作:(1)加热煮沸;(2)加入AgNO3溶液;(3)取少量该卤代烃;(4)加入足量稀硝酸酸化;(5)加入NaOH溶液;(6)冷却。
正确的操作顺序是:A、(3) (1) (5) (6) (2) (4)B、(3) (5) (1) (6) (4) (2)C、(3) (2) (1) (6) (4) (5)D、(3) (5) (1) (6) (2) (4)10、下列物质能发生消去反应的是A.(CH3)3C—CH2Cl C.(CH3)3C—OHD.(CH3)3C—CH2OH11、.白藜芦醇广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性。

(B)——章节详解高中化学教材知识详解专题四第二单元醇和酚苏教版选修5第二单元醇和酚Ⅰ基础知识剖析版一.知识概念地图答案:1.酒精C2H6O CH3CH2OH(CH3-CH2-OH)或C2H5OH(C2H5-OH) -OH 2.无小极性小 3.置换氧化消去 4.醇一元醇二元醇三元醇CnH2n+2O或CnH2n+1OH 5.木精木醇毒甲醇 6.无抗冻甘油硝化甘油7.酚苯酚石炭酸8.C6H6O 12 极性8.无色粉红互毒9.弱酸取代氧化加成显色缩聚二.教材知识详解(一) 乙醇⑴乙醇的分子结构结构简式:CH3CH2OH(CH3-CH2-OH)或C2H5OH(C2H5-OH)⑵物理性质乙醇是无色透明而有特殊香味的液体,密度比水小,沸点为78.5 ℃,易挥发,乙醇是一种极性分子,分子间可以形成氢键,与水可以任意比混溶,且其溶液浓度愈大,密度愈小。
乙醇分子中乙基与有机物会产生较强的相互作用,羟基与无机物也会产生较强的相互作用,因此乙醇是一种能溶解许多有机物和无机物的良好的极性溶剂。
⑶化学性质①取代反应a.与金属钠反应:化学方程式:2CH3CH2OH +2Na → 2CH3CH2ONa +H2↑乙醇和Na反应:金属钠表面有气泡生成,反应较慢;水和钠反应:反应剧烈。
b.与HX反应化学方程式:CH3CH2OH +HX → CH3CH2X +H2O c. 乙醇的脱水①乙醇的分子间脱水化学方程式:2CH3CH2OH CH3CH2OCH2CH3+H2O②乙醇的分子内脱水化学方程式:CH3CH2OH CH2=CH2↑ +H2Oe.酯化反应化学方程式:CH3CH2OH +CH3COOH CH3CH2OOCCH3 +H2O②消去反应化学方程式:CH3CH2OH CH2=CH2↑ +H2O③氧化反应a.燃烧化学方程式:CH3CH2OH +3O2 2CO2 +3H2Ob.催化氧化化学方程式:2CH3CH2OH +O2 2CH3CHO +2H2O特别提示乙醇在发生化学反应时,其分子中有5处化学键可以发生断裂,表现出不同的化学性质。



第2节醇和酚1.了解醇和酚的物理性质及化学性质、用途和一些常见的醇和酚,能够用系统方法对简单的醇进行命名。
2.能够根据饱和一元醇的结构特征举例说明醇的反应机理(断键和成键规律),并且会设计醇到烯烃、卤代烃、醛、酮、酯的转化路线。
3.能够区别酚与醇且了解酚的主要化学性质,并能够从苯环和羟基之间的相互影响来理解。
一、醇的概述1.醇:烃分子中__________上的一个或几个氢原子被________取代的产物。
2.醇的分类。
(1)根据醇分子里羟基的数目,醇可分为:①________醇:如CH3OH、;②________醇:如;③________醇:如。
(2)根据醇分子里烃基是否饱和,醇可分为:①________醇:如CH3OH、、;②________醇:如;注意:饱和醇的通式为C n H2n+2O x。
3.醇的命名。
醇的命名法按以下步骤进行:(1)选择连有________________________做主链,按主链所含碳照子数称为某醇。
(2)对碳原子的编号由接近________的一端开始。
(3)命名时,羟基的位次号写在“某醇”的前面,其他取代基的名称和位次号写在母体名称的前面。
如:的名称为___________________________4.重要的醇。
5.醇的物理性质。
(1)沸点:饱和一元醇的通式________________________,沸点比与其相对分子质量接近的烷烃或烯烃的沸点________,主要因为一个醇分子中的氢原子和另一个醇分子中的氧原子形成_______________,增强了醇分子间的相互作用。
多元醇分子中___________较多,增加了分子间形成氢键的几率,使多元醇的沸点______________ 。
(2)水溶性:对于饱和一元醇,当烷基较小时,醇与水可以______________,当烷基较大时,醇的物理性质逐渐接近________,常温常压下,饱和一元醇中的碳原子数为______的醇能以任意比与水互溶,碳原子数为________的醇为油状液体。
醇知识点主要以乙醇为例:醇:链烃基与羟基结合的化合物,分子里含有一个羟基的醇叫做一元醇。
饱和一元醇的通式:C n H 2n+2O (n ≥1)。
1、物理性质:甲醇:无色透明液体,与水任意比例互溶,具有酒精气味,易燃烧,有毒,饮用后会导致人的眼睛失明。
工业酒精中常含有甲醇。
乙醇:无色、透明而有特殊香味的液体。
比水轻,沸点为78.5℃,与水的混合物蒸馏时优先蒸出,易挥发,能溶解多种有机物和无机物,能与水任意比例互溶,是一种良好的溶剂。
甲醇、乙醇、丙醇能与水任意比互溶,丁醇在水中的溶解度显著降低,含10个碳原子数以上的一元醇几乎不溶于水。
碳原子数在11或11以下的饱和一元醇为液体,11以上的饱和一元醇为固体。
2、化学性质:醇的官能团:羟基-OH1)与活泼金属反应2Na+2CH 3CH 2OH →2CH 3CH 2ONa+H 2↑水比甲醇更容易与Na 反应,甲醇比乙醇容易与Na 反应,随着碳原子数的增加,与金属反应时醇的活泼性减弱。
2)分子内脱水----消除反应典型方程式:CH 3CH 2OHCH 2=CH 2↑+H 2O消除反应条件:当连有羟基的碳原子有相邻的碳原子,且该碳原子上有氢原子时,才能发生消除反应。
3)分子间脱水----取代反应CH 3CH 2OH+HOCH 2CH 3CH 3CH 2OCH 2CH 3+H 2O乙醚:无色、无毒、易挥发的液体,有特殊气味,比水轻,微溶于水。
以上两个反应切记:相同的反应物,反应条件不同,脱水的方式不同,产物也不同。
浓H 2SO 4170℃浓H 2SO 4140℃4)燃烧CH 3CH 2OH+3O 22CO 2+3H 2O乙醇是一种可再生能源,也是一种清洁燃料。
5)催化氧化特征实验:取一支试管。
加入3ml 乙醇。
将一根粗铜丝绕成螺旋状,把铜丝放在酒精灯外焰上加热至红热后,迅速伸入试管里的酒精溶液中。
反复多次后,嗅闻试管里溶液的气味。
现象:铜丝红热后表面生成黑色的物质,当插入酒精中,铜丝又变红色,嗅闻试管中的液体,有特殊刺激性气味。
第一节醇和酚一、醇1、醇的定义:羟基直接连在脂肪烃基上形成的化合物叫做醇2、醇的分类1)烃基:区分为饱和醇和不饱和醇2)羟基数目:区分为一元醇和多元醇3)是否含芳香烃基:区分为芳香醇和脂肪醇4)与羟基直连碳上的直连氢数:伯醇(2)、仲醇(1)、叔醇(0)3、醇的通式1)链状饱和醇:CnH2n+2O 2)链状烯醇:CnH2nO 3)芳香醇:CnH2n-6O4、代表物质:乙醇【习题一】下列有机物中不属于醇类的是()A.B.C.D.【分析】官能团羟基与烃基或苯环侧链上的碳相连的化合物属于醇类,羟基与苯环直接相连的有机物为酚类,据此进行判断.【解答】解:A.中苯环侧链与羟基相连,名称为苯乙醇,属于醇类,故A正确;B.苯环与羟基直接相连,属于酚类,故B错误;C.,分子中烃基与官能团羟基相连,属于醇类,故C正确;D.羟基与烃基相连,为环己醇,故D正确。
故选:B。
【习题二】下列说法正确的是()A.羟基跟链烃基直接相连的化合物属于醇类B.含有羟基的化合物属于醇类C.酚类和醇类具有相同的官能团,因而具有相同的化学性质D.分子内含有苯环和羟基的化合物都属于酚类【分析】A.醇是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物;B.醇是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物;C.酚类和醇类的结构不同,性质不同;D.苯环可通过链烃基再与羟基相连则形成醇类.【解答】解:A.羟基跟链烃基直接相连的化合物属于醇类,故A正确;B.含有羟基的化合物不一定属于醇类,如与苯环上的碳原子直接相连属于酚,故B错误;C.酚具有弱酸性而醇则没有弱酸性,故C错误;D.苯环可通过链烃基再与羟基相连则形成醇类。
如,故D错误。
故选:A。
二、乙醇1、基本结构分子式:C2H6O 结构式:结构简式:CH3CH2OH2、物理性质:无色,液体,带有特殊气味,密度比水小,可与水互溶,易挥发,是一种良好的有机溶剂,俗称酒精2、化学性质1)取代反应a、与金属的反应(K、Na、Ca、Mg等)2CH3CH2O-H+2Na → 2CH3CH2ONa+H2↑断键基理:氧氢键断裂,原子构成氢气分子b、与卤化氢的取代CH3CH2-OH+H-X → CH3CH2X+H2O断键基理:碳氧键断裂,羟基与卤化氢中的氢原子形成水分子c、分子间脱水:与浓硫酸混合共热(140℃)条件下反应2CH3CH2-OH → CH3CH2-O-CH2CH3+H2O断键基理:一个乙醇分子中碳氧键断裂,另一个分子中的氧氢键断裂,两个分子脱下的羟基和氢原子形成水分子2)消去反应与浓硫酸混合共热(170℃)条件下反应CH3CH2-OH → CH2=CH2+H2O断键基理:碳氧键断裂,同羟基直连碳上的碳氢键断裂,脱下的羟基和氢原子形成水分子,两个碳原子间形成双键实验步骤:在长颈圆底烧瓶中加入乙醇和浓硫酸(体积比约为1∶3)的混合液20 mL,放入几片碎瓷片,以避免混合液在受热时暴沸。
课时考点5 醇和酚考点阐释:(1)掌握乙醇的分子结构、化学性质;(2)以乙醇为例,了解羟基官能团在化合物中的作用,掌握醇的性质和主要化学反应,并能结合同系列原理加以应用。
通过对乙醇性质的学习,使学生获得物质的结构、性质之间关系的科学观点。
(3)、掌握苯酚的结构式、性质用途等;(4)、掌握乙醇与苯酚的性质的对比,了解不同的烃基对同一官能团有不同的影响一、基础巩固1. (6分)下列有关乙醇的物理性质的应用中不正确的是A. 由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去B. 由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分C. 由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒D. 由于乙醇容易挥发,所以才有俗语“酒好不怕巷子深”的说法2. (6分)水是一种廉价而且非常有用的试剂,下列用水就能鉴别的一组物质是A. 苯、己烷、四氯化碳 B . 苯、乙醇、四氯化碳C. 硝基苯、乙醇、四氯化碳D. 硝基苯、乙醇、醋酸3. (6分)在有机反应中,能引入羟基的反应是A 磺化反应B 消去反应C 水解反应D 聚合反应4. (6分)工业上,为使95.6%的乙醇变为100%的绝对乙醇,常常加入一种物质加热回流一段时间后蒸馏,得到99.5%的无水乙醇,然后再加入另一种物质加热回流一段时间后蒸馏可得到绝对乙醇,这两种物质分别是A. 无水硫酸铜,生石灰B. 无水氯化钙,金属钠C. 生石灰,金属镁D. 浓硫酸,金属镁5、(6分)丁香油酚的结构简式是,该物质不应有的化学性质是①可以燃烧;②可以跟溴加成;③可以使酸性KMnO 4溶液褪色;④可以跟NaHCO 3溶液反应;⑤可以跟NaOH 溶液反应;⑥可以在碱性条件下水解A 、①③B 、③⑥C 、④⑤D 、④⑥ 6、(6分)(07江苏)花青苷是引起花果呈颜色的一种花色素,广泛存在于植物中。
它的主要结构在不同pH 条件下有以下存在形式:下列有关花青苷说法不.正确的是 A .花青苷可作为一种酸碱指示剂 B .I 和Ⅱ中均含有二个苯环 C .I 和Ⅱ中除了葡萄糖基外,所有碳原子可能共平面 D .I 和Ⅱ均能与FeCl 3溶液发生显色反应CH 2-CH =CH 2HO OCH 3OH7、(12分)如何将苯的同系物和的混合物分离出来。
醇和酚____________________________________________________________________________________________________________________________________________________________________1.了解醇类、酚类的结构特点、一般特性和用途;2.掌握乙醇、苯酚的化学性质。
知识点一.醇的结构和性质1.醇的结构、分类及通式(1).醇是羟基与烃基或苯环侧链上的碳原子相连的化合物,或者说醇是烃分子中饱和碳原子上的氢原子被羟基取代所形成的化合物。
—OH是醇类物质的官能团。
(2).醇的分类。
根据醇分子中含有的醇羟基的数目,可以将醇分为一元醇、二元醇和多元醇等。
一般将分子中含有两个和两个以上醇羟基的醇分别称为二元醇和多元醇。
(3).醇的通式。
一元醇的分子通式为R—OH,饱和一元醇的分子通式为C n H2n+1—OH。
碳原子数相同的饱和一元醇与饱和一元醚互为同分异构体。
2 . 醇的物理性质(1).低级的饱和一元醇为无色中性液体,具有特殊的辛辣气味。
(2).常温常压下,碳原子数为1~3的醇能与水以任意比例互溶;碳原子数为4~11的醇为油状液体,仅部分可溶于水;碳原子数为12以上的高级醇为无色无味的蜡状固体,不溶于水。
(3).醇的沸点随分子中碳原子数的增加而升高,且相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点。
(4).醇的密度比水的密度小。
3. 醇的化学性质醇发生的反应主要涉及分子中的C —O 键和H —O 键:断裂C —O 键脱掉羟基,发生取代反应和消去反应;断裂H —O 键脱掉氢原子,发生取代反应。
此外醇还能发生氧化反应。
(1).消去反应。
(2).取代反应。
CH 3CH 2OH+HBrH+∆−−−→CH 3CH 2Br+H 2O CH 3CH 2CH 2OH+HBrH +∆−−−→CH 3CH 2CH 2Br+H 2O C 2H 5OH+H —OC 2H 5140C ︒−−−−→浓硫酸C 2H 5—OC 2H 5+H 2O此外醇与钠、羧酸的反应也都属于取代反应。