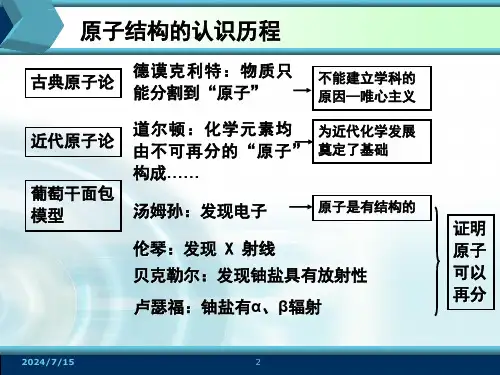
核外电子排布、原子结构示意图、电子式、8电子稳定结构
- 格式:docx
- 大小:255.63 KB
- 文档页数:5


[1]H氢1s1[2]He氦1s2[3]Li锂1s2 2s1 [4]Be铍1s2 2s2 [5]B硼1s2 2s2 2p1 [6]C碳1s2 2s2 2p2 [7]N氮1s2 2s2 2p3[8]O氧1s2 2s2 2p4[9]F氟1s2 2s2 2p5 [10]Ne氖1s2 2s2 2p6 [11]Na钠1s2 2s2 2p6 3s1 [12]Mg镁1s2 2s2 2p6 3s2 [13]Al铝1s2 2s2 2p6 3s2 3p1 [14]Si硅1s2 2s2 2p6 3s2 3p2[15]P磷1s2 2s2 2p6 3s2 3p3 [16]S硫1s2 2s2 2p6 3s2 3p4 [17]Cl氯1s2 2s2 2p6 3s2 3p5 [18]Ar氩1s2 2s2 2p6 3s2 3p6 [19]K钾1s2 2s2 2p6 3s2 3p6 4s1 [20]Ca钙1s2 2s2 2p6 3s2 3p6 4s2 [21]Sc钪1s2 2s2 2p6 3s2 3p6 3d1 4s21s2 2s2 2p6 3s2 3p6 3d2 4s2 [23]V 钒1s2 2s2 2p6 3s2 3p6 3d3 4s2 *[24]Cr铬1s2 2s2 2p6 3s2 3p6 3d5 4s1 [25]Mn锰1s2 2s2 2p6 3s2 3p6 3d5 4s2 [26]Fe铁1s2 2s2 2p6 3s2 3p6 3d6 4s2 [27]Co钴1s2 2s2 2p6 3s2 3p6 3d7 4s2 [28]Ni镍1s2 2s2 2p6 3s2 3p6 3d8 4s21s2 2s2 2p6 3s2 3p6 3d10 4s1 [30]Zn锌1s2 2s2 2p6 3s2 3p6 3d10 4s2 [31]Ga镓1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 [32]Ge锗1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 [33]As砷1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 [34]Se硒1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 [35]Br溴1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5[36]Kr氪1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6例3.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。

姓名,年级:时间:第一课时原子核外电子的排布一、电子层1.电子的能量(1)在多电子原子里,电子的能量不同。
(2)在离核近的区域运动的电子的能量低,在离核远的区域运动的电子的能量高。
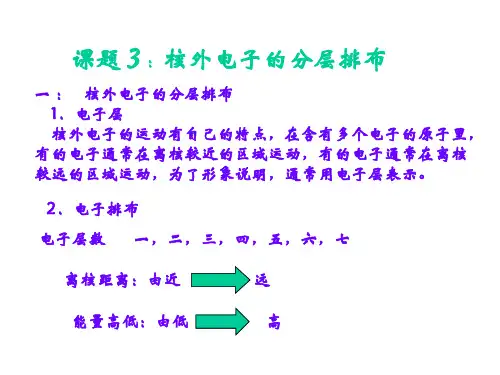
2.电子层(1)概念:在多电子的原子里,把电子运动的不同的区域简化为不连续的壳层,称作电子层.(2)不同电子层的表示及能量关系3.原子核外电子的排布规律(1)电子总是尽可能先从K层排起,当一层排满后再填充下一层。
(2)原子核外各电子层最多容纳2n2个电子.(3)原子最外层电子数不能超过8个(K层为最外层时不能超过2个),次外层电子数不能超过18个。
二、电子层的表示方法1.钠原子的结构示意图如下,请注明其意义:2.原子结构示意图中,核内质子数等于核外电子数,而离子结构示意图中,二者则不相等。
如:Na+;Cl-.阳离子:核外电子数__<__核电荷数。
阴离子:核外电子数__〉__核电荷数.1.正误判断(1)多电子原子中,在离核较近的区域内运动的电子能量较高()(2)稀有气体元素的原子最外层都排有8个电子( )(3)M层为最外层时容纳的最多电子数不超过8个()(4)原子核外各电子层容纳的电子数为2n2个( )[答案](1)×(2)×(3)√(4)×2.某元素原子的最外层电子数是次外层电子数的3倍,则该元素核内质子数为 ( )A.3 B.7 C.8 D.10[答案]C3.下列原子(离子)的结构示意图正确吗?如有错误,请改正。
(1)磷原子____________________;(2)碳原子____________________;(3)钠原子____________________;(4)氟离子____________________。
[答案] (1)正确(2)不正确,(3)不正确,(4)正确知识点一原子核外电子的排布规律1.原子核外电子的排布规律2.核外电子排布的表示方法——结构示意图(1)原子结构示意图①用小圆圈和圆圈内的符号及数字表示原子核和核电荷数。


统编人教版高中化学必修第一册《第一节原子结构与元素周期表》优质课公开课课件、教案1. 核外电子排布的表示方法(1)原子结构示意图①小圆圈和圆圈内的符号及数字表示原子核及核内质子数。
②弧线表示电子层。
③弧线内数字表示该层中的电子数。
(2)离子结构示意图①当主族中的金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与少一个电子层的稀有气体元素原子相同的电子层结构。
②非金属元素的原子得电子形成简单离子时,形成与电子层数相同的稀有气体元素原子相同的电子层结构1.下列表示物质结构的化学用语或模型正确的是A.HF的电子式:B.O的核外电子排布:分子的球棍模型:C.S2-离子的结构示意图:D.CH4【答案】B【解析】A、HF为共价化合物,电子式为,故A错误;B、O为8号元素,核外有8个电子,其中第一层有2个电子,第二层有6个电子,核外电子排布为故B正确;C、S为16号元素,核内有16个质子,S2-离子的结构示意图为,故C错误;D、为甲烷的比例模型,CH4分子的球棍模型为,故D错误;答案选B。
2、明确几个量的关系(1)质量数(A)=质子数(Z)+中子数(N),质量数可近似地代替原子的相对原子质量。
(2)原子的核外电子总数=质子数=核电荷数=原子序数。
(3)阳离子M n+的核外电子数=质子数-n;阴离子N n-的核外电子数=质子数+n。
2.某物质H2RO3分子中共有x个电子,R原子的质量数为A,则R原子核内含有_______个质子,________个中子。
【答案】x-26 A-x+26【分析】根据分子中各种元素的原子核外电子数的和等于总电子数,原子核外电子数等于其原子核内质子数,原子的质量数等于其质子数与中子数的和计算。
【详解】H原子核外只有1个电子,O原子核外有8个电子,则根据H2RO3分子中共有x个电子,可得该物质分子中R原子核外电子数为(x-1)×2-8×3=x-26;由于原子的质量数等于其质子数与中子数的和,R原子的核外电子数等于x-26,则其原子核内质子数也等于x-26,其质量数为A,故该原子核内中子数为A-( x-26)= A-x+26。



教育学科教师辅导讲义课 题 原子结构和核外电子排布规律教学目的了解元素原子核外电子排布的基本规律,能用原子(离子)结构示意图表示原子(离子)的核外电子排布教学内容一、知识引入复习初中原子性质:化学变化中不可再分,保持化学性质的最小微粒,在不停的运动,原子不显电性,电子带负电性,质子带正电性,中子不带电等知识。
二、知识梳理 一、原子构成1、构成原子的基本粒子及其性质2、质量数(A )忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值后相加,所得数值叫做质量数。
二、构成原子的微粒的关系(“二等式”)1、核电荷数(Z )= 核内质子数 = 核外电子数 = 原子序数2、质量数(A )= 质子数(Z )+ 中子数(N ) 三、构成原子的微粒的作用(“三决定”)1、质子数→元素种类2、最外层电子数→元素性质3、中子数→同位素4、同位素(1)定义:具有相同质子数,不同中子数的同种元素的原子互称同位素 (2)判据:质子数相同、中子数不同、原子 四、 电子式1、概念:用元素符号表示原子核和内层电子,并在元素符号的周围用·(或×)表示原子或离子最外层电子,这种式子叫做电子式。
构成原子的粒子原子核电子质子中子 电性和电量 一个单位正电荷 电中性 一个单位负电荷 质量/kg 1.673×10-27 1.675×10-27 9.041×10-31 相对质量1.0071.008 1/1836质量数A质子数Z化合价±ab ±离子电荷c 原子个数XH Mg2、图例:五、原子核外电子排布<一>、核外电子排布的一般规律(1)核外电子总是尽量先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层(能量最低原理)。
(2)原子核外各电子层最多容纳2n2个电子。
(3)原于最外层电子数目不能超过8个(K层为最外层时不能超过2个电子)。

[1]H氢1s1[2]He氦1s2[3]Li锂1s2 2s1[4]Be铍1s2 2s2[5]B硼1s2 2s2 2p1[6]C碳1s2 2s2 2p2[7]N氮1s2 2s2 2p3[8]O氧1s2 2s2 2p4[9]F氟1s2 2s2 2p5[10]Ne氖1s2 2s2 2p6[11]Na钠1s2 2s2 2p6 3s1[12]Mg镁1s2 2s2 2p6 3s2[13]Al铝1s2 2s2 2p6 3s2 3p1[14]Si硅1s2 2s2 2p6 3s2 3p2[15]P磷1s2 2s2 2p6 3s2 3p3[16]S硫1s2 2s2 2p6 3s2 3p4[17]Cl氯1s2 2s2 2p6 3s2 3p5[18]Ar氩1s2 2s2 2p6 3s2 3p6[19]K钾1s2 2s2 2p6 3s2 3p6 4s1 [20]Ca钙1s2 2s2 2p6 3s2 3p6 4s2 [21]Sc钪1s2 2s2 2p6 3s2 3p6 3d1 4s2 [22]Ti钛1s2 2s2 2p6 3s2 3p6 3d2 4s21s2 2s2 2p6 3s2 3p6 3d3 4s2*[24]Cr铬1s2 2s2 2p6 3s2 3p6 3d5 4s1 [25]Mn锰1s2 2s2 2p6 3s2 3p6 3d5 4s2 [26]Fe铁1s2 2s2 2p6 3s2 3p6 3d6 4s2 [27]Co钴1s2 2s2 2p6 3s2 3p6 3d7 4s2 [28]Ni镍1s2 2s2 2p6 3s2 3p6 3d8 4s2*[29]Cu铜1s2 2s2 2p6 3s2 3p6 3d10 4s1 [30]Zn锌1s2 2s2 2p6 3s2 3p6 3d10 4s2 [31]Ga镓1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 [32]Ge锗1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 [33]As砷1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p31s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 4[35]Br 溴1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5[36]Kr 氪1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 例3.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E )如下图所示。
第一章原子结构与性质第一节原子结构 .................................................................................................................. - 1 - 第1课时能层与能级构造原理 .............................................................................. - 1 - 第2课时基态原子核外电子排布原子轨道 ........................................................ - 13 - 第二节原子结构与元素的性质 ........................................................................................ - 27 - 第1课时原子结构与元素周期表 ............................................................................ - 27 - 第2课时元素周期律 ................................................................................................ - 41 -第一节原子结构第1课时能层与能级构造原理一、能层与能级1.能层(1)意义:根据多电子原子的核外电子的________差异,将核外电子分成不同的能层。
(2)符号:能层序数一、二、三、四、五、六、七分别用________________表示。
2.能级(1)意义:根据多电子原子中同一能层电子________不同,将它们分成不同的能级。
(2)符号:在每一能层中,能级符号分别为n s、n p、n d、n f……,其中n代表________。
八电子稳定结构的判断【例题】下列分子中所有原子都满足最外层为8电子结构的是A.BF3B.H2OC.SiCl4D.PCl5解析:根据定义,共价键中的电子被成键的两个原子共有,围绕两个原子核运动。
所以,形成共价键的原子的最外层电子数等于它本身最外层电子的个数加上它与其他原子形成共价键的数目。
据此,题中各原子的最外层电子个数为:A中B有3+3=6个、F有7+1=8个;B中H有1+1=2个、O有6+2=8个;C中Si有4+4=8个、Cl有7+1=8个;D中P有5+5=10个、Cl有7+1=8个。
答案:C规律总结:①分子中若含有氢元素,则氢原子不能满足最外层八电子稳定结构,但它满足K层为最外层两个电子的稳定结构。
同样Be原子最外层只有两个电子,在其化合物中最外层电子数也不可能满足八电子的稳定结构。
②分子中若不含有氢元素,可按下述方法进行判断:若某元素的化合价的绝对值与其原子最外层电子数之和等于八,则该元素的原子最外层满足八电子的稳定结构;否则不满足。
例如:CO2分子中,碳元素的化合价为+4价,碳原子最外层电子数为四,二者之和为八,则碳原子满足最外层八电子稳定结构;氧元素化合价为-2(其绝对值为2),氧原子最外层电子数为六,二者之和为八,则氧原子也满足最外层八电子的稳定结构。
如NO2分子中,氮元素的化合价为+4价,氮原子最外层的电子数为五,二者之和为九,故氮原子不满足最外层八电子的稳定结构。
再如BF3分子中,硼元素的化合价为+3,硼原子最外层的电子数为三,二者之和为六,故硼原子不满足最外层八电子的稳定结构。
③若为同种元素组成的双原子分子,则看该元素原子的最外层电子数目与其在分子中形成的共价键的数目之和是否为八,若为八,则其最外层满足八电子结构,反之不满足。
如常见的X2(卤素单质)、O2、N2等双原子单质分子中原子最外层为八电子稳定结构。
练习1:下列分子中,所有原子的最外层均为8电子结构的是A. BeCl2B. H2SC. NCl3D. SF4练习2:下列分子中,所有原子都满足最外层均为8电子结构且为非极性分子的是:A. PCl5B. SiH4C. NF3D. CO2元素周期表与元素周期律:一、选择题(每道题仅有一个选项符合题意)1. 张青莲是我国著名的化学家。
高考化学原子结构与元素周期表综合练习题及答案一、原子结构与元素周期表练习题(含详细答案解析)1.锌在工业中有重要作用,也是人体必需的微量元素。
回答下列问题:(1)Zn 原子核外电子排布式为__________洪特规则内容_____________泡利不相容原理内容______________________(2)黄铜是人类最早使用的合金之一,主要由Zn 和Cu 组成。
第一电离能I 1(Zn)__________I 1(Cu)(填“大于”或“小于”)。
原因是__________(3)ZnF 2具有较高的熔点(872℃ ),其化学键类型是__________;ZnF 2不溶于有机溶剂而ZnCl 2、ZnBr 2、ZnI 2能够溶于乙醇、乙醚等有机溶剂,原因是__________(4)金属Zn 晶体中的原子堆积方式如图所示,这种堆积方式称为__________,配位数为____六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为N A ,Zn 的密度为__________g·cm -3(列出计算式)。
【答案】1s 22s 22p 63s 23p 63d 104s 2或[Ar ]3d 104s 2 原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低 每个原子轨道上最多只能容纳两个自旋状态不同的电子 大于 Zn 核外电子排布为全满稳定结构,较难失电子 离子键 ZnF 2为离子化合物,ZnCl 2、ZnBr 2、ZnI 2的化学键以共价键为主、极性较小 六方最密堆积(A 3型2A 3N 6a c ⨯⨯⨯ 【解析】【分析】【详解】(1)Zn 原子核外有30个电子,分别分布在1s 、2s 、2p 、3s 、3p 、3d 、4s 能级上,其核外电子排布式为1s 22s 22p 63s 23p 63d 104s 2或[Ar]3d 104s 2,洪特规则是指原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低,而泡利原理是指每个原子轨道上最多只能容纳两个自旋状态不同的电子,故答案为:1s 22s 22p 63s 23p 63d 104s 2或[Ar]3d 104s 2;原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低;每个原子轨道上最多只能容纳两个自旋状态不同的电子;(2)轨道中电子处于全满、全空、半满时较稳定,失去电子需要的能量较大,Zn 原子轨道中电子处于全满状态,Cu 失去一个电子内层电子达到全充满稳定状态,所以Cu 较Zn 易失电子,则第一电离能Cu <Zn ,故答案为:大于;Zn 核外电子排布为全满稳定结构,较难失电子;(3)离子晶体熔沸点较高,熔沸点较高ZnF 2,为离子晶体,离子晶体中含有离子键;根据相似相溶原理知,极性分子的溶质易溶于极性分子的溶剂,ZnF 2属于离子化合物而ZnCl 2、ZnBr 2、ZnI 2为共价化合物,ZnCl 2、ZnBr 2、ZnI 2分子极性较小,乙醇、乙醚等有机溶剂属于分子晶体极性较小,所以互溶,故答案为:离子键;ZnF 2为离子化合物,ZnCl 2、ZnBr 2、ZnI 2的化学键以共价键为主,极性较小;(4)金属锌的这种堆积方式称为六方最密堆积,Zn 原子的配位数为12,该晶胞中Zn 原子个数=12×16+2×12+3=6,六棱柱底边边长为acm ,高为ccm ,六棱柱体积=[(6×23a )×3×c]cm 3,晶胞密度=2A m V 3N 6a c =⨯⨯⨯,故答案为:六方最密堆积(A 3型);12;2A 3N 6a c ⨯⨯⨯。
原子的核外电子排布1.原子结构行星模型告诉我们,核外电子在原子核外的外周运动,那么原子的核外电子是怎样排布在原子核外的呢?下图是1~20号元素核外电子的排布图,仔细观察图像,回答下列问题:注:在圆内标出原子的核电荷数,外面用弧线表示电子层,每层排的电子数目在弧线上标出。
(1)第一层最多排_______个电子,第二层最多排________个电子,第三层最多排______个电子。
规律:第n层最多容纳的电子数为______________(用含n的代数式表示)。
(2)最外层最多排_______个电子。
(3)第二层电子的能量比第一层电子的能量_________(填“大”或“小”,提示:从原子核对电子的作用思考)。
2.电子层的表示方法及能量变化:3.核外电子的排布规律:(1)能量最低原则:核外电子总是先排布在能量______的电子层里,然后再按照由______向______的顺序依次排布在能量逐渐升高的电子层里。
(2)电子分层排布的原则:①第n层最多容纳的电子数为______。
②最外层不超过________个(K层为最外层时,不超过_____个)。
4.原子结构示意图:在圆内标出原子的核电荷数,外面用弧线表示电子层,每层排的电子数目在弧线上标出,如:5.阴阳离子的形成:(1)当原子_________(填“得到”或“失去”)电子时便形成阴离子,如N3-、O2-、F-。
(2)当原子_________(填“得到”或“失去”)电子时便形成阳离子,如Na+、Mg2+、Al3+。
规律:a.当原子的最外层电子数大于4时,原子易______(填“得”或“失”)电子形成_____离子(填“阴”或“阳”)。
b.当原子的最外层电子数小于4时,原子易______(填“得”或“失”)电子形成_____离子(填“阴”或“阳”)。
6.“8e”稳定结构:___________________________________________。
由“8e”稳定结构可知,N元素常见的化合价是________,S元素常见的化合价是__________。
规律:元素的最高正化合价=__________________,元素的最低负化合价=_________________。
7.原子的电子式:元素的化学性质主要由_________________决定,我们常用小黑点或×来表示元素原子的最外层上的电子。
分别写出下列粒子的电子式:Na_______、Na+__________、Cl_________、Cl-________、NH4+_________、OH-_________。
8.微粒半径大小的比较:(1)电子层数越多,微粒半径越______,如r(O)______ r(Na)。
(2)电子层数相同,核电荷数越大,微粒半径越_________,如r(Mg)______ r(Al)。
(3)电子层数相同,核电荷数也相同,电子数越多,微粒半径约___________,如r(Cl)______ r(Cl—)。
规律:不同的原子结构对应不同的性质(如化合价、半径大小等),这就是“结构决定性质”。
9.核外有十电子的微粒有:__________________________________________________________。
10.核外有十八电子的微粒有:________________________________________________________。
例1.(核外电子的排布规律)1.1.下列叙述中,正确的是(A)A.在多电子的原子里,能量高的电子通常在离核较远的区域内运动B.核外电子总是先排在能量低的电子层上,如M层只有排满18个电子后才能排N层C.两种微粒,若核外电子排布完全相同,则其化学性质一定相同D.微粒的最外层只能是8个电子才稳定1.2.A元素原子L层比B元素L层少2电子,B元素的核外电子总数比A元素的核外电子总数多5个,则A、B 可形成(D)A.ABB.A2BC.A2B3D.B2A3例2.(原子或离子结构示意图、电子式的书写)2.写出下列原子或离子的结构示意图和电子式:(1)碳原子(C)_________、______________,(2)钾原子(K)_________、______________,(3)硫离子(S2-)_________、______________,(4)铝离子(Al3+)_________、______________,例3.(微粒半径的比较)3.1.下列各组粒子中粒子半径由大到小的是__________________(填字母)。
(A)O、Cl、S、P (B)Al3+、Mg2+、Ca2+(C)K+、Mg2+、Al3+、H+(D)Li、Na、K(E)Fe、Fe2+、Fe3+(F)Cl-、O2-、Na+、Mg2+(G)H-、H、H+解:C、E、F、G3.2.已知a A n+,b B(n+1)+,c C n-,d D(n+2)-是具有相同的电子层结构,回答下列问题:(1)a、b、c、d原子序数由大到小排序为:____________________________。
(2)A、B、C、D原子半径由大到小排序为:____________________________。
(3)a A n+、b B(n+1)+、c C n-、d D(n+2)-离子半径由大到小排序为:_______________________。
例4.(不同的原子结构对应不同的化合价,“结构决定性质”)4.X元素原子最外层电子数是Y元素原子最外层电子数的3.5倍,由它们形成的化合物的化学式为(D )A.Y2X7B.Y7X2C.Y2XD.YX2变式训练:A n+表示,下列关于该粒子的叙述正确的是(D )1.某粒子用符号MZA.所含质子数为(A – N)B.所含中子数为(A – Z + n)C.所含电子数为(Z + n)D.中子数比电子数多(A – 2Z + n)2.下列各微粒:①H3O+、NH+4、Na+;②OH-、NH-2、F-;③O2-2、Na+、Mg2+;④CH4、NH3、H2O,以上具有相同质子数和电子数的一组是(B)A.①②③B.①②④C.②③④D.①③④3.X原子的核电荷数为a,它的阴离子X m-与Y原子的阳离子Y n+的电子层结构相同,则Y原子的核电荷数为(A)A.a+m+nB.a-m-nC.m+n-aD.m-n-a4.核外电子层结构相同的一组微粒是(D)A.Mg2+Al3+Cl﹣NeB.Na+F﹣Cl﹣ArC.Na+Mg2+Cl﹣S2﹣D.F﹣Na+Mg2+Ne5.下列说法或化学用语正确的是(C)A.146C原子中质子数为6、中子数为14B.16O2与18O2是两种不同的核素C.23Na+和24Mg2+具有相同的中子数和电子数D.S2-的结构示意图:6.下列化合物中,阴阳离子电子层结构相同的是( B )A.氯化钠B.氧化镁C.氧化钾D.氧化钙7.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1~10的元素中,满足上述关系的元素共有(B )A.1对B.2对C.3对D.4对8.下列各组微粒半径大小比较中,不正确的是(B)A.r(K)>r(Na)>r(Li)B.r(Mg2+)>r(Na+)>r(F-)C.r(Na+)>r(Mg2+)>r(Al3+)D.R(Cl-)>r(F-)>r(F)9.A+、B2+、C-、D2-四种离子具有相同电子层结构。
有以下排列顺序:①B2+>A+>C->D2-;②C->D2->A+>B2+;③B2+>A+>D2->C-;④D2->C->A+>B2+,四种离子的半径由大到小以及四种元素原子序数由大到小的顺序分别是(B )A.①④B.④①C.②③D.③②10.X 和Y 两元素的阳离子具有相同的电子层结构,X 元素的阳离子半径大于Y 元素的阳离子半径;Z 和Y 两元素的原子核外电子层数相同,Z 元素的原子半径小于Y 元素的原子半径。
X 、Y 、Z 三种元素的原子序数的关系是(D )A.X>Y>ZB.Y>X>ZC.Z>X>YD.Z>Y>X11.下列化合物中,阴离子和阳离子的半径之比最大的是( A )A.Al 2S 3B.NaFC.KClD.NaCl12.某金属R 原子的质量数为54,已知R 离子含有28个中子,23个电子,由这种离子组成的化合物的化学式正确的是( C )A.RCl 2B.R 2OC.R 2O 3D.HRO 313.X 、Y 、Z 三种元素,已知X 和Y 原子核外电子层数相同,Y 和Z 最外层电子数相同,又知 三种元素原子最外层电子数总和为14,而质子数总和为28,则三种元素分别为( D )A.N 、P 、OB.N 、C 、SiC.B 、Mg 、AlD.C 、N 、P14.(2016上海)硼的最高价含氧酸的化学式不可能是( B )A.HBO 2B.H 2BO 3C.H 3BO 3D.H 2B 4O 715.短周期元素A 和B 可形成AB 3型化合物。
若B 原子序数为m ,则A 的原子序数可能为( D )①m+6 ②m+4 ③m-4 ④m+8 ⑤m+14 ⑥m-12A.②③⑥B.①②③④C.①②③⑥D.①②③④⑤⑥16.某元素的同位素X 原子的质量数为A ,含N 个中子,它与1H 原子构成H m X 分子,在a g H m X 中所含原子的物质的量为__________,所含中子的物质的量为________,所含质子数为__________,所含电子数为_____________。
解:a A +m (m +1)mol a A +m N mol a A +m ×(m +A -N )N A a A +m(m +A -N )N A17.用1 ~ 20号元素符号填空:(1)原子中无中子的原子:H(2)最外层电子数与K 层电子数相同的是:H 、He 、Be 、Mg 、Ca(3)最外层电子数=次外层电子数的元素:Be 、Ar(4)最外层电子数是次外层电子数2倍的元素是:C(5)最外层电子数是次外层电子数3倍的元素是:O(6)最外层电子数是次外层电子数4倍的元素是:Ne(7)最外层电子数与电子层数相等的元素是:H 、Be 、Al(8)最外层电子数是电子层数2倍的元素是:He 、C 、S(9)最外层电子数是电子层数3倍的元素是:O(10)最外层电子数是电子层数4倍的元素是:Ne(11)次外层电子数是最外层电子数2倍的元素是:Li 、Si(12)核电荷数是电子层数的5倍,是最外层电子数的3倍的元素是:P(13)除稀有气体元素外,原子半径最大的元素原子是:K(14)原子M 层有电子,N 层无电子且原子半径最大的原子结构示意图为:Na18.有A、B、C、D四种元素,已知A+离子的原子核外没有电子,B原子的最外层电子数是次外层电子数的三倍,B原子、C+离子、D原子的电子层数相同,常见的D单质是黑色固体,B、C、D三种元素可分别形成DB2型和C2B型化合物,试回答下列问题:(1)写出A、B元素形成的离子的电子式。