钠灯光谱谱图分析
- 格式:pdf
- 大小:376.90 KB
- 文档页数:7
谱线的识别我选做实验的名称是“氢光谱与类氢光谱”,就是测量氢与类氢元素的光谱并对光谱加以分析。
在这个实验中我在谱线的识别方面进行了一些研究。
原理:由于该实验要求我们计算钠原子光谱各个线系的量子缺损,因此首先我所要做的就是把各个线系的谱线分开来。
我通过查找相关资料获得了钠原子光谱的详细信息(见附录1),这里面包括了多少纳米的波长(理论值)对应的哪一种跃迁也就是对应哪一个谱线系。
因此我现在所要做的就是将实验所测得的波长与我所查找到的理论值一一对应起来。
这里需要说明的是:对于查找到的理论值,我只承认它的准确性,但不承认它的完备性。
也就是说可能理论值给出的钠原子谱线并不完全,但是只要理论值中出现的波长,我都认为它是正确的。
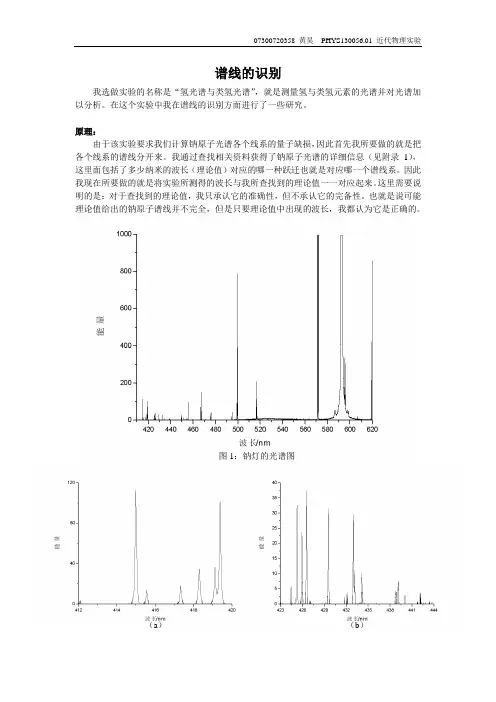
图1:钠灯的光谱图(a)(b)(c)(d)(e)(f)图2:钠灯光谱图的放大图如图1所示是实验所测得的钠灯的光谱图。
虽然谱线波长的数值都已经标在了坐标轴上,然而这些数据却是不能直接使用的。
因为光谱仪在运转的过程中,由于电机运转不可避免的会产生误差,而且这种误差会随着电机运转距离的增长而变大。
显然将实验值和理论值直接一一比对比较困难而且会产生较大误差的。
因此我采用以下办法来查找与实验值对应的理论值。
首先我们先把钠灯所具有的谱线绘成一张表,见附录2的“谱线波长实验值”这一列。
另外由于理论值所测定的波长非常的详细,有的甚至能给出相邻仅仅0.00036nm的两根谱线,而我们实验室光谱仪所能测量的最小波长差为0.01nm,也就是说诸如上面相邻仅0.0036nm的两根谱线从实验测得的谱线上看来其实是一条,这还不包括出射缝的大小对于分辨能力的限制。
因此为了便于与实验值更好的核对,我将理论值做了如下处理:将理论值中相邻波长小于0.01nm的两根(或更多)谱线用它们的平均值代替见附录2的“谱线波长理论值”这一列。
虽然经过以上处理,但是我们还是很难看出实验值与理论值有什么相似之处,这主要是由于上面所说的光谱仪运转误差较大的缘故。

数据处理用线性内插法求钠谱线波长5S→3P已知λFe1=6152.0A λFe2=6167.5AX Fe1=128.2000mm X Fe2=130.4071mmX Na1=128.6134mm X Na2=129.5155mm按照线性内插法有:λNa=λFe1+(X Na-X Fe1)(λFe2-λFe1)/(X Fe2-X Fe1)将数值代入上式有λNa1=6153.2A λNa2=6160.5A ¯λ=6156.85A 6S→3P已知λFe1=5145.0A λFe2=5155.6AX Fe1=126.6000mm X Fe2=127.9467mmX Na1=127.0362mm X Na2=127.6445mm按照线性内插法有:λNa=λFe1+(X Na-X Fe1)(λFe2-λFe1)/(X Fe2-X Fe1)将数值代入上式有λNa1=5148.7A λNa2=5153.4A ¯λ=5151.05A将计算结果制成表格如下表一波长1 波长2 平均波长5S→3P 6153.2A 6160.5A 6156.85A6S→3P 5148.7A 5153.4A 5151.05A求出波数˜υn+1˜υn再求出△˜υ。
因为˜υ=1/λ,将上表格数据代入,得:˜υn+1=˜υ6=19414(cm-1)˜υn=˜υ5=16242(cm-1)所以△˜υ=˜υn+1- ˜υn=3172.0(cm-1)由里德伯表查的相应的m值为3,a值为0.65则n*=m+a=3.65确定光谱项T(n)=R/n*2=8253.2(cm-1)求出量子缺△L=n-(m+a)=1.35 求出˜υ∞=˜υ+T(n)=24495.2(cm-1)主线系的线系线确定后,基态的能级就确定为E=-˜υ∞hc=4.87*10-19J依以上数据求得:钠原子能级公式 ENa= -hcR/(n-ΔL)^2= -13.61477/(n-1.36)^2 氢原子能级公式 EH= -hcR H/n^2= -13.61557/n^2钠原子的能级图和同一主量子数的氢原子能级图处理如下用Matlab编程如下:ENa=zeros(6,1);EH=zeros(6,1);for n=3:8ENa(n-2)=-13.61477/(n-1.35)^2;EH(n-2)=-13.61557/n^2;t1=0.2:0.005:1;t2=1.5:0.005:2.4;plot(t1,ENa(n-2),'-b',t2,EH(n-2),'-r')hold onendxlabel('钠原子锐线系氢原子'); ylabel('能级E(n)/10^(-19)焦耳');title('钠原子能级和主量子数相同的氢原子能级的位置');text(1,ENa(1),'3s');text(2.3,EH(1),'3');text(1,ENa(2),'4s');text(2.3,EH(2),'4');text(1,ENa(3),'5s');text(2.34,EH(3),'5');text(1,ENa(4),'6s');text(2.3,EH(4),'6');text(1,ENa(5),'7s');text(2.34,EH(5),'7');text(1,ENa(6)+0.07,'8s');text(2.3,EH(6)+0.07,'8');能级图如下:实验心得做这个实验,给我的感觉是比较轻松的。

高中物理课堂钠元素吸收光谱的简易观察方法钠元素是许多物理课堂实验中重要的实验材料,它产生了一种独特的吸收光谱。
高中物理教师可以利用这一特性研究光学。
本文旨在介绍钠元素吸收光谱的简易观察方法。
钠元素吸收光谱是一种特殊的光谱,它由正常化的可见光和紫外光构成。
正常化的可见光是从钠元素中放射出的最激发的可见光,它可以观察到的波长范围比紫外光更短。
紫外光是从钠元素中放射出的电磁波,它可以观察到的波长比可见光更长。
为了更好地观察钠元素吸收光谱,需要准备一些必要的实验设备。
首先,需要一个可在实验室中使用的钠灯,它可以模拟钠元素的发射光。
其次,可以准备一个光谱分析仪,用于观察钠元素吸收光谱的可见光和紫外光。
此外,还需要一台稳定供电的照明设备,以保证实验过程的最大稳定性。
实验过程的主要步骤如下:首先,将钠灯放置在稳定的环境中,并启动它以发射紫外光和可见光。
其次,使用光谱分析仪观察钠元素吸收光谱中的可见光和紫外光,记录由正常化的可见光和紫外光构成的波长形成的吸收光谱图。
最后,通过对所获得的吸收光谱图的分析,获得钠元素的光谱特征,并进行深入研究。
在高中物理课堂中,钠元素吸收光谱的简易观察方法是观察光学性质最重要、最容易实践的实验之一。
本文介绍了利用实验模拟的物理课堂实验,即利用钠元素发射的最激发的可见光和紫外光来观察钠元素吸收光谱的简易观察方法。
通过使用这种简易的观察方法,可以
清楚地观察到钠元素的光谱特征,进而深入地研究光学性质。
以上就是钠元素吸收光谱的简易观察方法的简要介绍,希望对大家有所帮助!。

1-2钠原子光谱-图文1.2钠原子光谱氢原子光谱和波尔理论给出了单纯正负电荷间相互吸引作用的电场量子化规律。
正确认识复杂原子光谱的规律,是完善波尔理论的必要条件。
在多电子原子体系中,碱金属原子只有一个价电子,与氢原子的结构相似,分析二者原子光谱的异同,是研究复杂原子光谱的切入点,不但认清了同种电荷间排斥作用的电场量子化规律,为解释元素的周期律奠定基础,还导致电子自旋的发现。
多电子原子中存在原子核-电子、电子-电子以及自旋-轨道多重相互作用。
通过拍摄钠原子光谱,在测量波长和分析光谱线系的基础上,根据价电子在不同轨道运动时的量子缺来理解电子-电子排斥作用对能级结构的影响,可以较全面地掌握光谱分析技术的基本方法。
一、实验目的(1)测量钠主线系的谱线波长;(2)了解原子光谱与原子结构的关系,求钠原子主线系的量子改正数(量子缺)。
二、实验原理原子中电子绕核运动的能量是量子化的。
电子从一个能级跃迁到另一能级,就要辐射或吸收一定的能量,由此形成原子的发射光谱或吸收光谱。
电子在主量数为n2和n1的上、下能级之间跃迁时,其发射光谱的波数为11~1(EE)R,(1.2.1)2122hcn1n2其中E1与E2分别表示上能级与下能级的能量,h为普朗克常数,c为光速,R为里德伯常数。
每一谱线的波数都可以表达为两光谱项之差,即~TT,(1.2.2)12T为光谱项,对于氢原子,光谱项可写成TRH。
(1.2.3)n2碱金属(Li,Na,K,Rb,C,Fr)原子只有一个价电子,在由原子核和闭壳层电子组成的离子实库仑场中运动,具有和氢原子相仿的结构,但比氢原子和类氢离子(He原子去掉一个核外电子形成的离子)要复杂。
这是由于碱金属原子中存在离子实的极化与贯穿,电子在主量子数n相同、轨道量子数l(l=1,2,…,n-1)不同的轨道上运动,其能量并不相同。
因此,电子的能量与n和l都有关系,即每个主量子数为n的能级分为n个子能级。
离子实的极化(离子实正负电荷中心不重合)与贯穿(价电子穿入离子实封闭电子壳层)都会使价电子受到附加的吸引作用,因此能量比氢原子体系的能量要低。


钠原子光谱的观测与分析实验者:梁家伟 合作者:窦家琪 实验日期:2017.3.7 指导老师:余云鹏摘要:本实验采用 WGD -8A 型光栅光谱仪观测 GY 一 5 型钠光灯发射出的钠原子光谱。
通过Na 原子光谱分辨出Na 原子光谱的各线系,计算量子缺,然后绘制能级图,本实验能计算出的量子缺与标准值相差很小。
关键词:Na 原子光谱、量子缺、能级、线系、光谱、双黄线。
一.引言对元素的光谱进行研究是了解原子结构的重要途径之一。
通过对原子光谱的 研究使我们了解原子内部电子的运动并导致电子自旋的发现和元素周期表的解 释。
通过对氢原了光谱的研究,人们认识到电子围绕原子核运动时只能处于一系 列能量不连续的状态,获得了关于氢原子结构的知识。
对于多电子原子,除了原 子核和电子的相互作用外,还存在着电子之间的相互作用,电子的自旋运动和轨 道运动的相互作用也更为显著。
本实验以钠原子光谱为例,通过对钠原子光谱的 观察、拍摄和分析,加深对碱金属原子中外层电子与原子实互作用以及自旋与轨 道运动相互作用的了解,在对光谱线系进行分析和波长测量的基础上,计算钠原 子中价电子在不同轨道运动时的量子缺,绘制钠原子的部分能级图,并根据双重 线不同成分的波长差,计算价电子在某些轨道运动时原子实的有效电荷。
二、实验原理(一)钠原子光谱的线系碱金属原子只有一个价电子,价电子在核和内层电子组成的原子实的中心力场中运功,和氢原子有点类似。
但是,由于原子实的存在,价电子处在不同量子态时,或者按轨道模型的描述,处于不同的轨道时,它和原子实的相互作用是不同的。
这主要是,价电子处于不同轨道时,它们的轨道在原子实中贯穿的程度不同,所受到的作用不同;其次,价电子处于不同轨道时,引起原子实极化的程度也不同,这二者都要影响原子的能量。
即使电子所处轨道的主量子数 n 相同而轨道量子数 l 不同,原子的能量也是不同的,因此原子的能量与价电子所处轨道的量子数 n ,l 都有关。


低压钠灯和高压钠灯的光谱
低压钠灯和高压钠灯都是常见的气体放电灯,它们的光谱特点有所不同。
低压钠灯主要由一种称为钠蒸汽的气体充填而成。
它的光谱主要由两个窄谱线组成,即589.0纳米和589.6纳米的黄色谱线。
这两条谱线对应着钠原子在激发态和基态之间的电子跃迁。
低压钠灯主要用于路灯和室内照明,因为它的光谱主要集中在黄光,对于提供良好的视觉效果和夜间能见度较好。
而高压钠灯则使用高压电流使钠气体产生放电。
高压钠灯的光谱相对比较宽,除了包含低压钠灯的黄光谱线外,还包括一些其他波长的光线。
高压钠灯的光谱在黄色到橙色之间,能够提供相对较高的亮度和较好的能见度。
因此,高压钠灯常被用于道路照明、工业区域和户外场所。
总的来说,低压钠灯的光谱主要集中在黄光谱线上,而高压钠灯的光谱则相对宽广,包含了更多的波长范围。

钠原⼦光谱的观测与分析钠原⼦光谱的观测与分析Abstract :This experiment aims at measure and observe the spectrums of sodium by AtomicEmission Spectrometry.And some spectrums of the principal series,sharp series and diffuse serieshave been received.Some erros have been found and explained and the intensions of somespectrums just conform to the law of the summation of the intensions.关键词:原⼦物理原⼦光谱项的波长原⼦发射光谱法 Na 原⼦平⾯光栅单⾊仪引⾔:通过对氢原⼦的研究,⼈们认识到电⼦围绕原⼦核运动时只能处于⼀系列能量不连续的状态,获得关于氢原⼦结构的知识,对于多电⼦原⼦,除了原⼦核和电⼦的相互作⽤外,还存在着电⼦之间的相互作⽤,电⼦的⾃旋运动和轨道运动的互相作⽤也更为显著。
本试验以钠原⼦光谱为例,通过对钠原⼦光谱的观察,分析,加深对碱⾦属原⼦中外层电⼦和原⼦实相互作⽤以及⾃旋与轨道运动相互作⽤的了解,在对光谱线系进⾏分析和波长测量的基础上,计算钠原⼦中价电⼦在不同轨道运动时的量⼦缺,绘制钠原⼦的部分能级图,并根据双重线不同成分的波长差,计算价电⼦在某些轨道运动时原⼦实的有效电荷。
理论部分:(⼀)原⼦光谱的产⽣:1、原⼦的壳层结构原⼦是由原⼦核与绕核运动的电⼦所组成。
每⼀个电⼦的运动状态可⽤主量⼦数n 、⾓量⼦数l 、磁量⼦数l m 和⾃旋量⼦数s m 等四个量⼦数来描述。
主量⼦数n ,决定了电⼦的主要能量E 。
⾓量⼦数l ,决定了电⼦绕核运动的⾓动量。
磁量⼦数l m (轨道⽅向的量⼦数),决定了电⼦绕核运动的⾓动量沿磁场⽅向的分量。

实验简介碱金属是元素周期表中的第一列元素(H除外),包括Li、Na、K、Rb、Cs、Fr,是一价元素,具有相似的化学、物理性质。
碱金属原子的光谱和氢原子光谱相似,也可以归纳成一些谱线系列,而且各种不同的碱金属原子具有非常相似的谱线系列。
碱金属原子的光谱线主要由4个线系组成:主线系、第一谱线系(漫线系)、第二辅线系(锐线系)和柏格曼线系(基线系)。
碱金属原子与氢原子在能级方面存在差异,而且谱线系种类也不完全相同。
原子实的极化和轨道贯穿理论很好的解释了这种差别。
进一步对碱金属原子光谱精细结构的研究证实了电子自旋的存在和原子中电子的自旋与轨道运动的相互作用,即自旋-轨道相互作用,这种作用较弱,由它引起了光谱的精细结构。
钠原子光谱及其相应的能级结构具有碱金属原子光谱和能级结构的典型特征。
本实验以钠原子光谱为研究对象,通过摄谱、识谱和波长测量,求出量子缺和钠原子若干激发态能级。
实验原理⏹原理●钠原子由一个完整而稳固的原子实和它外面的一个价电子组成。
原子的化学性质以及光谱规律主要决定于价电子。
●与氢原子光谱规律相仿,钠原子光谱线的波数可表示为两项差(1)其中为有效量子数,当无限大时,,为线系限的波数。
●钠原子光谱项它与氢原子光谱项的差别在于有效量子书不是整数,而是主量子数n减去一个数值,即量子修正,成为量子缺。
量子缺是由原子实的极化和价电子在原子实中的贯穿引起的。
碱金属原子的各个內壳层均被电子占满,剩下的一个电子在最外层轨道上,此电子称为价电子,价电子与原子的结合较为松散,与原子核的距离比其他內壳层电子远得多,因此可以把除价电子之外的所有电子和原子核看作一个核心,称为原子实。
由于价电子电场的作用,原子实中带正电的原子核和带负电的电子的中心会发生微小的相对位移,于是负电子的中心不再在原子核上,形成一个电偶极子。
极化产生的电偶极子的电场作用于价电子,使它受到吸引力而引起能量降低,降低了势能,此即轨道贯穿现象。
原子能量的这两项也将受到原子实的附加引力,降低了势能,此即轨道贯穿现象。
钠原子光谱实验报告一、实验目的与实验仪器1、了解钠原子光谱的实验规律以及与原子结构的关系;2、测定钠原子光谱;学会辨认同一线系的钠原子光谱线,由波长计算光谱项、量子缺和主量子数,并绘制钠原子能级图;3、根据钠原子双黄线波长差,估算钠原子有效电荷数和内部磁场,加深对自旋轨道耦合的认识。
仪器:WGD-8A型组合式多功能光栅光谱仪,钠光谱灯,汞灯等二、实验原理(要求与提示:限400字以内,实验原理图须用手绘后贴图的方式)钠原子光谱有类似于氢原子的规律,但是由于作用于价电子上的电场与点电荷有显著不同,所以光谱项是用有效量子数n‘’代替主量子数n。
若不考虑电子自旋和轨道运动的相互作用引起的能级分裂,钠原子光谱项可以写成其中为钠原子的里德伯常数;称为量子缺,是和主量子数n和轨道量子数l有关的修正系数。
当n不是很大时,量子缺的大小主要取决于轨道量子数l,本实验近似认为与n无关。
钠原子光谱线的波数或其中表示下能级的有效量子数,表示上能级的有效量子数。
也可以写成它表示电子从上能级跃迁到下能级发射的光谱线的波数。
如果固定下能级,而改变上能级,则得到一系列值,构成一个光谱线系。
在各谱线系中,不变,称为固定项,记作。
光谱中常用这种符号表示一个线系,并且分别用表示。
原子有效电荷数和内部磁场估算电子具有两种自旋取向,即自旋向下和自旋向上。
钠原子价电子轨道运动产生的磁场与自旋磁矩相互作用,产生了附加能,此处取的方向为z方向,由于电子磁矩,故由于该附加功能的产生,能级发生分裂,谱线发生分裂,出现精细结构,,从而由此可以估算出原子内部的磁场大小。
谱线双层能级的间隔可用波数差表示:其中,为里德伯常数,α为精细结构,z为原子的有效电荷数,n为主量子数,l为轨道量子数,若已知α、、l、n、和波数差,就可以计算出原子的有效电荷数z。
三、实验步骤1、把光栅光谱仪上的接收方式选择开关扳到光电倍增管位置,接通光栅光谱仪电源,接通控制计算机电源,将光电电压调至500-800V之间,在控制计算机上启动WGD-8A型软件。
钠原子光谱的拍摄与分析物理系宫明 00004045试验目的:通过对钠原子光谱的观察、拍摄和分析,加深对碱金属原子中外层电子与原子实相互作用以及自旋与轨道运动的相互作用的了解。
实验器材:钠光灯、光栅摄谱仪、光电倍增管、A/D接口、计算机和相应软件系统。
实验原理:1、钠原子光谱的线系:碱金属原子只有一个价电子,所以和氢原子类似,但是由于价电子在原子实中贯穿的程度和引起原子实极化的程度与价电子的量子态有关,所以电子的能量与量子数n,l都有关。
钠原子光谱有四个线系:主线系:3S—nP,有自吸收线,仅共振线在可见区漫线系:3P—nD,谱线展宽明显锐线系:3P—nS,谱线比较清晰基线系:3D—nF,全部在红外区2、钠原子光谱的双重结构:由于电子自旋和轨道运动的相互作用使能级分裂,钠原子光谱显示出双重结构。
主线系光谱线双重结构的两个成分中短波成分与长波成分的强度比为2:1,而锐线系和漫线系则相反。
实验步骤:1、打开光源、光电倍增管、计算机电源,进入软件界面,定标光电管位置。
2、调整光源位置和单色仪的两个狭缝宽度,初步测量300nm—620nm间的谱线分布和相对强度。
3、调整光源位置,分别测量记录不同强度的各个谱线,依据共振线定标。
4、记录各个谱线的位置、强度、特点等数据。
5、退出软件系统,关闭所有仪器。
数据处理:原始测量数据:(范围:300nm—620nm负高压:6增益:6采集次数:10)定标误差曲线: (用处见后面问题思考)∆λ/n mλ/nm能级图:对于3p 轨道有效电荷的计算:0034.1*=∆-=ln n Z σ问题思考:1、在光路的设计上,应当把狭缝尽量放小,而光源在需要时可以尽量接近狭缝,使得在保证光强的同时尽量使单色仪的分辨率提高。
2、可以通过把光源移近和拉远两次扫描并对比所得光谱,来得到每条光谱线的来源信息:如果来自于钠光灯,则光源移近后增强明显,反之则为杂散光(普通日光灯也是发射线)。
3、共振线在弥散较强烈的发射线背景上有一条吸收线。
Na光谱谱系的判断方法摘要本文主要分析Na原子的光谱图,并提出两种方法判断不同波长的谱线所属的线系。
里德伯表法和相对强度法各有优劣,它们分别适用于不同的要求。
关键词光谱图线系判断方法波长相对强度一、引言与氢原子不同的是,Na原子的光谱谱线的产生与轨道量子数有关,不同轨道量子数产生的跃迁属于不同的光谱线系。
判断光谱线所在的线系是类氢实验的主要目的之一。
本文通过研究Na光谱图,提出了两种方法来判断谱线所在的线系。
二、理论依据1、Na原子光谱谱线系钠原子光谱有四个主要线系:主线系 3S→nP, n≥3锐线系 nS→3P, n≥4漫线系 nD→3P, n≥3基线系 nF→3D, n≥32、Na原子能级图光线波长图中,右边指的是波数,即波长的倒数,而图中圈出来的数字指的是两个能级跃迁的光谱线波长。
4、里德伯表对常规的里德伯表进行波数的变换,可以得到下述关于Na原子光谱线四个线系的里德伯表。
对照里德伯表与Na 原子特征波长,可以准确判断出谱线线系。
5、Na 原子的双重结构电子具有自旋,自旋量子数 s=1/2。
由 于电子自旋和轨道运动的相互作用,使原子具有附加能量。
该附加能量除了与量子数 n ,l 有关外,还与原子的总角动量的量子数 j 有关,因此同一光谱项又分裂为不同能级。
不同能级的跃迁发射出不同波长的Na 光,表现在谱线上,就形成了Na 双线的的现象。
四个线系的双线之间的相对强度是不同的,通过判断双线之间的相对强度就可以判断出光谱线所属的线系。
以下分别对四个线系的相对强度进行分析:原子从上能级 n 至下能级m 的跃迁发出的光谱线强度为式中,N 代表上一个能级的粒子数,A 代表跃迁几率,h ν表示的是两个能级的能级差根据玻尔兹曼分布,可以近似的认为:因此,通常情况下,只要知道跃迁几率,就可以求出光谱线强度了,然后就可以计算不同线系之间不同能级跃迁产生的不同相对强度。
但实际上,我们通常根据强度和定则计算相对强度。