第八章 气体成分分析
- 格式:ppt
- 大小:12.27 MB
- 文档页数:97



油气测试方法一、化学分析方法1. 气体成分分析:气体成分分析是研究天然气组成和性质的基础。
常用的气体成分分析方法包括色谱法、质谱法等。
色谱法是一种通过气相色谱仪将气体成分分离并进行定量分析的方法,而质谱法则是通过质谱仪对气体成分进行检测和分析的方法。
2. 原油成分分析:原油成分分析是研究原油成分和性质的重要方法。
常用的原油成分分析方法包括色谱法、质谱法、核磁共振法等。
这些方法可以分析出原油中各种组分的含量和比例,从而确定原油的性质和品质。
3. 残余烃分析:残余烃分析主要是分析石油加工过程中残留的烃类化合物。
常用的残余烃分析方法包括色谱法、质谱法、元素分析法等。
这些方法可以确定残留烃的种类、含量和分布规律,为石油加工工艺的优化提供依据。
二、物理测试方法1. 密度测定:密度是描述油气物质密度大小的重要指标,对于估算油气的含量和储量具有重要意义。
常用的密度测定方法有液体置换法、气体置换法等。
这些方法可以测定油气的密度、容重等参数,并通过比较和计算得出油气的含量和储量。
2. 粘度测定:粘度是描述油气物质流动性的重要参数,对于评估油气开采和输送过程中的流动性能具有重要意义。
常用的粘度测定方法有旋转粘度计法、流变仪法等。
这些方法可以测定油气的粘度、黏度指数等参数,并通过比较和计算得出油气的流动性能。
3. 闪点测定:油气的闪点是在一定条件下恰好会发生燃烧或爆炸的温度,对于油气的储运和使用安全具有重要意义。
常用的闪点测定方法有闭口杯法、开口杯法、闪点测试仪法等。
这些方法可以测定油气的闪点和燃点,评估油气的安全性能。
三、地质测试方法1. 地震勘探:地震勘探是一种通过地震波在地下传播和反射的原理,对地下岩石结构和油气储层进行探测和识别的方法。
地震勘探可以提供地下岩石结构和油气储层的三维地质模型,为油气资源的勘探和开发提供依据。
2. 电磁勘探:电磁勘探是一种利用电磁场对地下物质进行探测和识别的方法。
电磁勘探可以在地下发现含水层、油气储层等目标物质,为油气资源的勘探和开发提供依据。

空气中的“流浪汉”第一章:认识空气中的气体成分1.1 教学目标:让学生了解空气的组成,知道空气中各成分的体积分数。
让学生掌握氧气、氮气、稀有气体、二氧化碳和其他气体等空气成分的性质和用途。
1.2 教学内容:空气的组成:氮气、氧气、稀有气体、二氧化碳和其他气体。
各成分的体积分数:氮气约占78%,氧气约占21%,稀有气体约占0.94%,二氧化碳约占0.03%,其他气体约占0.03%。
各成分的性质和用途:氧气能支持燃烧和供给呼吸,氮气可用作保护气、制氮肥、充入食品包装袋内防腐、液态氮可以做制冷剂,稀有气体通电时能发出不同颜色的光,可用于霓虹灯,二氧化碳既不能燃烧也不支持燃烧,可用于灭火、做化工原料、植物光合作用等。
第二章:空气污染及其危害2.1 教学目标:让学生了解空气污染的来源,知道有害气体和粉尘是主要的污染途径。
让学生掌握常见有害气体和粉尘的来源、危害及防治措施。
2.2 教学内容:空气污染的来源:有害气体(一氧化碳、二氧化硫、二氧化氮等)和粉尘(PM2.5、PM10等)。
常见有害气体和粉尘的来源:一氧化碳来源于化石燃料的不完全燃烧,二氧化硫来源于煤、石油等燃料的燃烧,二氧化氮来源于汽车尾气、工厂废气等,粉尘来源于扬尘、工业粉尘等。
危害:有害气体和粉尘对人体健康造成危害,如引起呼吸系统疾病、心血管疾病等,对环境造成污染,影响生态平衡。
防治措施:加强环保法规建设,提高公众环保意识,控制污染源排放,发展清洁能源等。
第三章:空气质量指数(AQI)与健康关系3.1 教学目标:让学生了解空气质量指数(AQI)的定义、计算方法和等级划分。
让学生掌握AQI与人体健康的关系,知道如何保护自己。
3.2 教学内容:空气质量指数(AQI)的定义:反映空气质量的好坏,数值越大,污染越严重。
AQI的计算方法:根据空气中PM2.5、PM10、二氧化硫、二氧化氮等污染物的浓度,按照一定的公式计算得出。
AQI的等级划分:0~50为优,51~100为良,101~150为轻度污染,151~200为中度污染,201~300为重度污染,大于300为严重污染。



初中化学《空气的成分》教案一、教学目标:1. 让学生了解空气的成分及各成分的体积分数。
2. 培养学生运用实验、观察、分析等方法探究空气成分的能力。
3. 增强学生对环境保护的认识,培养学生的环保意识。
二、教学内容:1. 空气的成分:氮气、氧气、稀有气体、二氧化碳及其他气体。
2. 各成分的体积分数:氮气约占78%,氧气约占21%,稀有气体约占0.94%,二氧化碳约占0.03%,其他气体和杂质约占0.03%。
3. 空气成分的相对稳定性。
三、教学重点:1. 空气的成分及各成分的体积分数。
2. 空气成分的相对稳定性。
四、教学难点:1. 空气中各成分的体积分数的计算和理解。
2. 空气成分的相对稳定性的概念和解释。
五、教学方法:1. 采用实验、观察、分析等方法引导学生探究空气成分。
2. 运用多媒体课件辅助教学,直观展示空气成分的实验现象和数据。
3. 采用小组讨论、问答等形式,激发学生的学习兴趣和参与度。
4. 注重培养学生运用科学知识解决实际问题的能力。
【课堂导入】教师通过展示空气的照片,引导学生思考空气的来源和组成,激发学生的学习兴趣。
【新课讲解】1. 教师介绍空气的成分,引导学生了解氮气、氧气、稀有气体、二氧化碳及其他气体的存在。
2. 教师讲解各成分的体积分数,让学生掌握氮气约占78%,氧气约占21%,稀有气体约占0.94%,二氧化碳约占0.03%,其他气体和杂质约占0.03%的数据。
3. 教师通过实验或多媒体课件展示空气成分的实验现象,让学生观察和分析空气成分的相对稳定性。
【课堂练习】1. 教师布置练习题,让学生计算空气中各成分的体积分数。
2. 教师组织学生进行小组讨论,探讨空气成分的相对稳定性在生活中的应用。
【课堂小结】【课后作业】1. 学生完成练习题,加深对空气成分的理解。
六、课堂活动:1. 学生进行空气成分的实验,如用气球收集空气样本,并用化学试剂检测氮气、氧气等成分。
2. 学生观察实验结果,记录各成分的体积分数。


1、天然气简介天然气是蕴藏在底层内的可燃性气体,化学组分以甲烷为主。
按来源不同分为4种:1.气田气 2.油田伴生气 3.凝析气田气 4.矿井气。
按贮运方式不同分为3种:1.管道天然气 2.压缩天然气 3.液化天然气2、天然气技术要求分析检验2.1质量要求在操作压力和温度下,压缩天然气肿不应该存在液态烃。
天然气作为化工原料时对其质量也有严格的要求。
2.2.组成分析检验(1).测定意义天然气组分不仅决定其使用特性,而且还对有关工艺设计、核算和实际使用有重要意义。
(2).分析检验方法天然气组成是指天然气中所含的各组分及其含量。
通常分析天然气中甲烷、乙烷等烃类组分和氮气、二氧化碳等常见非烃类组分含量。
2.3天然气分析常见分析:测定氮气、二氧化碳、甲烷至戊烷的含量,有时还包括六碳上的烃类(C6+)、氦气、氢气等组分。
延伸分析:测定摩尔质量大于己烷的各类烃类的含量,如分析到十二烷,十六烷甚至更高碳数的组分。
2.3.1方法原理——外标法:在同样操作条件下,分别将气样和等体积含有待测组分的标准气体混合物进样,得到色谱图,然后比较气样与标准气中相应组分的峰值,用标准气的组成数据计算气样相应组分的含量。
优点:具有较高的准确性,数据可比性和可信度强。
缺点:必须使用标准气,易受现场条件的限制;要求仪器的操作条件稳定,进样必须能够重复。
2.3.2天然气分析用色谱柱:吸附柱其作用为:完全分离氧气、氮气、氦气、氢气和甲烷等。
常用固定相:13X和5A分子筛、活性炭、GDX-101、PORAPAK R等。
多采用填充柱。
分离柱其作用为:分离二氧化碳、乙烷到戊烷之间的各组分。
常用的固定相:非极性或弱极性的固定液,如邻苯二甲酸二丁酯、BMEE 、SE-30等。
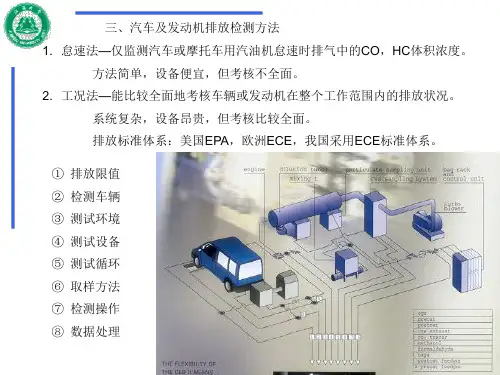
填充柱或毛细管柱2.4单柱分析过程:如果天然气试样中氧气、氮气含量很小或不需要测定,分析时用氢气或氦气作载气,使用热导检测器,用一根分配色谱柱可以分离其中的烃类和二氧化碳。
如用柱长为7m的25%BMEE…双-2-(2-甲氧基乙氧基)乙基醚‟/chromosorb P 的色谱柱分析,进样0.25mL,待正戊烷出峰后,再反吹出己烷及更重的组分,谱图如下:天然气的典型色谱图1-甲烷和空气;2-乙烷;3-二氧化碳;4-丙烷;5-异丁烷;6-正丁烷;7-异戊烷;8-正戊烷;9-庚烷和更重组分;10-己烷定量方法在同样条件下分别注入分析试样和标准气样,将两张谱图中的同组分的峰高或峰面积进行比较,正戊烷以前的组分含量按下式分别计算:式中:y i 、y s,i ——分别为样品中i 组分和标气中i 组分的摩尔分数,%;H i 、H s,i ——分别为气样中和标气中i 组分的峰高(或峰面 积),mm (或mm2)。
《多组分的空气》知识清单一、空气的组成成分空气是一种混合物,它主要由氮气、氧气、稀有气体(氦、氖、氩、氪、氙、氡)、二氧化碳以及其他气体和杂质组成。
氮气约占空气体积的 78%,是空气中含量最多的气体。
氮气在常温下是一种无色、无味、无臭的气体,化学性质稳定,一般不易与其他物质发生反应。
在工业上,氮气常用于食品包装、化工生产等领域。
氧气约占空气体积的21%,是人类和大多数生物生存所必需的气体。
氧气是一种无色、无味、无臭的气体,具有较强的氧化性,能够支持燃烧和呼吸作用。
稀有气体约占空气体积的 094%,虽然它们在空气中的含量较少,但却具有重要的作用。
稀有气体化学性质极不活泼,一般情况下不与其他物质发生反应,因此常用于霓虹灯、激光技术、保护气等方面。
二氧化碳约占空气体积的 003%,它是植物进行光合作用的原料之一。
但随着人类活动的增加,二氧化碳的排放量不断增加,导致全球气候变暖等环境问题。
此外,空气中还含有少量的水蒸气、一氧化碳、甲烷、一氧化氮、二氧化氮等气体和灰尘、花粉等杂质。
二、氮气1、氮气的物理性质氮气是一种无色、无味、无臭的气体,密度比空气略小,难溶于水。
2、氮气的化学性质氮气的化学性质很稳定,在常温下不易与其他物质发生反应。
但在高温、高压和催化剂的条件下,氮气能与氢气反应生成氨气(NH₃)。
3、氮气的用途氮气在工业上有广泛的用途。
由于其化学性质稳定,常用作保护气,防止食品、药品等被氧化变质。
液氮可以用于医疗上的冷冻麻醉,以及超导材料的冷却等。
三、氧气1、氧气的物理性质氧气是一种无色、无味、无臭的气体,密度比空气略大,不易溶于水。
在一定条件下,氧气可以变成淡蓝色的液体和淡蓝色的固体。
2、氧气的化学性质氧气具有较强的氧化性,能够与许多物质发生反应。
例如,氧气能与金属单质(如铁、铜等)发生氧化反应,生成金属氧化物;能与非金属单质(如碳、硫、磷等)发生燃烧反应;还能与一些化合物(如甲烷、乙醇等)发生氧化反应。