化合反应和氧化反应的关系
- 格式:ppt
- 大小:1.15 MB
- 文档页数:37


化合物的氧化能力强弱可以通过以下几个方面来判断:
1. 标准电极电势(Standard Reduction Potential):
- 标准条件下,可以比较不同氧化剂在氧化还原反应中的电极电势。
标准电极电势越高,该氧化剂的氧化性越强。
2. 化学反应:
- 通过观察化合物在化学反应中作为氧化剂的表现,分析其能否将其他物质氧化至较高氧化态。
如果一个化合物能够容易地氧化其它物质,那么它的氧化性强。
3. 反应条件:
- 在相似条件下,若多个氧化剂作用于同一还原剂时,能较快进行反应并生成更稳定氧化产物的氧化剂,其氧化性较强。
4. 元素周期表位置:
- 同周期从左到右,非金属元素形成的化合物通常氧化性逐渐增强;同主族从上到下,非金属元素形成的化合物氧化性逐渐减弱。
5. 物质活动顺序:
- 对于一些常见金属离子的氧化能力,可以根据金属活动性顺序进行大致判断,例如金属活动性顺序可以反映金属阳离子作为氧化剂的能力。
6. 酸碱性与氧化性关系:
- 非金属最高价氧化物对应的水化物酸性强弱,一般情况下可以说明中心元素的氧化性强弱。
如高氯酸是无机酸中最强的,说明氯的氧化性相对较强。
7. 热力学数据:
ΔG值(吉布斯自由能变化)也可以间接反映氧化还原反应的可能性和氧化剂的强度。
当ΔG为负时,反应自发进行,此时氧化剂的氧化能力强。
综合以上因素,可以全面评估和比较不同化合物的氧化性强弱。



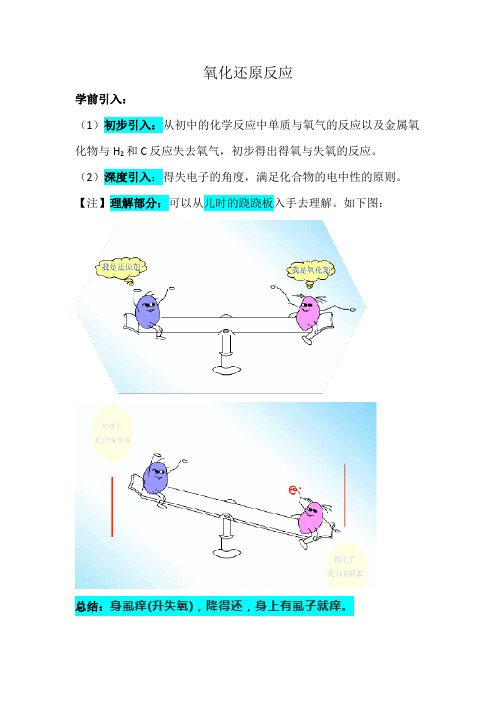
氧化还原反应学前引入:(1)初步引入:从初中的化学反应中单质与氧气的反应以及金属氧化物与H2和C反应失去氧气,初步得出得氧与失氧的反应。
(2)深度引入:得失电子的角度,满足化合物的电中性的原则。
【注】理解部分:可以从儿时的跷跷板入手去理解。
如下图:总结:身虱痒(升失氧),降得还,身上有虱子就痒。
一、基本概念1、定义:凡有元素化合价升降的化学反应就是氧化还原反应。
2、特征:化合价的升降3、本质:电子的得失4、初中基本四种基本反应与氧化还原的关系:【注】根据化合价的升降去判断,但这里有必要去回顾下初中学过的化合价,一些常见的化合价情况。
如; 碳;+2、+4。
氮:-3、+2、+4、+5等总结:(1)置换反应全都是氧化还原反应。
(2)有单质参加的化合反应是氧化还原反应。
(3)有单质生成的分解反应是氧化还原反应。
(4)复分解反应都不属于氧化还原反应。
例题:主要考察四种基本反应类型与氧化还原反应的关系,如何判断例1,P91、例1和变式1例2、下列反应一定属于氧化还原反应的是()A、化合反应B、分解反应C、置换反应D、复分解反应例3、判断正误(正确的划“√”,错误的划“×”)。
(1)有单质参加或有单质生成的化学反应一定是氧化还原反应。
( )(2)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原。
( )(3)某元素从游离态变为化合态,该元素可能被氧化也可能被还原。
( )(4)置换反应都是氧化还原反应,化合反应不都是氧化还原反应。
( )例4、P101,T5(教师版)例5、下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )A .Fe +CuSO 4===FeSO 4+CuB .AgNO 3+NaCl===AgCl ↓+NaNO 3C .Fe 2O 3+3CO=====△ 2Fe +3CO 2D .2KMnO 4=====△ K 2MnO 4+MnO 2+O 2↑。


氧气
一、氧气的性质
1.物理性质:
(1)色、味、态:无色无味的气体;(2)密度:密度略大于空气;
(3)溶解性:氧气不易溶于水
2.氧气的化学性质:支持燃烧,供给呼吸
3.氧气的用途:供呼吸(如潜水、医疗急救)支持燃烧(如燃料燃烧、炼钢、气
焊)
4.燃烧现象
(1)木炭在氧气中燃烧(黑色固体)
碳在空气燃烧中红热,产生气体
在氧气中发出白光,放热,产生能使澄清石灰水变浑浊的气体
点燃
文字表达式:碳+氧气二氧化碳
(2)硫在氧气中燃烧
硫在空气中燃烧发出微弱的淡蓝色火焰,放热生成有刺激性气味的气体。
在氧气中发出明亮的蓝紫色火焰,放热,产生有刺激性气味的气体
点燃
文字表达式:硫+氧气二氧化硫
注:集气瓶集气瓶底部加少量的水的目的——是吸收二氧化硫,防止污染环境,
(3)红磷在氧气中的燃烧
产生黄色火焰,放出热量,生成大量的白烟。
点燃
文字表达式:红磷+氧气五氧化二磷
注:集气瓶集气瓶底部加少量的水的目的—--冷却吸收五氧化二磷
(4)铁在氧气中的燃烧
铁剧烈燃烧,火星四射,放出大量热生成一种黑色固体。
文字表达式:点燃
铁+氧气四氧化三铁
1。

氧化反应是指有化合价升降的反应,通常称作氧化还原反应。
氧化反应是指物质与氧发生的化学反应,氧气在此过程中提供氧。
物质失电子的作用叫氧化。
相反的,得电子的作用叫还原。
狭义的氧化反应指物质与氧化合,还原反应指物质失去氧的作用。
氧化时氧化值升高,还原时氧化值降低。
化合反应是由两种或两种以上的物质生成一种新物质的反应。
其中部分反应为氧化还原反应,部分为非氧化还原反应。
此外,化合反应一般释放出能量。
凡是有单质参加的化合反应,一定是氧化反应。
氧化反应要比化合反应的范围更广阔。
化合反应和氧化反应没有必然联系,它们的关系属于交叉关系。
有些化学反应既是化合反应,又是氧化反应,如:铁和氧气反应;。



四大基本反应与氧化还原反应的关系1.氧化还原反应:有化合价发生升降的反应。
如:Fe+CuSO4=Cu+FeSO42.非氧化还原反应:没有化合价发生升降的反应。
HCl+NaOH=NaCl+H2O3.四大基本反应(1)化合反应:由两种或者两种以上的物质生成一种物质。
特点:多变一。
如:C+O2=(点燃)=CO2、2Fe+3Cl2=2FeCl3(属于氧化还原反应)那是不是所有的化合反应都是氧化还原反应呢?答案是否定的。
如:CaO+H2O=Ca(OH)2、CaCO3+CO2+H2O=Ca(HCO3)2(属于非氧化还原反应)总结:有单质参加的化合反应属于氧化还原反应。
(2)分解反应:由一种物质生成两种或者两种以上的物质。
特点:一变多。
如:H2CO3=CO2+H2O、CaCO3=(高温)=CaO+CO2(属于非氧化还原反应)那是不是所有的分解反应都不是氧化还原反应呢?当然不是。
如:2H2O2=2H2O+O2、2KMnO4=加热=K2MnO4+MnO2+O2(属于氧化还原反应)总结:有单质生成的分解反应属于氧化还原反应。
(3)置换反应:由一种单质+一种化合物=另外一种单质+另外一种化合物。
如:Fe+CuSO4=Cu+FeSO4、Zn+H2SO4=ZnSO4+H2(属于氧化还原反应)总结:所有的置换反应都是氧化还原反应。
(4)复发解反应:两种化合物互相交换成分,生成新的两种化合物。
如:HNO 3+NaOH=NaNO 3+H 2O 、Na 2CO 3+2HCl=2NaCl+CO 2+H 2O(属于非氧化还原反应)总结:所有的复分解反应都不属于氧化还原反应。
4. 那是不是有单质参加或生成的反应都是氧化还原反应呢?当然不是。
如:C (金刚石)=C (石墨)、3O 2=2O 3(属于非氧化还原反应) 总结:同素异形体之间的相互转换,属于非氧化还原反应。
5. 图形表示氧化还原反应与四大基本反应的关系(1)(2)非氧化还原反应 分解反应置换反应。

专题:“氧化反应及其应用”竞赛辅导练习题一、选择题1.氧化反应和化合反应两者的关系是()A. 氧化反应属于化合反应B. 化合反应属于氧化反应C. 与氧气化合的反应属于一种氧化反应D. 化合反应指氧气与另一种物质生成一种氧化物的反应2.下列说法中,正确的是()A. 催化剂只能改变化学反应速率B. 分离液态空气制氧气是分解反应C. 氧化反应必须有氧气参加D. 由一种物质生成两种物质的反应属于分解反应3.下列反应中,既属于化合反应,又属于氧化反应的是()A. 水氢气+氧气B. 氧化钙+ 水氢氧化钙C. 乙炔+氧气水+二氧化碳D. 磷+氧气五氧化二磷4.分析、推理和类比是化学学习中常用的思维方法,下列分析、推理或类比正确的是()A. 物质与氧气发生的反应属于氧化反应,所以氧化反应一定有氧气参加B. 金刚石和石墨由于碳原子的排列方式不同,所以它们的物质性质存在很大的差异C. 无色酚酞溶液遇酸性溶液不变色,所以无色酚酞溶液不变色的一定是酸性溶液D. 碳酸盐能与盐酸反应生成气体,所以能与盐酸反应生成气体的一定是碳酸盐5.化学反应有多种分类.化合反应、置换反应、氧化反应和还原反应的关系可用如图表示,其中b处表示既属于化合反应,又属于氧化反应和还原反应.现有反应:2C+Fe3O43Fe+2CO2.则此反应应该填充到()A. a处B. c处C. d处D. e处6.化学概念相互间存在如图3种关系:下列对概念间关系的说法正确的是()A. 纯净物与混合物属于包含关系B. 化合物与氧化物属于包含关系C. 单质与化合物属于交叉关系D. 氧化反应与化合反应属于并列关系7.氧气是我们身边常见的物质,以下有关氧气的叙述正确的是()A. 物质与氧气发生的反应都是氧化反应B. 氧气能跟一切物质发生化学反应C. 氧气具有可燃性D. 物质在氧气中燃烧的反应一定是化合反应8.下列反应既不是化合反应又不是氧化反应的是()A. 镁+氧气→ 氧化镁B. 碱式碳酸铜→ 氧化铜+二氧化碳+水C. 氢气+氯气→ 氯化氢D. 蜡烛+氧气→ 水+二氧化碳9.已知:有元素化合价升降的反应属于氧化还原反应.下图反应中,属于氧化还原反应的是()A. ①③B. ②⑤C. ①④D. ④⑤10.符合如图中阴影部分的化学反应的文字表达式的是()A. 石蜡+氧气水+二氧化碳B. 铁+氧气四氧化三铁C. 高锰酸钾锰酸钾+二氧化锰+氧气D. 氢气+氧化铜铜+水11.判断下列反应既属于化合反应又属于氧化反应的是()A. 加热氧化汞B. 加热氯酸钾C. 硫的燃烧D. 蜡烛燃烧12.推理是化学学习中常用的思维方法.下列4个推断不正确的是()A. 氯化钠是盐,含有金属元素,盐中不一定含有金属元素B. 单质是只含有一种元素的纯净物,含有一种元素的纯净物一定是单质C. 中和反应一定生成盐和水,生成盐和水的反应不一定是中和反应D. 物质和氧气发生的反应都是氧化反应,氧化反应一定有氧气参加13.氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应,如图所示,关于三个反应的叙述中不正确的是()A. 都是化合反应B. 都需要点燃C. 生成物都是固体D. 都是和氧气反应14.下列说法正确的是()A. 氧化反应就是物质和氧气发生的反应B. 氧化反应一定是化合反应C. 氧化反应一定不属于化合反应D. 动植物的呼吸包含缓慢氧化15.氧气是我们身边常见的物质,以下关于氧气的叙述不正确的是()A. 物质与氧气发生的反应都是氧化反应B. 鱼、虾能在水中生存是由于氧气易溶于水C. 在标准状况下,氧气的密度比空气密度略大D. 氧气可以供给呼吸,和体内物质反应而释放能量,维持生命活动16.元素化合价发生改变的反应都是氧化还原反应.例如:反应前后,Fe和Cl元素的化合价发生了改变,该反应是氧化还原反应.下列反应不属于氧化还原反应的是()A. 4P+5O22P2O5B. FeCl3+3NaOH=Fe(OH)3↓+3NaClC. Zn+H2SO4=ZnSO4+H2↑D. 2H2O2H2↑+O2↑二、填空题17.下列变化:①铁+硫酸铜→硫酸亚铁+铜②碱式碳酸铜氧化铜+水+二氧化碳③锌+稀硫酸→硫酸锌+氢气④一氧化碳+氧气二氧化碳属于分解反应的是________(填序号,下同);属于化合反应的是________;属于氧化反应的是________.18.化学概念在逻辑上存在如图所示关系时,对下列概念间的关系说法正确的是________.A.纯净物与混合物属于包含关系B.化合反应与氧化反应属于交叉关系C.物理性质与化学性质属于交叉关系D.________.19.现有碱式碳酸铜、红磷、铁、木炭、硫、二氧化锰、镁带、蜡烛等,按下面的要求选择适当的物质和适当条件发生化学反应,写出反应的文字表达式,在括号内注明反应的类型(化合反应、分解反应).(1)写出属于B区域内的反应________ ;(2)写出属于A区域内的反应________ ;(3)写出不属于A、B、C区域内的反应________ .20.电子技术离不开高纯硅,硅广泛应用于电子工业,工业上制硅的基本原理是:SiO2+2C Si+2CO↑,该反应中还原剂是________,该反应中氧化剂是________21.碳和碳的氧化物都是常见的含碳物质,回答下列问题.(1)在金刚石和石墨中,可用于制作铅笔芯的是________ ;(2)CO和CO2都是碳的化合物,但由于它的分子构成不同,导致________ 一定不同;(3)在炼铁的化学反应中(3CO+Fe2O32Fe+3CO2)发生氧化反应的物质是________ .22.小科在学习了氧化反应与化合反应的概念后,为体现两概念间的关系,他设计了如图所示的方式,并完成了A处所表示内容的填写,请你完成B、C的填写内容.A.是化合反应,但不是氧化反应,生石灰+水→熟石灰B.________;________C.________;________判断:①物质与氧气的反应一定是氧化反应.________②氧化反应一定是物质与氧气的反应.________.23.右图表示了化合反应和氧化反应的关系.按示例填空:A部分:是化合反应,不是氧化反应,例:二氧化碳+水→碳酸;B部分:________,例:________;C部分:________,例:________.三、实验探究题24.分类、类比是初中化学常用的学习方法.(1)化学实验可按其主要目的分为:物质发生化学反应条件的探究,物质性质的探究,物质含量的探究等.据此应将下列实验中D与________ (填“A”或“B”或“C”)归为一类,依据的实验目的是________.C DA B(2)在氧化还原反应中,元素化合价升高的反应物为还原剂,反之为氧化剂.则上述实验B中,氧化剂是________,请写出由一种单质和一种化合物发生化合反应的化学方程式________(其中单质为还原剂,化合物为氧化剂).四、综合题25.让我们沿用科学家认识事物的方式认识“空气”.(1)从分类角度:空气属于________(填“混合物”或“纯净物”).(2)从微观角度:用“ ”表示氮原子,“ ”表示氧原子.①用“ ”可表示的微粒是________(填名称).②同温同压下,气体的体积比等于分子数目比.若空气中其它成分忽略不计,如图可表示空气微观模型的是________(填标号).(3)从变化角度:已知:常压下,氮气沸点﹣196℃,氧气沸点﹣183℃.将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是________.该烧杯放置一段时间后,液态物质剩余约体积,其主要成分是________(4)从应用角度:利用空气制取氮肥的流程如图所示.①Ⅰ中发生化合反应,其反应的化学方程式为________②物质所含元素化合价发生变化的反应称为氧化还原反应.反应Ⅲ________(填“属于”或“不属于”)氧化还原反应.(5)从环保的角度:下列做法不利于保护大气的是(填字母序号,下同).A. 使用清洁能源B. 燃放烟花爆竹C. 植树造林D. 提倡绿色出行.26.如果A、B两圆分别表示化合反应和氧化反应,请你根据两圆位置关系来回答下列问题:(1)C表示有的化学反应既是化合反应又是________反应.(2)请你写出一个属于A的化学变化的反应化学式表达式________.(3)“石蜡+氧气水+二氧化碳”这个反应属于________(填A、B或C).27.请回答下列问题.(1)铵态氮肥不能与碱性物质混合施用的原因是________(2)为了防止月饼变质,常在月饼的内包装袋中放入一小包防腐剂,它的主要成分是铁粉,铁粉的作用是________;(3)在炼铁的核心反应3CO+Fe2O32Fe+3CO2中,________发生了氧化反应;(4)向AgNO3和Cu(NO3)2的混合溶液中加入一定量的Zn粉,充分反应后过滤,向滤渣中加盐酸有气泡,则滤渣中一定含有的金属是________.。

化学四大基本反应类型化学四大基本反应类型1、化合反应:化合反应指的是由两种或两种以上的物质反应生成一种新物质的反应。
其中部分反应为氧化还原反应,部分为非氧化还原反应。
此外,化合反应一般释放出能量。
可简记为A+B=AB。
2、分解反应:由一种物质生成两种或两种以上其它的物质的反应叫分解反应。
简称一分为二,表示为AB=A+B。
只有化合物才能发生分解反应。
3、置换反应:一种单质与化合物反应生成另外一种单质和化合物的化学反应,是化学中四大基本反应类型之一,包括金属与金属盐的反应,金属与酸的反应等。
可简记为AB+C=A+CB。
4、复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应。
其实质是:发生复分解反应的两种物质在水溶液中相互交换离子,结合成难电离的物质----沉淀、气体、水(弱电解质),使溶液中离子浓度降低,化学反应即向着离子浓度降低的方向进行。
可简记为AB+CD=AD+CB。
氧化还原反应与基本反应类型的关系:化合反应有单质参加的是氧化还原反应;分解反应有单质生成的是氧化还原反应;置换反应全部是氧化还原反应;复分解反应都是非氧化还原反应.化学反应的分类:化学反应按照不同的分类标准,可以分成不同的反应类型根据原子(原子团)的组合形式来分类,把化学反应分为化合反应、分解反应、置换反应、复分解反应,但是四种基本类型的反应并不能包括所有的化学反应,比如3O2==2O3。
1.按是否有电子转移,把化学反应分为氧化还原反应和非氧化还原反应。
2.按是否有离子参加反应,把化学反应分为离子反应和非离子反应。
3.按化学反应的能量关系,把化学反应分为放热反应和吸热反应。
化学反应类型分为四种基本化学反应类型,包括化合反应,分解反应,置换反应,还有复分解反应。
置换反应1、根据反应环境的类别,置换反应有以下2种情况:(1)固态置换在加热或高温条件下固体与固体或固体与气体发生的置换反应。
(2)液态置换在水溶液中进行的置换反应。

课题2 氧气答案:铁 (8)化合1.氧气的物理性质 (1)在标准状况下,氧气是无色、无味气体,密度为1.429 g/L ,比空气的密度(1.293 g/L)略大。
它不易溶于水(1 L 水能溶解30 mL 氧气)。
气态――→101 kPa -183 ℃液态淡蓝色――→101 kPa -218 ℃雪花状固体淡蓝色工业生产的氧气一般通过降温加压,变为液态氧气后贮存有蓝色钢瓶中。
释疑点 氧气转变为液氧发生了什么变化氧气变为淡蓝色液体或淡蓝色雪花状固体时发生了物理变化。
因为无论是哪种状态的氧气,都属于同种物质。
可见,有颜色改变的变化不一定是化学变化。
【例1】以下关于氧气物理性质的表达,错误的选项是( ) A .在标准状况下,氧气的密度比空气略大 B .氧气不溶于水C .在通常状况下,氧气是无色、无味的气体D .液态氧是淡蓝色液体 A √ 标准状况下氧气的密度比空气略大B × 不易溶于水,不是不溶于水,应理解成氧气在水中溶解得不够多C √ 通常状况下氧气是无色、无味的气体D √ 液态氧是淡蓝色液体 2.氧气的化学性质氧气是一种化学性质比较活泼的气体,一定条件下,能与多种物质发生化学反应。
氧气具有氧化性和助燃性。
氧气具有助燃性,但不能认为氧气可燃烧。
(1)氧气能使带火星的木条复燃如图,将带火星的木条伸到盛有氧气的集气瓶中,观察到木条复燃,说明氧气能支持燃烧(助燃)。
点技巧 验证一瓶无色气体是氧气的方法将带有火星的木条伸入瓶中,若木条复燃,证明该气体是氧气。
①产生微弱的淡蓝色火焰;②生成有刺激性气味的气体,放出热量 不产生火焰,发出红光,放出热量在空气中不燃烧,保持红热不产生火焰,发出白光,放出大量热,生成使澄清石灰水变浑浊的气①剧烈燃烧,火星四射;②放出大量热,生成黑色固体细沙替代?不相同。
前者是为了吸收二氧化硫,减少空气污染,不能够用细沙替代;后者是为了防止高温熔融物溅落,炸裂集气瓶底部,能够用细沙替代。


既属于化合反应又属于氧化反应的例子
1. 碳在氧气中燃烧生成二氧化碳呀,这可不是既典型又有趣的化合反应和氧化反应的完美结合嘛!你想想,碳那么不起眼的小玩意儿,遇到氧气之后“轰”地一下燃烧起来,然后就变成了我们熟悉的二氧化碳啦!这变化多神奇呀!
2. 硫燃烧生成二氧化硫也是这样呢!硫本来安安静静的,点火之后和氧气一作用,哇塞,就产生了二氧化硫!这不是像一场奇妙的变身之旅吗?太有意思啦!
3. 铁在氧气里燃烧变成四氧化三铁,这绝对算得上是既属于化合反应又属于氧化反应的精彩例子呀!铁那么硬邦邦的家伙,居然能和氧气产生这么奇妙的反应,简直酷得不行呢,你说是不是?
4. 氢气在氧气中燃烧生成水呀!就好像氢气和氧气在跳一场热情的舞蹈,跳着跳着就变成了水呢!这反应真是让人惊叹不已呀!
5. 磷燃烧生成五氧化二磷也是让人惊叹呢!一点点磷,遇到氧气后就华丽丽地变成了五氧化二磷,这不是很让人惊喜吗?就像一个小魔术一样呢!
6. 一氧化碳燃烧生成二氧化碳啊,这不就是很典型的吗?一氧化碳本来好像有点危险似的,和氧气一结合,就变成了二氧化碳,这转变真是太奇妙啦!
我觉得呀,这些既属于化合反应又属于氧化反应的例子都超级有趣,它们展示了化学世界的奇妙与精彩呀!让我们对这个世界有了更多的好奇和探索欲望呢!。

还原反应和化合反应还原反应和化合反应是化学过程中的两种基本的反应方式,在我们的生活中无时无刻不在发生着这两种反应,能够使我们的空气、水体和其他环境保持在一个最佳的状态,它们都是在化学的操作中的重要反应,极大的推动了化学的发展。
此外,它们都是经过复杂程序而实现的,必须要了解得清楚它们之间的差别才能进行正确的操作和更好地发挥其作用,以便实现更加科学和高级的设备。
还原反应是减少氧化反应的一种方式。
通常,物质会进行氧化,将其中的某种原子的电子从原子中转移出去,产生负电荷,这就是原子的氧化,反过来,就是还原反应。
还原反应的过程中,物质会把已经被氧化的原子用原子中的电子还原回去,也就是减少氧化反应。
还原反应是一种特定的反应,在其中涉及到两种形式,即氧化物和还原物。
其中,氧化物是把电子转移出去的原子,而还原物是把电子转移回去的原子。
化合反应是一种化学反应,在其中物质会结合到一起,形成新的物质。
化合反应是根据原子的特征来进行的,主要反应的过程是能量的释放或重新组合,这样能够赋予物质新的性质。
化合反应可以分为离子反应和离子化反应。
离子反应是指通过原子交换电子的反应,离子化反应是指通过原子或者分子的直接结合所形成的反应。
由于原子的电荷水平发生变化,所以反应结果会有很大差异,也就是所谓的低熔点和高熔点反应。
还原反应和化合反应是最重要的化学反应之一,它们发挥着重要的作用,可以帮助我们实现我们想要的材料或设备,这些材料和设备是由这些反应而产生的,它们是科学发展的重要基础,在我们生活的方方面面都发挥着重要的作用。
如果把还原反应和化合反应的概念从更深的程度来考虑,我们发现它们的反应本质上都是物质转化的过程,当物质转化成它们所需要的形式时,会实现最佳状态,这两种反应也可以实现这一目标。
只有在清晰地知道这两种反应的本质以及它们之间的区别后,才能更好地进行更多的化学实验,才能发挥的更大的作用,才能取得更佳的效果。
综上所述,还原反应和化合反应是一种特定的反应,在化学反应中占据着重要的地位,这两种反应的本质是物质的转化,以实现最佳状态,其把握的要点是要清楚了解这两种反应之间的本质,以及它们之间的区别,从而更好地将它们发挥出来,才能达到最理想的状态。