Chap11 第十一章 配位滴定法
- 格式:ppt
- 大小:3.16 MB
- 文档页数:51










摘要化学分析中的配位滴定法在金属离子测定中有其独特性,但滴定剂的选择性差,并且滴定过程须控制一定的酸碱度,把握其理论要点对实际操作有十分重要的作用。
对配位滴定的理论要点,从的结构、性质、特点出发加以阐述。
关键词配位滴定;;特点;选择性作为化学分析中的四大滴定之一的配位滴定,在测定溶液中金属离子的含量时有着显著的优点,表现为简便快速,准确度高,应用范围广,但也有其局限性,即干扰离子多,选择性差。
本文从配位滴定的理论出发来阐述该滴定法,有待对高职分析化学配位滴定法的教学有所帮助。
1配位滴定原理配位滴定法是以配位反应为基础的滴定方法。
我们知道适用于滴定的化学反应必须满足如下条件①反应能定量完成;②反应速率快;③能用简便的方法确定滴定终点。
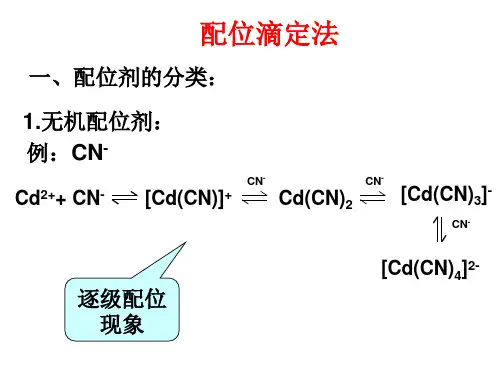
由于许多无机配合物不够稳定,配位过程中有逐级配位的现象产生,而各级稳定常数相差又不大,导致滴定终点不明显。
自从1945年出现氨羧配位体之后[1],使配位滴定的应用得到了迅速发展,其中乙二胺四乙酸简称是配位滴定中应用最广的配位剂。
学名乙二胺四乙酸,是一种有机弱酸,分子式简写为4,结构式如下乙二胺四乙酸在水溶液中由于原子上的孤电子对的极化作用,羟基上的氢原子转移到氮原子上,使分子具有双偶极离子结构当4溶解于水时,如果溶液的酸度很高,它的两个羧基可再接受两个质子+,形成62+,因此就相当于有机六元酸[2]。
由于为有机弱酸,在水溶液中溶解度很小,实际应用中常用它的二钠盐22•2,它的溶解度大,适应于水溶液中的滴定,一般也简称为。
分子中的两个氮原子和四个羟基中的氧原子与绝大多数金属离子都能形成五元环稳定的如下螯合物从上述可知,具有下列特点①稳定,能与周期表中的绝大多数金属离子形成稳定的螯合物除+、+、+等少数离子;②反应速率快,与大多数金属离子形成配合物的反应能在瞬间完成。
只有3+、3+、3+在室温下反应较慢,但加热可加快反应速度,使反应迅速完成;③配合物水溶性好,有利于在水溶液中进行滴定;④计量关系简单,与绝大多数金属离子都形成1∶1的配合物,计算方便;⑤配合物颜色与金属离子保持一致,无色金属离子与生成的配合物无色,有色金属离子与生成的配合物呈原离子的颜色,只是颜色加深;⑥与金属离子配合物稳定性和溶液酸度有关。