湖南省湘潭凤凰中学高三化学 专题练习 与酸碱性有关的离子方程式的书写
- 格式:doc
- 大小:70.50 KB
- 文档页数:2
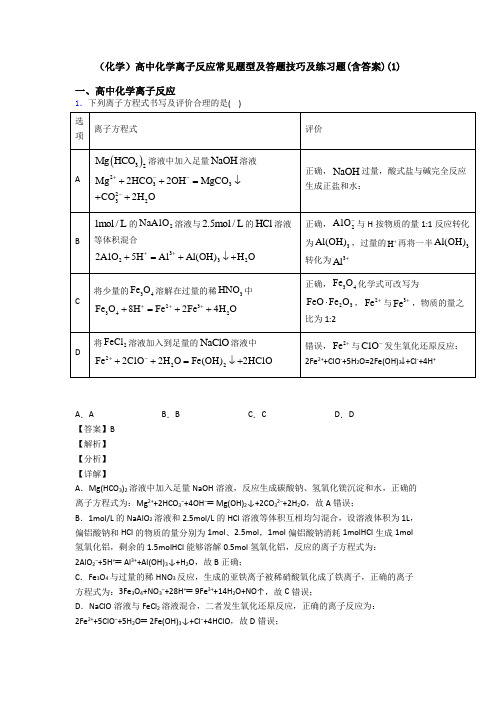
(化学)高中化学离子反应常见题型及答题技巧及练习题(含答案)(1)一、高中化学离子反应1.下列离子方程式书写及评价合理的是( )A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A.Mg(HCO3)2溶液中加入足量NaOH溶液,反应生成碳酸钠、氢氧化镁沉淀和水,正确的离子方程式为:Mg2++2HCO3−+4OH−═Mg(OH)2↓+2CO32−+2H2O,故A错误;B.1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合,设溶液体积为1L,偏铝酸钠和HCl的物质的量分别为1mol、2.5mol,1mol偏铝酸钠消耗1molHCl生成1mol 氢氧化铝,剩余的1.5molHCl能够溶解0.5mol氢氧化铝,反应的离子方程式为:2AlO2−+5H+═Al3++Al(OH)3↓+H2O,故B正确;C.Fe3O4与过量的稀HNO3反应,生成的亚铁离子被稀硝酸氧化成了铁离子,正确的离子方程式为:3Fe3O4+NO3−+28H+═9Fe3++14H2O+NO↑,故C错误;D.NaClO溶液与FeCl2溶液混合,二者发生氧化还原反应,正确的离子反应为:2Fe2++5ClO−+5H2O═2Fe(OH)3↓+Cl−+4HClO,故D错误;答案选B。
2.学校化学研究小组对实验室某废液缸里的溶液进行检测分析,提出假设:该溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、I-、SO42-等离子中的几种离子。
实验探究:①取少量该溶液滴加紫色石蕊试液,溶液变红。
②取100mL该溶液于试管中,滴加足量Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.3mol 白色沉淀甲,向滤液中加入AgNO3溶液未见沉淀产生。
③另取100mL该溶液,逐渐加入Na2O2粉末,产生的沉淀和气体与所加Na2O2粉末物质的量的关系曲线如图所示。
下列说法中不正确的是()A.该溶液中一定不含有I-、HCO3-、Cl-B.该溶液中一定含有K+,其物质的量浓度为1mol•L-1C.在溶液中加入0.25~0.3molNa2O2时,发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑、Al(OH)3+NaOH=NaAlO2+2H2OD.该溶液能使紫色石蕊试液变红的唯一原因是NH4+发生水解【答案】D【解析】【分析】①滴加紫色石蕊试液,溶液变红,说明溶液显酸性,则溶液中无HCO3-;②滴加足量Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.3mol白色沉淀甲,向滤液中加入AgNO3溶液未见沉淀产生,说明溶液中有SO42-,且n(SO42-)=0.3mol,无Cl-、I-;③逐渐加入Na2O2粉末,由图可知,过氧化钠与水反应生成氢氧化钠,氢氧化钠依次与铝离子反应生成氢氧化铝0.1mol,与铵根离子反应生成氨气0.2mol,最后与氢氧化铝反应,含有铝离子,一定不存在碳酸氢根离子。

高三化学复习《离子方程式选择》专题练习1下列离子方程式与所述事实相符且正确的是A .磁性氧化铁溶于稀硝酸:Fe 3O 4+8H ++NO 3-=3Fe 3++NO ↑+4H 2OB .Ca(HCO 3)2溶液中加入少量NaOH 溶液:Ca 2++2HCO 3-+2OH -=CaCO 3↓+CO 32-+H 2OC .明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al 3++2SO 42-+2Ba 2++4OH -=AlO 2-+2BaSO 4↓+2H 2OD .向含有0.4 mol FeBr 2的溶液中通入0.3 mol Cl 2充分反应:4Fe 2++2Br -+3Cl 2=4Fe 3++6Cl -+Br 22、下列离子方程式表达正确的是A .Na 2S 的水解:S 2ˉ+ 2H 2O H 2S +2 B .用铜电极电解CuSO 4溶液:2Cu 2++2H 2++O2↑C .硫酸亚铁酸性溶液中加入过氧化氢:2Fe 2+ + H 2O 2 +2H + = 2Fe 3++ 2H 2OD .向NaClO 溶液中通入少量SO 2:2ClO ˉ+SO 2+H 2O =SO 32ˉ+2HClO3、下列离子反应中,表达正确的是A .向烈Cl 3溶液中加入过量氨水:Al 3++4NH 3·H 2O=AlO 2-+4NH 4++2H 2OB .用铜作电极电解硫酸溶液:2H 2O 2H 2↑+O 2↑C .等体积等物质的量浓度的NaHCO 3溶液与Ba (OH )2溶液混合时发生反应:HCO 3-+Ba 2++OH BaCO 3↓+H 2OD .硫酸亚铁溶液与稀硫酸、双氧水混合:Fe 2++2H 2O 2+4H Fe 3++4H 2O4、下列离子方程式与所述事实相符的是A. 向CuSO 4溶液中滴加过量的氨水:B. 氢氧化亚铁溶于稀硝酸中:C. 用双氧水和稀硫酸处理印刷电路板:D.用FeS 除去工业废水中的5、下列离子方程式正确的是A .向Ag (NH 3)2OH 溶液中加足量氢溴酸:Ag (NH 3)2++ OH -+3H +=Ag ++2NH 4++H 2OB .Ba (HCO3)2溶液与Ba (OH )2溶液任意比混合:Ba2++HCO3—+OH —═BaCO3↓+H2OC .FeCl 3溶液中撒入CaCO 3粉末有气泡产生:2Fe 3++3CaCO 3+3H 2O =2Fe (OH )3↓+3Ca 2++3CO 2↑D .向NH 4HCO 3溶液中加入足量NaAlO 2溶液:NH 4++AlO 2—+2H 2O = NH 3·H 2O+ Al (OH )3↓6、下列离子方程式式书写正确的是A .明矾溶液中加入过量的氢氧化钡溶液:Al 3++2SO 42++2Ba 2++4OH -=2BaSO 4↓+AlO 2-+2H 2OB .氯气溶于水:Cl 2+H 2O=2H ++Cl -+ClO -C .苯酚钠溶液中通入少量CO 2:2C 6H 5O -+CO 2+H 2O →2C 6H 5OH+CO 32-D .硝酸亚铁溶液和稀盐酸混合:Fe 2++4H ++NO 3-=Fe 3++2H 2O+NO ↑7、下列离子方程式表达正确的是A .硫化钠的水解反应:S 2—+2H 2O H 2S +2OH —B .NaHSO 4溶液与Ba(OH)2溶液反应至中性:H ++SO 42-+Ba 2++OH -= BaSO 4↓+H 2OC .在硫酸亚铁溶液中通入氧气:4Fe 2++O 2+4H +=4Fe 3++2H 2OD .向AlCl 3溶液中滴加过量的氨水:Al 3++4OH -=AlO 2—+ 2H 2O8、下列化学反应的离子方程式正确的是A .Al(OH)3与稀HNO 3反应:Al(OH)3+3H +=Al 3++3H 2OB .往碳酸镁中滴加稀盐酸:CO 32-+2H +=CO 2↑+H 2OC .往氨水中滴加氯化铝:Al 3++4OH -=AlO 2-+2H 2OD .Fe(NO 3)3溶液中加入过量的HI 溶液:2Fe 3++2I -=2Fe 2++I 29、下列化学反应的离子方程式正确的是A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2OB.氧化铁溶于过量氢碘酸:Fe2O3+6H+ = 2Fe3++3H2OC.将少量SO2气体通入足量的NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClOD.稀硝酸中加入过量的铁屑:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O10、下列离子方程式表达正确的是A.用稀硝酸洗涤做银镜反应的试管:3Ag +4 H++ NO3¯ = 3Ag++ NO↑+ 2H2OB.用氢氧化钠溶液除去铝表面的氧化膜:Al(OH)3+ OH¯ = AlO2¯+ 2H2OC.用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+=Cu2++2H2OD.用食醋除去水瓶中的水垢:CO32¯+ 2CH3COOH = 2CH3COO¯+ CO2↑+ H2O11、下列反应的离子方程式正确的是A.澄清石灰水中滴加过量的小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2OB.铵明矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2OC.H2O2溶液中滴加酸性KMnO4溶液: 2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O)与碳酸氢钠溶液反应:D.尼泊金酸(错误!未找到引用源。


高考必考的离子方程式的书写近六年高考所考查到的离子方程式的书写(括号内为考查的次数)(09、8)1、Cl2与NaOH溶液反应(2)Cl2+2OH-=Cl-+ClO-+H2O2、F2与NaOH溶液反应 2F2+4OH-=4 F-+O2+2H2O3、氯化亚铁溶液中通入氯气(4) 2Fe2++Cl2=2Fe3++2Cl-4、向溴化亚铁溶液中通入过量氯气(2) 2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-5、双氧水在酸性条件下氧化亚铁离子(2)2Fe2++H2O2+2H+=2Fe3++2H2O6、向苯酚钠溶液中通入二氧化碳(3) C6H5O-+CO2+H2O=C6H5OH+HCO3-7、电解饱和食盐水 2Cl-+2H2O=Cl2↑+H2↑+2OH-8、电解硫化钠溶液 S2-+2H2O=S↓+H2↑+2OH-9、电解氯化铝溶液2Al3++6Cl-+6H2O=3Cl2↑+3H2↑+2Al(OH)3↓10、实验室用浓盐酸与MnO2反应制Cl2 MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O11、氯化铁溶液中通入硫化氢气体 2Fe3++H2S=2Fe2++S↓+2H+12、AgNO3溶液中加入过量氨水 Ag++2NH3.H2O=Ag(NH3)2++2H2O13、AgNO3溶液与锌片 2Ag++Zn=2Ag+Zn2+14、氯化铝溶液中加入过量氨水(7) Al3++3NH3.H2O=Al(OH)3↓+3NH4+15、向三氯化铝溶液中加入过量氢氧化钠溶液(2) Al3++4OH-=AlO2-+2H2O16、硫酸铝溶液与小苏打溶液反应 Al3++3HCO3-=Al(OH)3↓+3CO2↑17、氨水与盐酸(2)NH3.H2O+H+=NH4++H2O18、明矾溶液加热水解 Al3++3H2O=Al(OH)3(胶体)+3H+19、氢氧化铝与足量盐酸反应 Al(OH)3+3H+=Al3++3H2O 20、氢氧化铜与盐酸 Cu(OH)2+2H+=Cu2++2H2O21、Fe3O4与稀HNO3反应 3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O22、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体 Fe3++3H2O=Fe(OH)3(胶体)+3H+23、次氯酸钙溶液中通入过量二氧化碳 ClO-+CO2+ H2O=HCO3-+HclO24、向次氯酸钙溶液通入二氧化硫、 Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+25、NaHSO4与Ba(OH)2溶液反应(2) 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2OH++SO42-+Ba2++OH-=BaSO4↓+H2O26、等体积等物质的量浓度氢氧化钡溶液与碳酸氢铵溶液混合Ba2++2OH-+ NH4++HCO3-= BaCO3↓+NH3.H2O+H2O27、碳酸氢铵溶液中加入过量氢氧化钠溶液(2)NH4++HCO3-+2OH-=CO32-+ NH3.H2O+H2O28、碳酸氢钠溶液中加入盐酸(4) HCO3-+H+=H2O+CO2↑29、碳酸氢钙溶液与稀硝酸反应(3) HCO3-+H+=H2O+CO2↑30、向小苏打溶液中加入醋酸溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O31、碳酸氢钙溶液与醋酸反应 HCO3-+HAc=CO2↑+H2O+Ac-32、向饱和碳酸氢钙溶液中加饱和氢氧化钙溶液(2) HCO3-+HAc=CO2↑+H2O+Ac-33、碳酸氢钙溶液加入过量的氢氧化钠溶液(4) Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-34、碳酸氢钠溶液与少量石灰水反应(3) Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-35、碳酸氢钠溶液与氢氧化钡(2) Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32-36、碳酸氢钠溶液与氢氧化钠反应 HCO3-+OH-=CO32-+H2O37、澄清石灰水与稀盐酸反应(2) OH-+H+=H2O38、氢氧化钡与稀硫酸CH3COOH+OH-=CH3COO-+H2O39、醋酸与氢氧化钾溶液反应(2) Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O40过量氢氧化钙溶液和碳酸氢镁溶液反应2Ca2++2HCO3-+Mg2++4OH-=2CaCO3↓+Mg(OH)2↓+2H2O41、碳酸镁与稀盐酸(硝酸)(3) MgCO3+2H+=Mg2++CO2↑+H2O42、碳酸钙溶于醋酸(4) CaCO3+2HAc=Ca2++CO2↑+H2O+2Ac-43、碳酸钙与硝酸 CaCO3+2H+=Ca2++CO2↑+H2O44、氯化铵与氢氧化钠两种浓溶液混合加热 NH4++OH-=NH3↑+H2O45、SO2通入NaOH溶液(2) SO2+2OH-=SO32-+H2O SO2+OH-=H SO3-46、CO2通入NaOH溶液(4) CO32-+SO2=SO32-+CO247、用氨水吸收少量二氧化硫(2) 2NH3.H2O+SO2=2NH4++ SO32-+H2O48、钠与水的反应(4) 2Na+2H2O=2Na++2OH-+H2↑49、铁跟稀硫酸反应Fe+2H+=Fe2++H2↑50、金属铝溶于盐酸 2Al+6H+=2Al3++3H2↑51、金属铝溶于氢氧化钠溶液(2) 2Al+2OH-+2H2O=2AlO2-+3H2↑52、铁与过量的稀硝酸反应 Fe+4H++NO3-=Fe3++NO↑+2H2O53、单质铜与稀硝酸 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O54、铜片插入硝酸银溶液中 Cu+2Ag+=Cu2++2Ag55、用FeCl3溶液腐蚀印刷电路 2Fe3++Cu=2Fe2++Cu2+56、三氯化铁溶液与过量氨水反应(2) Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+57、氢氧化镁与稀硫酸反应 Mg(OH)2+2H+=Mg2++2H2O58、Na2CO3溶液中通入少量CO2CO32-+CO2+H2O=2HCO3-59、用碳酸钠溶液吸收少量二氧化硫 2OH-+CO2=CO3-+H2O OH-+CO2=HCO3-60、硫化亚铁与盐酸反应(3)FeS+2H+=Fe2++H2S↑61、FeS固体放入稀硝酸溶液中 FeS+4H++NO3-=Fe3++S↓+NO↑+2H2O62、硫化钠溶于水中、硫化钠的第一步水解 S2-+H2O≒HS-+OH-63、硫酸铜溶液中通入硫化氢Cu2++H2S=CuS↓+2H+64、醋酸钠与盐酸酸 CH3COO-+H+=CH3COOH65、醋酸钠水解 CH3COO-+H2O≒CH3COOH+OH-66、苯酚钠溶于醋酸液 C6H5O-+HAc=C6H5OH+Ac-67、甲酸钠溶液和盐酸反应 HCOO-+H+=HCOOH68、醋酸钡溶液和硫酸反应 2Ac-+2H++Ba2++SO42-=BaSO4↓+2HAc69、碳酸钙与盐酸反应 CaCO3+2H+=Ca2++CO2↑+H2O70、次氯酸钠溶液与二氧化硫反应 ClO-+SO2+H2O=SO42-+Cl-+2H+71、氯化铝与偏铝酸钠溶液反应 Al3++3AlO2-+6H2O=4Al(OH)3↓72、I-在酸性条件下与MnO2反应 MnO2+4H++2I-=Mn2++I2+2H2O73、碳酸钠溶液与硫酸氢钠溶液反应 2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O74、氯化钡溶液与硫酸铜溶液反应 Ba2++SO42-=BaSO4↓75、硫酸铜溶液与碳酸钠溶液反应 Cu2++CO32-=CuCO3↓76、硫酸铜溶液与氢氧化钠溶液反应Cu2++2OH-=Cu(OH)2↓77、硫酸铜与氢氧化钡 Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓78、铜屑与稀硫酸和过氧化氢三者反应 Cu+H2O2+2H+=Cu2++2H2O79、MnO2在酸性条件下与双氧水反应 MnO2+H2O2+2H+=Mn2++O2↑+2H2O80、SO2通入BaCl2和HNO3混合溶液中的反应3Ba2++3SO2+2H2O+2NO3-=3BaSO4↓+2NO↑+4H+81、Fe(NO3)2溶液中加入HI溶液Fe2++4H++NO3-+2I-=Fe3++I2+NO↑+2H2O82、NaNO2溶液加入酸性KMnO4溶液 CO3-+2H+=CO2↑+H2O高中化学方程式汇总1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl3、碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑4、木炭还原氧化铜: 2CuO + C 高温 2Cu + CO2↑5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl7、钠在空气中燃烧:2Na + O2△ Na2O2钠与氧气反应:4Na + O2 = 2Na2O8、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O210、钠与水反应:2Na + 2H2O = 2NaOH + H2↑11、铁与水蒸气反应:3Fe + 4H2O(g) = Fe3O4 + 4H2↑12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑13、氧化钙与水反应:CaO + H2O = Ca(OH)2 14、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O15、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3△ Fe2O3 + 3H2O↑21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH3)2SO422、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O24、氢氧化铝加热分解:2Al(OH)3△ Al2O3 + 3H2O25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl226、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl327、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温 CaSiO329、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓32、氯气与金属铁反应:2Fe + 3Cl2点燃 2FeCl3 33、氯气与金属铜反应:Cu + Cl2点燃 CuCl234、氯气与金属钠反应:2Na + Cl2点燃 2NaCl 35、氯气与水反应:Cl2 + H2O = HCl + HClO36、次氯酸光照分解:2HClO 光照 2HCl + O2↑37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O 38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O39、盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO340、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO41、二氧化硫与水反应:SO2 + H2O ≈ H2SO3 42、氮气与氧气在放电下反应:N2 + O2放电 2NO43、一氧化氮与氧气反应:2NO + O2 = 2NO2 44、二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO45、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2催化剂 2SO346、三氧化硫与水反应:SO3 + H2O = H2SO447、浓硫酸与铜反应:Cu + 2H2SO4(浓) △ CuSO4 + 2H2O + SO2↑48、浓硫酸与木炭反应:C + 2H2SO4(浓) △ CO2 ↑+ 2SO2↑ + 2H2O49、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑50、稀硝酸与铜反应:3Cu + 8HNO3(稀) △ 3Cu(NO3)2 + 4H2O + 2NO↑51、氨水受热分解:NH3·H2O △ NH3↑ + H2O 52、氨气与氯化氢反应:NH3 + HCl = NH4Cl53、氯化铵受热分解:NH4Cl △ NH3↑ + HCl↑54、碳酸氢氨受热分解:NH4HCO3△ NH3↑ + H2O↑ + CO2↑55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △ NH3↑ + NaNO3 + H2O56、氨气的实验室制取:2NH4Cl + Ca(OH)2△ CaCl2 + 2H2O + 2NH3↑57、氯气与氢气反应:Cl2 + H2点燃 2HCl58、硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △ 2NH3↑ + Na2SO4 + 2H2O59、SO2 + CaO = CaSO3 60、SO2 + 2NaOH = Na2SO3 + H2O61、SO2 + Ca(OH)2 = CaSO3↓ + H2O 62、SO2 + Cl2 + 2H2O = 2HCl + H2SO463、SO2 + 2H2S = 3S + 2H2O 64、NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2O65、Si + 2F 2 = SiF4 66、Si + 2NaOH + H2O = NaSiO3 +2H2↑67、硅单质实验室制法:粗硅的制取:SiO2 + 2C 高温电炉 Si + 2CO (石英沙)(焦碳)(粗硅)粗硅转变为纯硅:Si(粗) + 2Cl2△ SiCl4化合反应 SiCl4 + 2H2高温 Si(纯)+ 4HCl1、镁在空气中燃烧:2Mg + O2点燃 2MgO2、铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O43、铝在空气中燃烧:4Al + 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 + O2点燃 2H2O5、红磷在空气中燃烧:4P + 5O2点燃 2P2O56、硫粉在空气中燃烧: S + O2点燃 SO27、碳在氧气中充分燃烧:C + O2点燃 CO2 8、碳在氧气中不充分燃烧:2C + O2点燃 2CO9、二氧化碳通过灼热碳层: C + CO2高温 2CO 10、一氧化碳在氧气中燃烧:2CO + O2点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)2 13、无水硫酸铜作干燥剂:CuSO4+ 5H2O ==== CuSO4·5H2O 14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl分解反应 15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑16、加热高锰酸钾:2KMnO4加热 K2MnO4 + MnO2 + O2↑17、水在直流电的作用下分解:2H2O 通电 2H2↑+ O2↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO + CO2↑置换反应 20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑ 23、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O 24、木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑ 25、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O 26水蒸气通过灼热碳层H2O + C 高温 H2 + CO 27焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑其他 28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO429、甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O30、酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O31、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO232、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O35、石灰石(或大理石)与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O43. 铜在空气中受热:2Cu + O2加热 2CuO4. 铝在空气中燃烧:4Al + 3O2点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2点燃 2H2O6. 红磷在空气中燃烧:4P + 5O2点燃 2P2O57. 硫粉在空气中燃烧: S + O2点燃 SO28. 碳在氧气中充分燃烧:C + O2点燃 CO2 9. 碳在氧气中不充分燃烧:2C + O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2点燃 2CO2 11. 甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O 12. 酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 通电 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2↑16. 加热高锰酸钾:2KMnO4加热 K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑ 18. 高温煅烧石灰石:CaCO3高温 CaO + CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O 20木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3高温 4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4高温 3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4高温 3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑ 27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑ 29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑ 31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑ 33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物 +酸 -------- 盐 + 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3↓+ H2O(5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O 51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4↓+ 2HCl(7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO371.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO3 73.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH 75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O化学方程式反应现象应用2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3银白金属变为白色固体3Fe+2O2点燃Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热 4Fe + 3O2高温2Fe2O3C+O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S+O2点燃SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2Δ2KCl +3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失 2CO+O2点燃2CO2蓝色火焰煤气燃烧Zn+H2SO4=ZnSO4+H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因C + CuO 高温2Cu+ CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑冶炼金属 Fe3O4+2C高温3Fe + 2CO2↑冶炼金属C + CO2高温2CO CO2 + H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性H2CO3ΔCO2↑+ H2O 石蕊红色褪去2CH3OH+3O2点燃2CO2+4H2OCa(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑白色沉淀产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3高温 CaO+ CO2↑工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体、除水垢Na2CO3+H2SO4=Na2SO4+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温 2Fe+3CO2冶炼金属原理 Fe3O4+4CO高温 3Fe+4CO2冶炼金属原理WO3+3CO高温 W+3CO2冶炼金属原理 CH3COOH+NaOH=CH3COONa+H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4溶液由浅绿色变为无色 Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解 Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色 ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解 CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解 Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Ca(OH)2+2HCl=CaCl2+2H2OAl(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色HCl+AgNO3= AgCl↓+HNO3生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解 MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2O Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2O Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解 CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解 MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解 NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解 Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解 Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO4 3NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成 MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成 Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成CuSO4+5H2O= CuSO4·H2O 蓝色晶体变为白色粉末CuSO4·H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgCl↓+Na NO3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成 MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+CO2↑ MgCO3+2HCl= MgCl2+H2O+ CO2↑NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体。

离子方程式书写汇总1、氯化钠溶液滴加硝酸银溶液2、钠与水反应3、钠与硫酸铜溶液4、过氧化钠与水反应5、碳酸氢盐溶液与强酸溶液混合6、碳酸氢盐溶液与醋酸溶液混合7、氢氧化钙溶液与碳酸氢镁反应8、向碳酸氢钙溶液中加入过量的氢氧化钠9、向碳酸氢钙溶液中加入少量的氢氧化钠10、澄清石灰水与少量小苏打溶液混合11、澄清石灰水通入少量CO212、澄清石灰水通入过量CO213、碳酸氢钠溶液与少量石灰水反应14、碳酸氢钠溶液与过量石灰水反应15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合16、碳酸钠溶液与盐酸反应17、向氢氧化钠溶液中通入少量的CO218、过量的CO2通入氢氧化钠溶液中19、碳酸氢铵溶液中加入过量氢氧化钠溶液20、碳酸钙与盐酸反应21、碳酸钙与醋酸反应22、澄清石灰水与稀盐酸反应23、磷酸溶液与少量澄清石灰水24、磷酸溶液与过量澄清石灰水25、碳酸镁溶于强酸26、硫酸镁溶液跟氢氧化钡溶液反应27、硫酸溶液跟氢氧化钡溶液反应28、硫酸氢钠溶液与氢氧化钡反应至中性29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀30、硫酸铝溶液中加入过量氢氧化钡溶液31、氢氧化镁与稀硫酸反应32、铝跟氢氧化钠溶液反应33、物质的量之比为1:1NaAl合金置于水中34、氧化铝溶于强碱溶液35、氧化铝溶于强酸溶液36、氢氧化铝与氢氧化钠溶液37、氢氧化铝与盐酸溶液反应38、硫酸铝溶液与碳酸氢钠溶液39、硫酸铝溶液与碳酸钠溶液40、氯化铝溶液中加入过量氨水41、明矾溶液加热水解生成沉淀42、氯化铝溶液与偏铝酸钠溶液43、偏铝酸钠溶液中加入氯化铁溶液44、偏铝酸钠溶液中加入少量盐酸45、偏铝酸钠溶液中加入过量盐酸46、偏铝酸钠溶液中加入氯化铵溶液47、金属铁溶于盐酸中48、铁粉与氯化铁溶液反应49、铜与氯化铁溶液反应50、硫化亚铁与盐酸反应51、硫化钠与盐酸反应52、硫化钠溶液中加入溴水53、氯化亚铁溶液中通入氯气54、向硫酸铁的酸性溶液中通入足量的H2S55、氯化铁溶液中滴加少量硫化钠溶液56、硫化钠溶液中滴加少量氯化铁溶液57、氯化铁溶液中滴加少量碘化钾溶液58、氯化铁溶液与氢氧化钠溶液反应59、氯化铁溶液跟过量氨水反应60、氯化铁溶液与硫氰化钾溶液61、氯化铁溶液跟过量锌粉反应62、锌与稀硫酸63、锌与醋酸64、锌与氯化铵溶液65、氯化铁溶液加入碘化钾溶液66、硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液67、硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液68、四氧化三铁溶于浓盐酸69、氧化铁溶于盐酸70、氧化铁溶于氢碘酸溶液71、用氯化铁与沸水反应制氢氧化铁胶体72、向溴化亚铁溶液通入足量的氯气73、向溴化亚铁溶液通入少量氯气74、向碘化亚铁溶液通入足量氯气75、向碘化亚铁溶液通入少量氯气76、碘化钾溶液中加入氯水77、碘化钾溶液中加入过量氯水78、溴化钠溶液中加入氯水79、亚硫酸溶液中加入氯水80、亚硫酸溶液中加入氯化铁81、亚硫酸溶液中加入双氧水82、氯气通入水中83、氯气通入碳酸氢钠溶液中84、亚硫酸钠溶液中加入溴水85、亚硫酸钠溶液中加入双氧水86、二氧化硫通入溴水中87、单质铁溶于过量稀硝酸中(NO)88、过量单质铁溶于稀硝酸中(NO)89、单质铜与稀硝酸反应90、单质铜与浓硝酸反应91、铜片插入硝酸银溶液92、用氨水吸收少量SO293、用氨水吸收过量的SO294、稀硝酸中通入SO295、浓硝酸中通入SO296、氯化铵与氢氧化钠两种浓溶液混合加热97、向次氯酸钙溶液中通入SO298、用碳酸钠溶液吸收过量SO299、硫酸铜溶液中通入硫化氢100、硫酸铜溶液中加入硫化钠溶液101、电解饱和食盐水102、电解硫酸铜溶液103、电解氯化铜溶液104、电解熔融氯化钠105、电解熔融氧化铝106、二氧化锰与浓盐酸共热107、氯气通入冷的氢氧化钠溶液中108、氯气通入热的氢氧化钾溶液中109、次氯酸钙溶液通入过量的二氧化碳110、次氯酸钠溶液中加入浓盐酸111、氯酸钾与浓盐酸112、硫化钠、亚硫酸钠混合液中加入稀硫酸113、NO2溶于水114、NO2通入亚硫酸钠溶液115、硫化钠的第一步水解116、碳酸钠的第一步水解117、氯化钡溶液与硫酸反应118、硫溶于热的氢氧化钠溶液119、醋酸钡溶液与硫酸反应120、醋酸与氢氧化钾溶液反应121、醋酸与氨水反应122、苯酚溶于氢氧化钠溶液123、苯酚与氯化铁溶液反应124、苯酚钠溶于醋酸溶液125、苯酚钠溶液中通入少量CO2126、碳酸钠溶液中加入过量苯酚127、碳酸钙跟甲酸反应128、甲酸钠跟盐酸反应129、小苏打溶液与甲酸溶液反应130、Na2C2O4溶液中加入酸性高锰酸钾溶液131、酸性高锰酸钾溶液与双氧水132、酸性氯化亚铁溶液与双氧水133、SO2通入酸性高锰酸钾溶液134、乙烯通入酸性高锰酸钾溶液生成CO2135、乙酸乙酯与氢氧化钠溶液136、硬脂酸甘油酯与氢氧化钠溶液137、氯乙烷在氢氧化钠溶液中水解138、硝酸银溶液中滴入少量氨水139、硝酸银溶液中滴加氨水至过量140、葡萄糖发生银镜反应141、硫酸铜溶液中加入氢氧化钠溶液142、硫酸铜溶液中加入少量氨水143、硫酸铜溶液中加入过量氨水144、硫酸锌溶液中加入少量氨水145、硫酸锌溶液中加入过量氨水146、甘氨酸与氢氧化钠溶液147、甘氨酸与盐酸溶液148、邻羟基苯甲酸与氢氧化钠溶液149、邻羟基苯甲酸与碳酸氢钠溶液150、邻羟基苯甲酸与碳酸钠溶液参考答案:1、硝酸银与盐酸及可溶性盐酸盐溶液:Ag++Cl-=AgCl↓2、钠与水反应:2Na+2H2O=2Na++2OH–+H2↑3、钠与硫酸铜溶液:2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑4、过氧化钠与水反应:2Na2O+2H2O=4Na++4OH–+O2↑5、碳酸氢盐溶液与强酸溶液混合:HCO3-+H+=CO2↑+H2O6、碳酸氢盐溶液与醋酸溶液混合:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-7、氢氧化钙溶液与碳酸氢镁反应:Ca2++2OH-+2HCO3-+Mg2+=Mg(OH)2↓+CaCO3↓8、向碳酸氢钙溶液中加入过量的氢氧化钠:2HCO3-+Ca2++2OH–=CaCO3↓+2H2O+CO32–9、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH–=CaCO3↓+H2O10、澄清石灰水与少量小苏打溶液混合:Ca2++OH–+HCO3-=CaCO3↓+H2O11、澄清石灰水通入少量CO2:Ca2++2OH–+CO3=CaCO3↓+H2O12、澄清石灰水通入过量CO2:OH–+CO2=HCO3-13、碳酸氢钠溶液与少量石灰水反应:Ca2++2OH–+2HCO3-=CaCO3↓+CO32–+2H2O14、碳酸氢钠溶液与过量石灰水反应:HCO3-+OH–+Ca2+=CaCO3↓+H2O15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH–+NH4++HCO3-=BaCO3↓+H2O+NH3·H2O16、碳酸钠溶液与盐酸反应:CO32–+H+=HCO3- 或CO32–+2H+=CO2↑+H2O17、向氢氧化钠溶液中通入少量的CO2:CO2+2OH–=CO32–+H2O18、过量的CO2通入氢氧化钠溶液中:CO2+OH–=HCO3-19、碳酸氢铵溶液中加入过量氢氧化钠溶液:NH4++HCO3-+2OH–=NH3↑+CO32–+2H2O20、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O21、碳酸钙与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O22、澄清石灰水与稀盐酸反应:H++OH–=H2O23、磷酸溶液与少量澄清石灰水:H3PO4+OH–=H2O+H2PO4–24、磷酸溶液与过量澄清石灰水:2H3PO4+3Ca2++6OH–=Ca3(PO4)2↓+6H2O25、碳酸镁溶于强酸:MgCO3+2H+=Mg2++CO2↑+H2O26、硫酸镁溶液跟氢氧化钡溶液反应:Ba2++2OH–+Mg2++SO42–=BaSO4↓+Mg(OH)2↓27、硫酸溶液跟氢氧化钡溶液反应:Ba2++2OH–+2H++SO42–=BaSO4↓+2H2O28、硫酸氢钠溶液与氢氧化钡反应至中性:2H++SO42–+2OH–+Ba2+=2H2O+BaSO4↓29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀:H++SO42–+OH–+Ba2+=BaSO4↓+H2O30、硫酸铝溶液中加入过量氢氧化钡溶液:2Al3++3SO42–+8OH–+3Ba2+=3BaSO4↓+2AlO2–+4H2O31、氢氧化镁与稀硫酸反应:Mg(OH)2+2H+=Mg2++2H2O32、铝跟氢氧化钠溶液反应:2Al+2OH–+2H2O=2AlO2–+3H2↑33、物质的量之比为1:1NaAl合金置于水中:Na+Al+2H2O=Na++AlO2–+2H2↑34、氧化铝溶于强碱溶液:Al2O3+2OH–=2AlO2–+H2O35、氧化铝溶于强酸溶液:Al2O3+6H+=2Al3++3H2O36、氢氧化铝与氢氧化钠溶液:Al(OH)3+OH–=AlO2–+2H2O37、氢氧化铝与盐酸溶液反应:Al(OH)3+3H+=Al3++3H2O38、硫酸铝溶液与碳酸氢钠溶液:Al3++3HCO3-=Al(OH)3↓+CO2↑39、硫酸铝溶液与碳酸钠溶液:2Al3++3CO32–+3H2O=2Al(OH)3↓+3CO2↑40、氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+41、明矾溶液加热水解生成沉淀:Al3++3H2O=Al(OH)3↓+3H+42、氯化铝溶液与偏铝酸钠溶液:Al3++3AlO2–+6H2O=4Al(OH)3↓43、偏铝酸钠溶液中加入氯化铁溶液:Fe3++3AlO2–+6H2O=Fe(OH)3↓+3Al(OH)3↓44、偏铝酸钠溶液中加入少量盐酸:AlO2–+H++H2O=Al(OH)3↓45、偏铝酸钠溶液中加入过量盐酸:AlO2–+4H+=Al3++2H2O46、偏铝酸钠溶液中加入氯化铵溶液:AlO2–+NH4++H2O=Al(OH)3↓+NH3↑47、金属铁溶于盐酸中:Fe+2H+=Fe2++H2↑48、铁粉与氯化铁溶液反应:Fe+2Fe3+=3Fe2+49、铜与氯化铁溶液反应:Cu+2Fe3+=Cu2++3Fe2+50、硫化亚铁与盐酸反应:FeS+H+=Fe2++H2S↑51、硫化钠与盐酸反应:S2–+2H+=H2S↑52、硫化钠溶液中加入溴水:S2–+Br2=S↓+2Br–53、氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl–54、向硫酸铁的酸性溶液中通入足量的H2S:2Fe3++H2S=2Fe2++S↓+2H+55、氯化铁溶液中滴加少量硫化钠溶液:2Fe3++S2–=S↓+2Fe2+56、硫化钠溶液中滴加少量氯化铁溶液:2Fe3++3S2–=S↓+2FeS↓57、氯化铁溶液中滴加少量碘化钾溶液:2Fe3++2I–=2Fe2++I258、氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH–=Fe(OH)3↓59、氯化铁溶液跟过量氨水反应:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+60、氯化铁溶液与硫氰化钾溶液:Fe3++3SCN–=Fe(SCN)361、氯化铁溶液跟过量锌粉反应:2Fe3++3Zn=2Fe+3Zn2+62、锌与稀硫酸:Zn+2H+=Zn2++H2↑63、锌与醋酸:Zn+2CH3COOH=CH3COO–+Zn2++H2↑64、锌与氯化铵溶液:Zn+2NH4+=Zn2++NH3↑+H2↑65、氯化铁溶液加入碘化钾溶液:2Fe3++2I-=2Fe2++I266、硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O67、硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O68、四氧化三铁溶于浓盐酸:Fe3O4+8H+=2Fe3++Fe2++4H2O69、氧化铁溶于盐酸:Fe2O3+6H+=2Fe3++3H2O70、氧化铁溶于氢碘酸溶液:Fe2O3+2I-+6H+=2Fe2++I2+3H2O71、用氯化铁与沸水反应制氢氧化铁胶体:Fe3++3H2O Fe(OH)3+3H+72、向溴化亚铁溶液通入足量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-73、向溴化亚铁溶液通入少量氯气:2Fe2++Cl2=2Fe3++2Cl-74、向碘化亚铁溶液通入足量氯气:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-75、向碘化亚铁溶液通入少量氯气:2I-+Cl2=I2+2Cl-76、碘化钾溶液中加入氯水:2I-+Cl2=I2+2Cl-77、碘化钾溶液中加入过量氯水:I-+3Cl2+3H2O=6H++IO3-+6Cl-78、溴化钠溶液中加入氯水:2Br-+Cl2=Br2+2Cl-79、亚硫酸溶液中加入氯水:H2SO3+Cl2+H2O=4H++2Cl-+SO42-80、亚硫酸溶液中加入氯化铁:H2SO3+2Fe2++H2O=4H++2Fe2++SO42-81、亚硫酸溶液中加入双氧水:H2SO3++H2O2=2H++H2O+SO42-82、氯气通入水中:Cl2+H2O=H++Cl-+HClO83、氯气通入碳酸氢钠溶液中:Cl2+HCO3=Cl-+CO2+HClO84、亚硫酸钠溶液中加入溴水:SO32-+H2O+Br2=SO42-+Br-+2H+85、亚硫酸钠溶液中加入双氧水:SO32-+H2O2=SO42-+2H2O86、二氧化硫通入溴水中:SO2+Br2+2H2O=4H++2Br-+SO42-87、单质铁溶于过量稀硝酸中(NO):Fe+NO3-+4H+=Fe3++NO↑+2H2O88、过量单质铁溶于稀硝酸中(NO):3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O89、单质铜与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O90、单质铜与浓硝酸反应:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O91、铜片插入硝酸银溶液:2Ag++Cu=2Ag+Cu2+92、用氨水吸收少量SO2:SO2+2NH3+H2O=2NH4++SO32-93、用氨水吸收过量的SO2:SO2+NH3+H2O=NH4++HSO3-94、稀硝酸中通入SO2:3SO2+2NO3-+2H2O=3SO42-+2NO↑+4H+95、浓硝酸中通入SO2:SO2+2NO3-=SO42-+2NO2↑96、氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH-NH3↑+H2O97、向次氯酸钙溶液中通入SO2:Ca2++SO2+ClO-+H2O=CaSO4↓+Cl-+2H+98、用碳酸钠溶液吸收过量SO2:CO32-+H2O+2SO2=CO2↑+2HSO3-99、硫酸铜溶液中通入硫化氢:H2S+Cu2+=CuS↓+2H+100、硫酸铜溶液中加入硫化钠溶液:S2-+Cu2+=CuS↓101、电解饱和食盐水:2Cl-+2H2O2OH-+H2↑+Cl2↑102、电解硫酸铜溶液:2Cu2++2H2O 2Cu↓+O2↑+4H+ 103、电解氯化铜溶液:Cu2++2Cl-Cu↓+Cl2↑104、电解熔融氯化钠:2Na++2Cl-(熔融)2Na+Cl2↑105、电解熔融氧化铝:4Al3+ +6O2-4Al+3O2↑106、二氧化锰与浓盐酸共热:MnO2+2Cl-+4H+Mn2++Cl2↑+2H2O 107、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O108、氯气通入热的氢氧化钾溶液中:3Cl2+6OH-=5Cl-+ClO3-+3H2O109、次氯酸钙溶液通入过量的二氧化碳:ClO-+H2O+CO2=HClO+HCO3- 110、次氯酸钠溶液中加入浓盐酸:ClO-+Cl-+2H+=Cl2↑+H2O111、氯酸钾与浓盐酸:ClO3-+5Cl-+6H+=3Cl2↑+3H2O112、硫化钠、亚硫酸钠混合液中加入稀硫酸:2S2-+SO32-+6H+=3S↓+3H2O 113、NO2溶于水:3NO2+H2O=2H++NO3-+NO↑114、NO2通入亚硫酸钠溶液:SO32-+NO2=SO42-+NO↑115、硫化钠的第一步水解:S2-+H2O HSO3-+OH-116、碳酸钠的第一步水解:CO32-+H2O HCO3-+OH-117、氯化钡溶液与硫酸反应:Ba2++SO42-=BaSO4↓118、硫溶于热的氢氧化钠溶液:3S+6OH-=2S2-+SO32-+3H2O119、醋酸钡溶液与硫酸反应:Ba2++2CH3COO-+2H++SO42-=BaSO4↓+2CH3COOH 120、醋酸与氢氧化钾溶液反应:CH3COOH+OH-=CH3COO-+H2O121、醋酸与氨水反应:CH3COOH+NH3·H2O=CH3COO-+NH4++2H2O 122、苯酚溶于氢氧化钠溶液:C6H5OH+OH-=C6H5O-+H2O123、苯酚与氯化铁溶液反应:6C6H5OH+Fe3+=[Fe(C6H5O)6]3-+6H+124、苯酚钠溶于醋酸溶液:C6H5O-+CH3COOH=C6H5OH+CH3COO-125、苯酚钠溶液中通入少量CO2:C6H5O-+H2O+CO2=C6H5OH+HCO3-126、碳酸钠溶液中加入过量苯酚:C6H5OH+CO32-=C6H5O-+HCO3-127、碳酸钙跟甲酸反应:CaCO3+HCOOH=Ca2++CO2↑+H2O+HCOO- 128、甲酸钠跟盐酸反应:HCOO-+H+=HCOOH129、小苏打溶液与甲酸溶液反应:HCOOH+HCO3-=CO2↑+H2O+HCOO-130、Na2C2O4溶液中加入酸性高锰酸钾溶液:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O131、酸性高锰酸钾溶液与双氧水:5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O 132、酸性氯化亚铁溶液与双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O133、SO2通入酸性高锰酸钾溶液:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+134、乙烯通入酸性高锰酸钾溶液生成CO 2:5C 2H 4+12MnO 4-+36H +=10CO 2↑+12Mn 2++28H 2O135、乙酸乙酯与氢氧化钠溶液:CH 3COOCH 2CH 3+OH -=CH 3COO -+HOCH 2CH 3 136、硬脂酸甘油酯与氢氧化钠溶液:(C 17H 35COO)3(C 3H 5O 3)+3OH -=3C 17H 35COO -+CH 2(OH)CH(OH)CH 2OH137、氯乙烷在氢氧化钠溶液中水解:CH 3CH 2Cl+OH -=CH 3CH 2OH+Cl-138、硝酸银溶液中滴入少量氨水: Ag ++NH 3·H 2O=AgOH ↓+NH 4+139、硝酸银溶液中滴加氨水至过量:Ag ++2NH 3·H 2O=[Ag(NH 3)2]++2H 2O 140、葡萄糖发生银镜反应:CH 2(OH)(CHOH)4CHO+2[Ag(NH 3)2]++2OH -=CH 2(OH)(CHOH)4COO -+NH 4++3NH 3+H 2O+2Ag ↓141、硫酸铜溶液中加入氢氧化钠溶液:Cu 2++2OH -=Cu(OH)2↓ 142、硫酸铜溶液中加入少量氨水:Cu 2++2NH 3·H 2O=Cu(OH)2↓+2NH 4+143、硫酸铜溶液中加入过量氨水:Cu 2++4NH 3·H 2O=[Cu(NH 3)4]2++4H 2O144、硫酸锌溶液中加入少量氨水:Zn 2++2NH 3·H 2O=Zn(OH)2↓+2NH 4+145、硫酸锌溶液中加入过量氨水:Zn 2++4NH 3·H 2O=[Zn(NH 3)4]2++4H 2O146、甘氨酸与氢氧化钠溶液:NH 2CH 2COOH+OH -=NH 2CH 2COO -+H 2O147、甘氨酸与盐酸溶液: NH 2CH 2COOH+H +=[ NH 3CH 2COOH]+148、邻羟基苯甲酸与氢氧化钠溶液:149、邻羟基苯甲酸与碳酸氢钠溶液:150、邻羟基苯甲酸与碳酸钠溶液:。

(化学)高考化学高中化学离子反应常见题型及答题技巧及练习题(含答案)一、高中化学离子反应1.下列离子方程式书写正确的是A.H 2S 溶液显酸性:H2S+2H2O2H3O++S2-B.将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+3ClO-=SO42-+Cl-+2HC1OC.向Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2OD.向FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-【答案】B【解析】【分析】【详解】A.H 2S属于弱酸,分步电离,且以第一步电离为主,H2S+H2O H3O++HS-,故A错误;B.少量二氧化硫通入次氯酸钠溶液中发生氧化还原反应,反应的离子方程式为SO2+3ClO-+H2O=SO42-+2HClO+Cl-,故B正确;C.向Ca(HCO3)2溶液中加入澄清石灰水,与用量无关,离子方程式:Ca2++HCO3-+OH-═CaCO3↓+H2O,故C错误;D.向FeI2溶液中通入少量Cl2,只氧化I-,反应的离子方程式为:2I-+Cl2═I2+2Cl-,故D错误;故选B。
【点睛】本题的易错点为CD,C中反应与用量无关,要注意与NaHCO3溶液中加入澄清石灰水的区别;D中要注意亚铁离子和碘离子的还原性的强弱比较,反应时,首先与还原性强的离子反应。
2.某100mL溶液可能含有 Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法正确的是A.若原溶液中不存在 Na+,则 c(Cl-)<0.1mol•L﹣1B.原溶液可能存在 Cl-和 Na+C.原溶液中 c(CO32-)是 0.01mol•L﹣1D.原溶液一定存在 CO32-和SO42-,一定不存在 Fe3+【答案】D【解析】【分析】加入BaCl2溶液之后,有沉淀生成,且加入过量盐酸之后,沉淀质量减少,则说明一定有CO 32-、SO 42-这两种离子,一定没有Fe 3+(Fe 3+和CO 32-会发生双水解反应,不能共存),且沉淀2为BaSO 4,n(BaSO 4)=-1m 2.33g ==0.01mol M 233g molg ,m(BaCO 3)=4.30g-2.33g=1.97g ,则n(BaCO 3)= -1m 1.97g ==0.01mol M 197g molg 。
高三化学离子方程式的书写及正误判断试题1.能正确表示下列反应的离子方程式的是A.硫酸溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2OB.NaHCO3溶液水解:HCO3-+H2O H3O+ +CO32-C.NaOH溶液中加入铝片:Al+2OH-=AlO2-+H2↑D.NH4HCO3溶液与足量烧碱溶液混合:HCO3-+OH-=CO32-+H2O【答案】A【解析】A、正确;B、多元弱酸水解应分步进行,且以第一步水解为主;C、电荷不守恒;D、NH4+也可与OH-反应。
【考点】考查离子方程式的正误判断。
2.下列离子方程式正确的是【答案】B【解析】A中次氯酸是弱酸,不应拆开,且反应为可逆反应;铜做电极,阳极铜溶解,阴极Cu2+发生还原反应;D中电荷和原子不守恒。
答案选B。
3.下列反应的离子方程式书写正确的是A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-++=BaCO3↓+NH3·H2O+H2OB.氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2OC.向亚硫酸钠溶液中加入足量硝酸:+2H+=SO2↑+H2OD.向AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+【答案】A【解析】B项Fe3+能够将I-氧化为I2;C项亚硫酸钠与硝酸的反应为氧化还原反应;D项氨水过量时不能得到沉淀,而是形成银氨溶液。
4.下列表示对应化学反应的离子方程式正确的是()。
A.NO2通入水中:3NO2+H2O=2H++2NO3—+NOB.用两个铜电极电解CuSO4溶液:2Cu2++2H2O2Cu+O2↑+4H+C.SO2通入FeCl3溶液中:SO2+Fe3++2H2O=SO42—+Fe2++4H+D.过量的CO2通入NaAlO2溶液中:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32—【答案】A【解析】B项,铜作电极,则阳极上铜电极溶解,阴极上铜离子放电析出铜,故不正确;C项,离子方程式未配平,正确的离子方程式应为SO2+2Fe3++2H2O=SO42—+2Fe2++4H+;D项,通入过量的CO2气体应该生成HCO3—,正确的离子方程式应为AlO2—+CO2+2H2O=Al(OH)3↓+HCO3—。
高三化学加时训练1 班级姓名座号写出下列反应的离子方程式(每题4分)1.钠与水反应2.钠与硫酸铜溶液3.工业制钠4.过氧化钠与水反应5.向碳酸钠溶液中滴入少量稀盐酸6.向稀盐酸中滴入少量碳酸钠溶液7.工业制烧碱、氯气(氯碱工业)8.NaHCO3溶液与过量石灰水9.Na2CO3俗名纯碱的离子方程式10.向石灰水中通入过量CO211.铝与NaOH溶液12.NaAlO2溶液与少量盐酸反应13.往NaAlO2溶液中通入少量CO214.明矾用作净水剂15.泡沫灭火器原理16.工业冶炼铝17.氯化亚铁溶液与氯水反应18.向氯化铁溶液加入铁粉19.证明Fe3+氧化性强于Cu2+(腐蚀印刷铜电路板反应)20.用湿润淀粉碘化钾溶液验证Fe3+有氧化性21.用KSCN溶液检验Fe3+离子22.FeO与稀硝酸23.氢碘酸与Fe2O324.向NaHSO4溶液中逐滴滴入Ba(OH)2溶液至溶液恰好呈中性(或至SO42-刚好完全沉淀) 25.向硫酸亚铁溶液中加入硫酸酸化的氯酸钠溶液高三化学加时训练2班级姓名座号写出下列反应的离子方程式(除特别说明写化学方程式外)(每题4分)1.向水玻璃(硅酸钠溶液)中通入过量CO22.氢氟酸能雕刻玻璃的原因(写化学方程式)3.工业制粗硅(写化学方程式)4.实验室用二氧化锰和浓盐酸加热制氯气5.氯气用于自来水消毒、杀菌6.工业制漂白液7.漂白粉失效原理(写化学方程式两个)8.用酸性高锰酸钾溶液验证SO2有还原性9.向稀氨水中通入过量SO210.SO2气体通入溴水11.SO2气体与H2S气体混合(写化学方程式)12.浓H2SO4与铜反应13.NO2气体与水反应14.氨水的弱碱性15.硫酸铝溶液与稀氨水反应16.实验室制氨气(写化学方程式)17.工业制氨气(写化学方程式)18.氨气与氧气反应(写化学方程式)19.NH4+的检验20.稀HNO3与银反应。
21.铁与过量稀硝酸反应22.浓HNO3与碳单质反应23.浓HNO3受热分解(写化学方程式)24.NO2气体与NaOH溶液反应生成亚硝酸钠、硝酸钠和水25.酸性溶液中,用草酸钠(Na2C2O4)还原氯酸钠制得ClO2(以下写出正极、负极的电极反应式):47.铝-空气-海水电池48.碱性锌锰电池49.普通锌锰电池50.银锌电池(纽扣电池)51.铅蓄电池(放电)52.CO-O2-熔融碳酸盐(可传导CO32-)燃料电池53.二甲醚(CH3OCH3)-O2-KOH溶液燃料电池54.丁烷-空气-固体氧化物(可传导O2-)燃料电池55.锂电池(Li-SOCl2-LiAlCl4有机电解质)。
高三化学离子方程式的书写及正误判断试题答案及解析1.下列离子方程式书写正确的是A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH—=BaSO4↓+H2OB.NaClO溶液与FeCl2溶液混合:Fe2++2ClO—+2H2O =Fe(OH)2↓+2HC1OC.NH4HSO3溶液与足量NaOH溶液反应:NH+4+OH—=NH3↑+H2OD.将1mol/LNaAlO2溶液和1.5mol/L的HC1溶液等体积均匀混合:6AlO—2+9H++3H2O=5Al(OH)3↓+Al3+【答案】D【解析】A、二者反应至中性时硫酸氢钠物质的量是氢氧化钡物质的量的2倍,与离子方程式不符,错误;B、次氯酸钠具有强氧化性,与亚铁离子发生氧化还原反应,生成氢氧化铁和氯离子,错误;C、亚硫酸氢铵与足量氢氧化钠反应时,亚硫酸氢根离子也与氢氧化钠反应生成亚硫酸根离子和水,错误;D、将1mol/LNaAlO2溶液和1.5mol/L的HC1溶液等体积均匀混合,盐酸稍过量,偏铝酸根离子与氢离子的物质的量符合1:1.5,溶液中既有氢氧化铝沉淀,又有铝离子,符合离子方程式的书写,正确,答案选D。
【考点】考查对离子方程式书写的判断2.书写离子方程式(8分)(1)铜和足量浓硝酸反应的离子方程式为(2)二氧化锰与足量浓盐酸反应的离子方程式为:(3)向碳酸氢钾溶液中滴入少量澄清石灰水反应的离子方程式为:(4)向明矾溶液中加入过量的氢氧化钡溶液反应的离子方程式为【答案】21.书写离子方程式(8分)(1) Cu+4H++2NO3-═Cu2++2H2O+NO2↑(2)MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O(3)2HCO3-+Ca2++2OH-=CO32-+2H2O+CaCO3↓(4)Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O【解析】根据书写原则:单质、气体、氧化物、弱酸、弱碱、难溶盐写成化学式,强酸、强碱、可溶性的盐写成离子形式,(1)铜和足量浓硝酸反应,铜、水、气体写成化学式,其余拆开,可得:Cu+4H++2NO3-═Cu2++2H2O+NO2↑(2)二氧化锰与足量浓盐酸反应,氧化物、气体、水写成化学式,其余拆开,可得MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O(3)依据“以少定多”的原则,向碳酸氢钾溶液中滴入少量澄清石灰水反应的离子方程式为:2HCO3-+Ca2++2OH-=CO32-+2H2O+CaCO3↓(4)依据“以少定多”的原则,向明矾溶液中加入过量的氢氧化钡溶液反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O【考点】考查离子方程式的书写。
与酸碱性有关的离子方程式的书写一、氧化还原的离子方程式:1、高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。
FeCl3与KClO 在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为__________________________________________________________________。
2、ZnSO4溶液中含有少量Fe2+和Mn2+,为了除去这两种离子,调节溶液pH为5,然后加入高锰酸钾溶液,使之生成沉淀。
已知高锰酸钾的还原产物是MnO2。
请写出该过程中两反应的离子方程式:___________________________________________________。
3、Na2S溶液长期放置有硫析出,原因为___________________________________。
4、①在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为________________________________________________________。
②在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,离子方程式是_______________________________________________________。
二、原电池的离子方程式:1、按要求写出电极反应式或总反应方程式。
(1) 肼(N2H4)_空气燃料电池是一种碱性电池,该电池放电时,负极的电极反应式为____________________。
(2)K2FeO4\Zn可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应为________________________________________________________________________,该电池总反应的离子方程式为_______________________。
与酸碱性有关的离子方程式的书写
一、氧化还原的离子方程式:
1、高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。
FeCl3与KClO 在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
__________________________________________________________________。
2、ZnSO4溶液中含有少量Fe2+和Mn2+,为了除去这两种离子,调节溶液pH为5,然后加入高锰酸钾溶液,使之生成沉淀。
已知高锰酸钾的还原产物是MnO2。
请写出该过程中两反应的离子方程式:___________________________________________________。
3、Na2S溶液长期放置有硫析出,原因为___________________________________。
4、①在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为________________________________________________________。
②在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,
离子方程式是_______________________________________________________。
二、原电池的离子方程式:
1、按要求写出电极反应式或总反应方程式。
(1) 肼(N2H4)_空气燃料电池是一种碱性电池,该电池放电时,负极的电极反应式为____________________。
(2)K2FeO4\Zn可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应为________________________________________________________________________,该电池总反应的离子方程式为_______________________。
(3)铝电池性能优越,Al_AgO电池可用作水下动力电源,其原理如下图所示。
该电池反应的化学方程式为_______________________________________________________。
2、(1)直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,负极反应式为_______________________________、正极反应式为_________________________________。
3、以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是:_________________________________。
三、电解池的离子方程式:
1、以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为________________________________________________________________________。
2、以铁为阳极电解氢氧化钠溶液,电解时阳极发生反应生成FeO2-4,该电极反应方程式
为____________________________________________________________________。
3、右图为电解精炼银的示意图, (填a 或b )极为含有杂
质的粗银,若b 极有少量红棕色气体生成,则生成该气体的电极反
应式为
4、电化学降解NO 3-为N 2的原理如题29图所示。
阴极反应式为
5、MnO 2可作超级电容器材料。
用惰性电极电解MnSO 4溶液可制得MnO 2,其阳极的电极反应式是_________________________________。
6、PbO 2也可以通过石墨为电极Pb(NO 3)2和Cu(NO 3)2的混合溶液为电解液电解制取。
阳极发生的电极反应式为_ _。
四、其它
1、已知:还原性HSO -3>I -,氧化性IO -3>I 2。
分别在NaIO 3溶液中滴加少量NaHSO 3溶液和过量NaHSO 3溶液,反应的离子方程式:__________________________;__________________________。
在含 5 mol NaHSO 3的溶液中逐滴加入含 1.8 mol NaIO 3的溶液。
离子方程式是__________________________。
2、 已知氧化还原反应:①2Fe 3++2I —=2Fe 2++I 2 ②2Fe 2++Br 2=2Fe 3++2Br ③2Br —+Cl 2=Br 2+2Cl —现向含a molFeI 2和b molFeBr 2的混合液中逐渐通入c molCl 2,反应随Cl 2通入明显分成几个阶段进行,试分别填写在c 值增大过程中,不同c 值范围内,被氧化的离子及被氧化离子的物质的量(用含a 、b 、c 代数式表示)。
变式训练:已知氧化性溴酸、碘酸、溴单质、碘单质依次减弱,现向含1mol 的碘化钠酸性溶液中加amol 的溴酸钠,试分析a 在不同的取值范围内收对应的氧化还原产物及其物质的量。