原子吸收光谱法的定量分析方法和测定条件的选择
- 格式:ppt
- 大小:1.60 MB
- 文档页数:22


原子吸收光谱的定量依据
原子吸收光谱是一种分析化学方法,它基于原子对特定波长的光的吸收来定量分析样品中的元素。
该方法的基本原理是,当原子处于基态时,它们可以通过吸收电磁辐射而被激发到激发态,这种激发态是非常短暂的,常常只有几微秒的寿命。
在激发态中,原子会吸收特定波长的光,并且其吸收量与元素浓度成正比。
因此,通过测量所吸收光的强度,可以计算出样品中的元素浓度。
原子吸收光谱定量分析的精度和准确性取决于很多因素,其中最重要的是所选用的谱线。
对于每个元素,都有一些谱线可以用来进行定量分析。
这些谱线的选择应该基于它们的灵敏度、准确性、稳定性和实验条件等因素。
一般来说,具有较高灵敏度和稳定性的谱线应该被优先选择。
除了谱线的选择外,还有一些其他因素也会影响到原子吸收光谱的精度和准确性。
这些因素包括样品制备、仪器校准和环境条件等。
为了获得准确的分析结果,必须严格控制这些因素。
总之,原子吸收光谱是一种非常有用的分析化学方法,它可以用于定量分析广泛的元素。
对于这种方法的应用,我们需要选择适当的谱线,并严格控制所有影响分析结果的因素。
- 1 -。
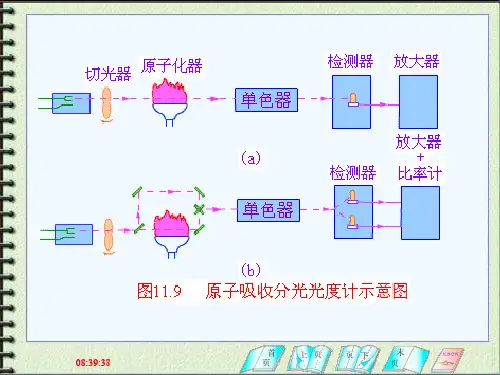

原子吸收定量分析方法一、定量分析方法(P145)⑴标准曲线法:配制一系列浓度不同的标准溶液,在相同测定条件下,测定标准系列溶液和待测试样溶液的吸光度,绘制A-c标准曲线,由待测溶液的吸光度值在标准曲线上得到其含量。
(2)标准加入法当试样组成复杂,待测元素含量很低时,应采用标准加入法进行定量分析。
取若干份体积相同的试液(cX),依次按比例加入不同量的待测物的标准溶液(cO):浓度依次为:cX,cX+cO,cX+2cO,cX+3cO,cX+4cO …分别测得吸光度为:AX ,A1 ,A2 ,A3 ,A4 …直线外推法:以对浓度做图得一直线,图中cX点即待测溶液浓度。
(3)稀释法:⑷内标法:在标准试样和被测试样中,分别加入内标元素,测定分析线和内标线的吸光度比,并以吸光度比与被测元素含量或浓度绘制工作曲线。
内标元素的选择:内标元素与被测元素在试样基体内及在原子化过程中具有相似的物理化学性质,样品中不存在,用色谱纯或者已知含量二、灵敏度和检出限(1)灵敏度1、定义:在一定浓度时,测定值(吸光度)的增量(△ A)与相应的待测元素浓度(或质量)的增量(△ c或A m)的比值(即分析校正曲线的斜率)PS:习惯上用特征浓度和特征质量表征灵敏度2、特征浓度定义:能产生1%吸收或产生0.0044吸光度时所对应的被测元素的质量浓度定义为元素的特征浓度3、特征质量定义:能产生1%吸收或产生0.0044吸光度时所对应的被测元素的质量定义为元素的特征质量。
(2)检出限定义:适当置信度下,能检测出的待测元素的最低浓度或最低质量。
用接近于空白的溶液,经若干次重复测定所得吸光度的标准偏差的3倍求得。
(3)测定条件的选择1.分析线的选择每种元素都有几条可供选择使用的吸收线。
一般选待测元素的共振线作为分析线,可以得到最好的灵敏度。
在测量高含量元素时,也可选次灵敏线。
2.单色器光谱通带的选择(调节狭缝宽度)光谱通带的选择以排除光谱干扰和具有一定透光强度为原则。



第四章原子吸收光谱法测定条件的选择1.空心阴极灯测量条件的选择1.1 吸收线选择为获得较高的灵敏度、稳定性、宽的线性范围和无干扰测定 , 须选择合适的吸收线。
选择谱线的一般原则:a)灵敏度一般选择最灵敏的共振吸收线, 测定高含量元素时 , 可选用次灵敏线。
例如在测定高浓度钠时,不选择最灵敏线(589.0nm),而选择次灵敏线(330.2 nm)。
具体可参考Z-5000分析软件中提供各元素的谱线信息。
b)干扰谱线干扰当分析线附近有其他非吸收线存在时 , 将使灵敏度降低和工作曲线弯曲 , 应当尽量避免干扰。
例如 ,Ni230.Om 附近有 Ni231.98nm 、 Ni232.14 nm 、 Ni231.6nm 非吸收线干扰,因此,可选择灵敏度稍低的吸收线(341.48 nm)作为分析线。
而测定铷时,为了消除钾、钠的电离干扰,可用798.4nm代替780.0nm。
c)仪器条件大多数原子吸收分光光度计的波长范围是190 900 nm,并且一般采用光电倍增管作为检测器,它在紫外区和可见区具有较高的灵敏度.因此,对于那些共振线在这些区域附近或以外的元素,常选用次灵敏线作为分析波长。
例如测定铅时,为了克服短波区域的背景吸收和吸收和噪声,一般不使用217.0nm灵敏线而用283.3nm谱线。
1.2 电流的选择选择合适的空心阴极灯灯电流 , 可得到较高的灵敏度与稳定性,图4-1为Cd 灵敏对水灯电流变化的曲线。
从灵敏度考虑 , 灯电流宜用小 , 因为谱线变宽及自吸效应小 , 发射线窄 , 灵敏度增高。
但灯电流太小 , 灯放电不稳定,光输出稳定性差,为保证必要的信号输出,势必增加狭缝宽度或提高检测器的负高压,这样就会引起噪声增加,使谱线的信噪比降低,导致精密度降低。
从稳定性考虑 , 灯电流要大 , 谱线强度高 , 负高压低 , 读数稳定 , 特别对于常量与高含量元素分析 ,灯电流宜大些。
灯电流的选择原则是:保证稳定放电和合适的光强输出的前提下,尽可能选用较低的工作电流。


火焰原子吸收光谱法测定饮用水中的钙一、实验目的1、了解原子吸收光谱仪的结构及其操作。
2、掌握以原子吸收光谱法进行定量测定的方法。
3、学会优选测定条件方法。
二、实验要求1、要求同学利用所学原子吸收光谱知识,设计出用火焰原子化法对钙元素的测定,选择出最佳测试条件。
2、设计出合理的实验方法(两种)测定出饮用水中的钙。
三、实验条件1、仪器:日立180-80型原子吸收光谱仪;电子天平(0.0001g);空心阴极灯(钙);空气压缩机;容量瓶;移液管;烧杯。
2、试剂:盐酸(优级纯)溶液;HCl(1+2)。
钙标准溶液的配制:Ca=1000μg/mL准确称取2.5000g(优级纯)CaCO3(在120℃,烘2小时),加去离子水50mL,滴加HCl溶液(1+2)至CaCO3完全溶解,移入1000 mL容量瓶中,用去离子水稀释至刻度,摇匀。
工作液的配制:Ca=100μg/mL取10.0 mL钙的标准溶液于100 mL容量瓶中,用去离子水稀释至刻度,摇匀。
四、实验方案1、原理:根据原子吸收定量的原理 A=KLC2、定量的方法:标准曲线法采用标准曲线法定量饮用水中微量钙,以钙标准系列溶液浓度为横坐标,以对应的吸光度为纵坐标绘制一通过原点的直线,在相同的条件下测得样品溶液的吸光度值,进而计算出样品中钙的含量。
标准加入法以钙的标准加入法工作溶液测得吸光度,绘制工作曲线,将其外推,求得饮用水中钙的含量。
3、实验方法3.1系列标准溶液的配制取5个100 mL容量瓶,依次加入0.00, 1.00, 3.00,5.00 ,7.00mL100μg/mL钙的工作标准溶液,用去离子水稀释至刻度,摇匀。
此标准系列钙的浓度为0.00, 1.00, 3.00,5.00 ,7.00 μg/mL。
3. 2 未知样溶液的配制取20mL饮用水于100mL容量瓶中,用去离子水稀释至刻度,摇匀。
3.3标准加入法工作液的配制取4个100 mL容量瓶,各加入10 mL 未知试样溶液,然后依次加入0.0, 1.0, 3.0, 5.0 mL100μg/mL的钙工作标准溶液,用去离子水稀释至刻度,摇匀。


原子吸收光谱法测量条件的选择
原子吸收光谱法测量条件的选择主要考虑以下几个方面:
1. 波长:选择与元素对应谱线的波长,使吸收峰的信号强度达到最大,同时避开可能受到干扰的谱线。
2. 稀释度:稀释度应适中,既要保证峰高足以显示,又要避免过浓引起信号饱和。
3. 标准品:选择与待测物质相同的标准品进行测量,即应选择含有相同量的待测元素的标准品。
4. 干扰元素的消除:如有干扰元素,则在选择波长时需要避开其谱线,或加入掩蔽剂或使用背景校正技术等方法进行干扰消除。
5. 试剂或样品预处理:某些元素需要特殊的试剂处理或样品预处理才能进行测量,如钠可通过加入碳酸钠等试剂后预处理,然后进行测量。
总之,选择合适的测量条件是保证原子吸收光谱法测量精度和准确度的关键。
(完整版)原子吸收光谱的定量分析
介绍
原子吸收光谱是一种常用的定量分析方法,用于测量样品中特定元素的浓度。
本文档旨在介绍原子吸收光谱的基本原理和定量分析的步骤。
原理
原子吸收光谱利用原子吸收特定波长的光来测量样品中特定元素的浓度。
当光通过样品中的原子气体时,原子会吸收与其原子结构相关的特定波长的光线。
通过测量吸收光的强度,可以确定样品中特定元素的浓度。
步骤
以下是进行原子吸收光谱定量分析的基本步骤:
1. 样品制备:将待分析的样品转化为原子气态。
常用的方法包括火焰法、电感耦合等离子体法等。
2. 选择波长:根据待分析元素的吸收峰进行波长选择。
可以通过参考相关文献或经验来确定。
3. 校准曲线:准备一系列浓度已知的标准溶液,测量它们的吸光度,并绘制校准曲线。
4. 测量样品:将样品引入原子吸收光谱仪器,测量其吸光度。
5. 数据分析:利用校准曲线,计算出样品中特定元素的浓度。
6. 重复测量:进行重复测量,确保结果的准确性和可靠性。
7. 结果报告:将测得的浓度结果整理并报告。
结论
原子吸收光谱是一种可靠的定量分析方法,能够有效测量样品中特定元素的浓度。
正确的样品制备、波长选择和数据分析步骤对于获得准确结果至关重要。
通过遵循上述步骤,可以进行原子吸收光谱的定量分析。
*注意:本文档仅为介绍原子吸收光谱的基本原理和步骤,具体实验细节和参数设置需要根据实际情况进行调整。
*。