氢原子和类氢离子薛定谔方程的直角坐标表示式
- 格式:ppt
- 大小:4.69 MB
- 文档页数:159

氢分子的薛定谔方程
氢分子的薛定谔方程是描述氢分子体系的基本定律。
它是由薛定谔方程推导而来,其中包括两个氢原子核和两个电子的相互作用。
这个方程表示了氢分子的波函数在空间中的变化规律和时间的演化。
氢分子的薛定谔方程可以写成:
HΨ= EΨ
其中,H是哈密顿算符,Ψ是氢分子的波函数,E是氢分子的能量。
哈密顿算符包括两部分,分别是动能和势能:
H = T + V
其中,T是氢分子中两个电子的动能,V是氢分子中两个电子和两个原子核之间的相互作用势能。
这个势能包括库伦势能和交换-相关势能。
解决氢分子的薛定谔方程需要用到量子力学的一些基本概念和数学方法,如波函数、本征值和本征函数等。
解得氢分子的波函数后,可以通过它来计算氢分子的性质,如能量、电荷密度、偶极矩等。
总之,氢分子的薛定谔方程是描述氢分子体系的一种数学表达方式,它是量子力学的基础之一。




氢原子的薛定谔方程
氢原子是最简单的原子之一,由一个质子和一个电子组成。
在量子力学中,描述氢原子的运动状态的数学模型就是薛定谔方程。
薛定谔方程是量子力学的基础方程之一,它描述了微观粒子在势场中的运动规律。
薛定谔方程是一个偏微分方程,描述了波函数随时间和空间的演化。
波函数包含了粒子的所有信息,包括位置、动量等。
在氢原子的情况下,薛定谔方程可以被简化为一个径向部分和一个角向部分的乘积。
径向部分描述了电子在原子核周围运动的距离,角向部分描述了电子在不同方向上的概率分布。
通过求解薛定谔方程,我们可以得到氢原子的能级和波函数,从而进一步研究原子的性质和行为。
薛定谔方程的求解需要考虑原子核和电子之间的相互作用,以及外加的势场对电子的影响。
通过引入适当的近似和数值方法,可以求解薛定谔方程并得到氢原子的能级和波函数。
氢原子的能级是量子化的,即只能取离散的数值。
能级越高,电子离原子核越远,能量也越大。
每个能级对应一个波函数,描述了电子在原子周围的分布情况。
薛定谔方程的求解不仅可以用于氢原子,还可以推广到其他原子和
分子系统。
通过求解薛定谔方程,我们可以理解原子和分子的结构、性质和反应规律,为化学和物理学的发展提供重要的理论基础。
薛定谔方程是描述氢原子和其他微观粒子运动的重要方程,它揭示了量子力学世界的奥秘。
通过求解薛定谔方程,我们可以深入理解原子和分子的微观世界,为科学研究和技术应用提供重要支持。
希望未来能够进一步探索量子力学的奥秘,推动科学的发展和进步。



氢原子的薛定谔方程
薛定谔方程是一个著名的电子结构理论,可以用来描述一个原子的电子状态。
它是一个带有四个变量的复合实现方程,被称为薛定谔方程。
它由20世纪伟大的物理学家Ernst Schrdinger发明,他是量子力学的创始人。
当谈到氢原子时,薛定谔方程还可以用来解释它的电子状态。
氢原子只有一个电子,因此为了解释它的电子状态,只需要一个薛定谔方程。
薛定谔方程可以如下表达:
iψ/t = ^2/2m·^2ψ + Vψ
其中,ψ表示波函数;i是虚数单位;表示普朗克常数,ψ/t表示时间导数;m是电子的质量;^2表示laplace算符;V表示电子的势能。
薛定谔方程简写为:
Hψ = εψ
其中,H表示哈密顿量,ε表示电子的能量。
对氢原子的薛定谔方程可以写为:
[^2/2m·^2+ V(r)E]ψ(r) = 0
其中,V(r)表示电子势能,E表示电子能量,r表示电子的位置半径。
解决氢原子的薛定谔方程需要一些技巧——定义一个适应性正交基函数组,利用拉普拉斯算符变换到正交空间,然后使用矩阵方法解决。
有时,哈密顿量可以被简化为一个对角矩阵,这一点取决于电
子势能的类型。
任何时候,电子能量的计算都是从在某个特定的位置的电子的能量开始的。
氢原子可以通过薛定谔方程来解释,并且可以计算出它的电子能量,解释的结果可以用来解释它的原子结构。
薛定谔方程对氢原子的电子状态起着至关重要的作用。

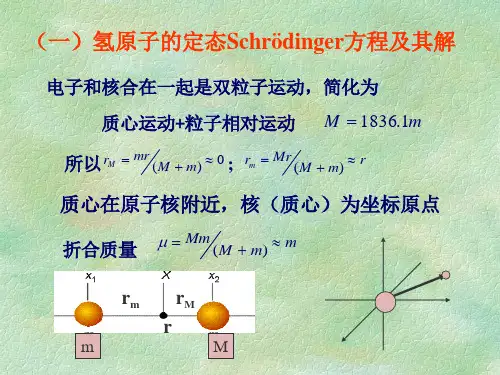
第二章 原子结构与性质§2.1.氢原子和类氢原子的薛定谔方程及其解 2.1.1.单电子原子的薛定谔方程H 原子和He +、Li 2+ 等类氢离子是单原子,它们的核电荷数为Z ,若把原子的质量中心放在坐标原点上,绕核运动的电子离核的距离为r ,电子的电荷为-e ,其静电作用势能为:r Ze V 024πε-=将势能代入薛定谔方程:得 0)(22282=ψ++ψ∇rZe h mE π或ψ=ψ-∇-E rZe mh ][22228π为了解题方便,将x 、y 、z 变量换成极坐标变量r 、θ、φ。
其关系:φθcos sin r x = φθsin sin r y =φcos r z =2222z y x r++=21)/(cos 222z y x Z ++=θx y tg /=φ})(sin )({2222sin 1sin 1212φθθθθθ∂∂∂∂∂∂∂∂∂∂++=∇r rr r 代入薛定谔方程:)()(sin )(2222222228sin 11sin 1121=ψ++++∂∂∂ψ∂∂∂∂∂∂∂rZe h mr r r rr E r πφθθθθθ2.1.2.分离变量§法:上述的方程是含三个度量的偏微分方程,要解这个方程可用度数分离法将其化为三个分别只含一个度量的常微分方程求解。
含:)()()(),,(φθθΦΘ=Φψr R r 代入方程:并乘以ΘΦR r θ22sin 移项可得:)(sin )(sin )(228sin 2sin 122222V E r r hu d d d ddr dR drdR d d ----=ΘΘΦΦθθπθθθθφ左边不含r 、θ,右边不含φ,欲左右两边相等必等于同一个常数(-m 2 )Φ-=Φ222m d d φ, 而右边可为:(除以sin θ))(sin )()(sin1sin 8212222θθθθπθd d d d m hur dr dR drdR V E r ΘΘ-=-+ 则有:K d d d d m =-ΘΘ)(sin sin1sin 22θθθθθK E r rZe hur dr dR drdR =++)()(2222821π2.1.3.方程解的结果 2.1.3.1.Φ(φ)方程的解0222=Φ+Φm d d φ这是一个常系数二阶齐次线性方程,有两个复函数的独立解。
强电、磁场效应中的氢及类氢原子强电、磁场效应是指外加的静电场、静磁场和交变电磁场的场强大到已不能作为微扰时对原子分子体系的物理和化学性质的影响。
实验表明髙激发态里德伯原子的能级特性与外场异常敏感而且复杂。
而理论研究也很困难,在弱外场下,可用微扰法求解薛定谔方程计算能级的劈裂、移动和展宽,得到与实验一致的结果。
强外场下就不能用微扰法,需要严格求解含外场的薛定谔方程,这变得很困难。
这种困难主要在于外场的静电力、洛伦兹力和核的库仑力具有各自不同的对称性。
大多数理论计算仍集中在氢原子,或以氢原子为模型的适当修正,如碱金属原子。
由于在均匀外电场中的哈密顿量在抛物坐标中变量是可分离的,相对计算容易一些。
本文简单的记述国内关于强电、磁场中氢以及类氢原子的部分研究。
一、强电场中的氢及类氢原子高激发态里德伯原子在电场下行为主要有电离和斯塔克效应这两方面的情况。
由于氢原子和类氢离子基态s电子波函数是球对称的它的点和分布中心和原子核是重合的。
可以证明:任意一个具有确定角动量量子数l态的固有电偶极矩也为零。
但是每一个n≠1的激发态,由于对l是简并的,不同l态线型叠加的结果使固有电偶极矩不为零。
对其他多电子原子,如碱金属原子,由于轨道贯穿和极化效应,使能级对l的简并破坏,它们的固有电偶极矩也为零。
在均匀电场作用下,原子被计划,电子云中心不再与核重合,原子还能产生电偶极矩。
除了原子具有的固有电偶极矩d0之外,外场诱导的电偶极矩d1正比于场强E。
原子具有的总电偶极矩d= d0+ d1,在外电场强度E作用下产生的能级分裂为?Ee=-d*E,这就是斯塔克效应。
关于类氢原子在强电场中的电离[1],前人有过研究。
方法是分离变量,即恒电场下类氢原子的薛定谔方程在旋转抛物座标下形式上分离变量,得到如下联立常微分方程:联立条件为。
其中,E为能量,Z为原子序,为电场强度,使用原子条件。
零边界条件为,。
在方向,;在方向远端渐进解包含出射波和入射波振幅为零。
氢原子薛定谔方程介绍薛定谔方程是量子力学中的基础方程之一,描述了微观粒子的行为。
在氢原子中,薛定谔方程被广泛应用于描述电子在氢原子中的运动。
本文将深入探讨氢原子薛定谔方程的内容。
氢原子的结构氢原子由一个质子和一个电子组成。
质子带正电荷,电子带负电荷,两者之间形成了一个静电力场。
电子在这个静电力场中运动,其行为可以用薛定谔方程来描述。
薛定谔方程的形式薛定谔方程可以写为:Ĥψ=Eψ其中,Ĥ是哈密顿算符,ψ是波函数,E是能量。
波函数的解释波函数ψ描述了电子在空间中的分布情况。
根据波函数的模的平方|ψ|2,可以得到电子在不同位置上的概率密度分布。
波函数本身是复数,其实部和虚部分别表示了不同的物理量。
分离变量法对于氢原子,可以使用分离变量法来求解薛定谔方程。
假设波函数可以写成一个径向部分和一个角向部分的乘积形式:ψ(r,θ,ϕ)=R(r)⋅Y(θ,ϕ)将波函数代入薛定谔方程,并对两个变量r和θ,ϕ分别进行分离变量,可以得到一系列关于r的径向方程和关于θ,ϕ的角向方程。
径向方程的求解径向方程可以写为:1 r2ddr(r2dRdr)+[2mℏ2(E−e24πε0r)−l(l+1)r2]R=0其中,m是电子的质量,ε0是真空介电常数,l是角量子数。
径向方程的解是球贝塞尔函数和球贝塞尔函数的导数的线性组合。
角向方程的求解角向方程可以写为:1 sinθddθ(sinθdYdθ)+[l(l+1)−m2sin2θ]Y=0其中,m是磁量子数。
角向方程的解是球谐函数。
能级和轨道通过求解径向方程和角向方程,可以得到一系列解。
每个解对应一个能级和一个轨道。
能级是电子的能量,轨道描述了电子在空间中的运动。
数值求解和定态波函数对于复杂的情况,无法通过解析方法得到薛定谔方程的解。
此时可以使用数值方法进行求解,例如使用数值计算软件。
通过数值求解可以得到氢原子的定态波函数。
结论氢原子薛定谔方程是描述氢原子中电子行为的基础方程。
通过求解薛定谔方程,可以得到氢原子的能级和轨道。