第十四章碳族元素
- 格式:doc
- 大小:1.14 MB
- 文档页数:9

![[实用参考]无机化学-碳族元素.ppt](https://uimg.taocdn.com/b8f4c5919ec3d5bbfc0a744d.webp)

第14章碳族元素(碳硅锗锡铅) 碳 1. 甲酸分解:HCOOH浓H2SO4CO↑+H2O2. 碳酸根与铁离子:3CO32-+2Fe3++3H2O=2Fe(OH)3↓+3CO2↑3. 二氧化碳与氨气:CO2+H2O+NH3=NH4HCO34. 2CO2+[Sn(OH)6]2-=Sn(OH)4↓+2HCO3-5. 碳与氧化铅:C+PbO=Pb+CO↑6. 一氧化碳与氧化铅:CO+PbO=Pb+CO2↑7. 草酸分解:H2C2O浓硫酸△CO2↑+CO↑+H2O8. 碳酸钙与盐酸:CaCO3+2HCl=2CaCl2+H2O+CO2↑9. 一氧化碳与氯化亚铜:CO+CuCl+2H2O=Cu(CO)Cl·2H2O10. CO2+K2CO3+H2O=2KHCO311. 碳酸氢钾分解:2KHCO3= CO2↑+K2CO3+H2O12. 碳酸钾与二氧化硫:K2CO3+SO2=K2SO3+CO2↑13. 碳酸钾与硫化氢:K2CO3+H2S=K2S+H2O+CO2↑14. 碳酸钠与盐酸:Na2CO3+2HCl=2NaCl+H2O+CO2↑15. 二氧化碳与氢氧化钙:CO2+Ca(OH)2=CaCO3↓+H2O16. CaCO3+CO2+H2O=Ca(HCO3)217. 碳与氧气:2C+O2=2CO18. 碳与氧气:C+O2=CO219. 一氧化碳与氧气:2CO+O2=2CO220. 碳与氧化锰:C+MnO=Mn+CO21. 一氧化碳与氧化锰:CO+MnO=Mn+CO222. 碳与氧化锌:C+ZnO高温Zn+CO23. 碳与水:C+H2O红热CO+H224. CO+PdCl2+H2O=CO2+2HCl+Pd↓25. CO+CuCl+2H2OH+Cu(CO)Cl·2H2O26. 一氧化碳与铁:5CO+Fe高温[Fe(CO)5]27. 碳酸钙分解:CaCO煅烧CaO+CO2↑28. 2CO32-+H2O+2Mg2+=Mg2(OH)2CO3↓+CO2↑29. HCO32-+Mg2+=MgCO3↓+H+30. 2C+SiO2+2Cl2△SiCl4+2CO31. 3C+3Cl2+B2O3△2BCl3+3CO32. 碳酸钠与二氧化硅:Na2CO3+SiO共融Na2SiO3+CO2↑33. 甲烷分解:CH41000℃C+2H234. 甲烷分解1500℃:2CH41500℃C2H2+3H2硅 1. 硅酸根与铵根:SiO32-+2NH4+=H2SiO3↓+2NH32. 二氧化硅与碳酸钠:SiO2+NaCO3共融Na2SiO3+CO2↑3. 二氧化硅与氟化氢:SiO2+6HF=H2[SiF6]+2H2O4. 甲硅烷分解:SiH4500℃Si+2H2↑5. SiCl4+LiAlH4乙醚SiH4↑+LiCl+AlCl36. SiF4+4H2O=H4SiO4↓+4HFSiF4+2HF=2H++[SiF6]2-7. 甲硅烷自燃:SiH4+2O2自燃SiO2+2H2O8. 四氯化硅与锌:SiCl4+2Zn=Si+2ZnCl29. 硅与氟气:Si+2F2=SiF410. 硅与氢氧根:Si+4OH-=SiO44-+2H2↑11. 3Si+18HF(aq)+4HNO3(浓)=3H2[SiF6]+4NO↑+8H2O12. 二氧化硅与碳:SiO2+2C1800℃Si+2CO↑13. 硅与氯气:Si+2Cl2△SiCl414. 硅与盐酸:Si+3HCl△SiHCl3+H215. SiCl4+2Zn△Si+2ZnCl216. 四氯化硅与氢气:SiCl4+2H2>1100℃Si+4HCl17. SiHCl3+H21100℃Si+3HCl18. 二氧化硅与氟化氢:SiO2+4HF(aq)=SiF4↑+2H2O19. SiO2+6HF(aq)=H2SiF6+2H2O20. 二氧化硅与氢氧根:SiO2+2OH-△SiO32-+H2O21. SiO44-+4H+=H4SiO4↓22. 二氧化硅与镁:SiO2+4Mg高温Mg2Si+2MgO23. 硅化镁与盐酸:Mg2Si+4HCl(aq)=SiH4↑+2MgCl224. 甲硅烷分解:SiH4500℃Si+2H225. SiH4+2O2自燃SiO2+2H2O26. 甲硅烷水解:SiH4+(n+2)H2O=SiO2·nH2O↓+4H227. SiH4+2KMnO4(aq)=2MnO2↓+K2SiO3+H2O+H228. 四氯化硅与水:SiCl4+4H2O=H4SiO4↓+4HCl↑29. SiO2+2C+2Cl2△SiCl4+2CO30. SiF4+4H2O=H4SiO4↓+4HFSiF4+2HF=2H++[SiF6]2-锗 1. 锗与浓硝酸:Ge+4HNO3(浓)=GeO2·H2O↓+4NO2↑+H2O2. 锗与氢气:Ge+2H2700~800℃GeH43. 二硫化锗与硫化钠:GeS2+Na2S(aq)=Na2GeS34. 锗与氢气:Ge+2H高温GeH4锡 1. 锡与浓硝酸:Sn+4HNO3(浓)=H2SnO3(β)↓+4NO2↑+H2O2. 锡与浓盐酸:Sn+2HCl(浓) △SnCl2+H2↑3. 3SnS2+6NaOH(aq)=Na2SnO3+2Na2SnS3+3H2O4. 3[Sn(OH)3]-+2Bi3++9OH-=3[Sn(OH)6]2-+2Bi↓5. 锡与氢氧根:Sn+2OH-+2H2O=[Sn(OH)4]2-+H2↑6. SnCl2+2HgCl2=SnCl4+Hg2Cl27. [Sn(OH)6]2-+2CO2=Sn(OH)4↓+2HCO3-8. 锡与氯气:Sn+2Cl2(g)=SnCl4(l)9. 四氯化锡与硫化钠:SnCl4+2Na2S=SnS2↓+4NaCl10. SnCl2+Na2S=SnS↓+2NaCl11. SnCl2+4NaOH=Na2[Sn(OH)4]+2NaCl12. 3[Sn(OH)4]2-+2Bi3++6OH-=2Bi↓+3[Sn(OH)6]2-13. Sn(OH)Cl+HCl=SnCl2+H2O14. 2Sn2++O2+4H+=2Sn4++2H2O15. Sn4++Sn=2Sn2+16. Na2SnS3+2HCl=SnS2↓+H2S↑+2NaCl17. 3Sn+8HNO3(极稀)=3Sn(NO3)2+2NO↑+4H2O铅 1. 铅与浓硝酸:Pb+4HNO3(浓)=Pb(NO3)2+2NO2↑+2H2O2. 二氧化铅与盐酸:PbO2+4HCl=PbCl2+Cl2↑+2H2O3. 5PbO2+2Mn2++4H+微热5Pb2++2MnO4-+2H2O4. PbCrO4+4NaOH=Na2[Pb(OH)4]+Na2CrO45. 硫化铅与氧气:2PbS+3O2=2PbO+2SO26. 氧化铅与氢氧化钠:PbO+2NaOH=Na2PbO2+H2O7. Na2PbO2+NaClO+H2O=PbO2+NaCl+2NaOH8. 氧化铅与碳:PbO+C=Pb+CO↑9. 氧化铅与一氧化碳:PbO+CO=Pb+CO2↑10. 铅与浓硫酸:Pb+3H2SO4(浓)=Pb(HSO4)2+SO2↑+2H2O11.. 铅与浓盐酸:Pb+3HCl(浓)=H[PbCl3]+H2↑12. 铅与硝酸:3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O13. Pb2++CrO42-=PbCrO4↓14. 2PbCrO4+2H+=2Pb2++Cr2O72-+H2O15. PbCrO4+3OH-=CrO42-+[Pb(OH)3]-16. 铅与稀盐酸:Pb+2HCl(aq)=PbCl2+H2↑17. 铅与氢氧根:Pb+OH-+2H2O=[Pb(OH)3]-+H2↑18. 硫化铅与氧气:2PbS+3O焙烧2PbO+2SO219. 二氯化铅与氯离子:PbCl2+2Cl-=[PbCl4]2-打印下来更方便记忆!。

第十四章 碳族元素Chapter 14 The Carbon Family ElementsCarbon (C) Silicon (Si) Germanium (Ge) Stannum (Sn) Plumbum (Pb)§14-1 碳及其化合物 Carbon and its Compounds一、General Properties1.根据σ键的数目,碳可采取sp 、sp 2、sp 3杂化,其最大配位数为42.由于碳—碳单键的键能特别大,所以C -C 键非常稳定,具有形成均键(homochains)的倾向C -C N -N O -O F -F E (kJ·mol -1) 374 250 210 159 实 例H 3C -CH 3H 2N -NH 2HO -OH从碳到氮的单键键能的突减,是由于N 2分子中氮原子之间非键电子对排斥的缘故。
二、The Simple Substance1.在第二周期中,氟、氧和氮都以双原子分子存在:F 2、O 2和N 2;而碳存在多聚物,其理由为:O 2和N 2的多重键要比σ单键(均键)强得多如: ,E (kJ·mol -1) 494 > 210 + 210 , 946 > 250 + 250而:E (kJ·mol -1) 627 < 374 + 374即C 2分子中的多重键比均链中的两个σ单键之和小,所以碳往往形成多原子均键,虽然在星际空间存在有C 2(g)分子。
2.Allotropes: diamond 、graphite 、fullerene (C 60、C 70)、carbin (carbon fibers) (1) 熵 S carbin >S graphite >S diamond(2) d C-C (nm): diamond > graphite > benzene > ethylene > carbin > acethylene (3) C graphite → C diamond ∆r H m >0,∆r S m <0根据平衡,需要高压Pa 100.1106109⨯-⨯,(because of the insignificantreduction of volume),升高温度不利于平衡的移动,但为了达到该过程可以接受的速率,反应温度大约在2000℃,近来已发明一种低压生产金刚石的方法:把金刚石晶种(seed )放在气态碳氢化合物(甲烷methane ,ethane )中,温度升高到1000℃,可以得到金刚石粉末或者crystal whiskers(4) C 60由12个正五边形和20个正六边形组成,每个碳原子以sp 3、sp 2杂化轨道与相邻的三个碳原子相连,使∠CCC 小于120︒而大于109︒28',形成曲面,剩余的p 轨道在C 60球壳的外围和内腔形成球面π键,从而具有芳香性。



碳族元素教学目标知识技能:掌握碳元素原子结构特点:能推断出碳族元素单质及化合物性质的变化规律;加深对典型碳元素单质及其化合物的化学性质的理解。
能力培养:比较碳族元素与卤素、氧族元素、氮族元素性质的相似性和递变性以及对碳及其合物化学性质讨论,培养学生抽象概括形成规律性认识的能力。
通过实验培养学生观察能力、思维能力。
使学生掌握非金属元素单质及其化合物性质的学习方法。
科学思想:通过对弱酸的酸式盐化学性质的讨论,对学生进行辩证唯物主义教育。
科学品质:组织讨论,激发学生求知欲,体验学习乐趣。
科学方法:观察、实验和科学抽象。
重点、难点重点:碳族元素性质的递变规律。
碳及其化合物的化学性质。
难点:碳酸的酸式盐与强酸和强碱的反应。
附1:碳金刚石:首饰、切割工具。
石墨:铅笔芯、润滑剂、电极。
化合物:甲烷、酒精、醋酸、汽油、碳素纤维硅硅单质:微电子技术:微型计算机、微处理机。
太阳能电池:性能稳定、效率高、体积小、重量轻(美国太空实验室装有4块太阳能电池帆板,功率12KW。
)二氧化硅:光导纤维之父——高锟(华裔),1964年8月提出用玻璃纤维代替金属导线。
硅酸盐:各种陶瓷,坚硬:刀具、轴承。
耐热:制汽车轮机、发动机的涡轮。
化学性质稳定:制人工牙齿、骨骼。
有机硅化物;硅油,极好的流动性和粘度受温度变化影响小,是高温或高寒环境的良好的润滑剂。
其无毒、无味,糕点模子抹一次硅油可连续使用1000次。
弹性硅胶:重建关节、耳朵、鼻子、乳房。
附4:随堂检测答案1.SiH4 2.HNO3 H3PO4 H3CO3 H2SiO3 3.1:3北京市第80中学吴卫东。


第十四章 碳族元素Chapter 14 The Carbon Family ElementsCarbon (C) Silicon (Si) Germanium (Ge) Stannum (Sn) Plumbum (Pb)§14-1 碳及其化合物 Carbon and its Compounds一、General Properties1.根据σ键的数目,碳可采取sp 、sp 2、sp 3杂化,其最大配位数为42.由于碳—碳单键的键能特别大,所以C -C 键非常稳定,具有形成均键(homochains)的倾向C -C N -N O -O F -F E (kJ·mol -1) 374 250 210 159 实 例H 3C -CH 3H 2N -NH 2HO -OH从碳到氮的单键键能的突减,是由于N 2分子中氮原子之间非键电子对排斥的缘故。
二、The Simple Substance1.在第二周期中,氟、氧和氮都以双原子分子存在:F 2、O 2和N 2;而碳存在多聚物,其理由为:O 2和N 2的多重键要比σ单键(均键)强得多如: ,E (kJ·mol -1) 494 > 210 + 210 , 946 > 250 + 250而:E (kJ·mol -1) 627 < 374 + 374即C 2分子中的多重键比均链中的两个σ单键之和小,所以碳往往形成多原子均键,虽然在星际空间存在有C 2(g)分子。
2.Allotropes: diamond 、graphite 、fullerene (C 60、C 70)、carbin (carbon fibers) (1) 熵 S carbin >S graphite >S diamond(2) d C-C (nm): diamond > graphite > benzene > ethylene > carbin > acethylene (3) C graphite → C diamond ∆r H m >0,∆r S m <0根据平衡,需要高压Pa 100.1106109⨯-⨯,(because of the insignificantreduction of volume),升高温度不利于平衡的移动,但为了达到该过程可以接受的速率,反应温度大约在2000℃,近来已发明一种低压生产金刚石的方法:把金刚石晶种(seed )放在气态碳氢化合物(甲烷methane ,ethane )中,温度升高到1000℃,可以得到金刚石粉末或者crystal whiskers(4) C 60由12个正五边形和20个正六边形组成,每个碳原子以sp 3、sp 2杂化轨道与相邻的三个碳原子相连,使∠CCC 小于120︒而大于109︒28',形成曲面,剩余的p 轨道在C 60球壳的外围和内腔形成球面π键,从而具有芳香性。
O O N N N N N C C C C C O O O欧拉方程:面数(F) + 顶点数(V) = 棱数(E) + 2a.structure:根据欧拉定理,通过12个正五边形和数个正六边形的连接可以形成封闭的多面体结构:C60为第一个五边形间互不相邻的封闭笼状结构,C70为第二个五边形间互不相邻的封闭笼状结构,两个五边形相邻的最小碳笼为C50,三个五边形相邻的最小碳笼为C28,不存在六边形的最小碳笼为C20。
b.properties:科学家认为C60将是21世纪的重要材料(i) C60分子具有球形的芳香性,可以合成C60F n,作为超级润滑剂。
(ii) C60笼内可以填入金属原子而形成超原子分子,作为新型催化剂或催化剂载体,具有超导性,掺K的C60,T c = 18K,Rb3C60T c = 29K,它们是三维超导体。
(iii) C60晶体有金属光泽,其微晶体粉末呈黄色,易溶于苯,其苯溶液呈紫红色。
C60分子特别稳定,进行化学反应时,C60始终是一个整体。
三、The Compounds1.[ - 4 ]O.S. covalent CH4, ionic-covalent Al4C3, metallic MC、M2C、M3C 水解性(或与水反应):Al4C3 + 12H2O4Al(OH)3 + 3CH4↑CaC2 + 2H2O Ca(OH)2 + C2H2↑20% HfC和80%TaC合金是已知物质中熔点最高的(m.p. = 4400℃)2.[ + 4 ]O.S.(1) CHal4a.preparation:CS2 + 2Cl2CCl4 + S2Cl2b.properties:hydrolysis CHal4 + 2H2O(g)CO2(g) + 4HHal(g)从热力学上看是可行的:CF4(∆r G m = -150kJ·mol-1),CCl4(∆r G m = -250kJ·mol-1)它们之所以不能水解是由于在通常条件下缺乏动力学因素,碳的配位数已饱和,不能与水分子结合。
从CF4→CI4随着键长的增大,键的强度减弱,稳定性减弱,活泼性增强(2) COHal2(卤氧化碳,也称为碳酰卤 carbonyl halides):所有的COHal2比CHal4的化学性质活泼,特别是它们易水解:COCl2 + H2O CO2 + 2HCl 它们都有极性,都是平面三角形。
COCl2 (光气 phosgene) 是剧毒的光气的制备:CO + Cl2COCl2(3) CS2(carbon disulfide)a.preparation(i) C + 2S900℃CS2CS2 + 2H2S(ii) 4S(g) + CH4(g)600℃Al2O3或硅胶b.propertiesCS2是易挥发、易燃的无色的有机溶剂明显水解:CS2 + 2H2O CO2 + 2H2S与碱性硫化物反应:Na2S + CS2Na2CS3(4) -23CO 、-23CS 、-22CNa .structure :642 ] [∏- 642 ] [∏- [N =C =N]2-2个43∏sp 2杂化 sp 2杂化 sp 杂化 b .properties(i) 碳酸盐:正盐中除碱金属(不包括Li +)、铵及Tl + 盐外,都难溶于水,许多金属的酸式盐的溶解度大于正盐,但3NaHCO S <32CO Na S 。
解释:这是由于在NaHCO 3溶液中-3HCO 从氢键相连成二聚离子,降低了它们的溶解度: --−→−23] [HCO 2热稳定性:H 2CO 3<MHCO 3<M 2CO 2 (ii) 硫代碳酸盐(thiocarbonate )22CS S K +32H 32CS H CS K −→−+H 2CS 3是高折射率油状物,易分解成H 2S 和CS 2H 2CS 3的水溶液为弱酸,在水中缓慢分解: H 2CS 3 + 3H 2OH 2CO 3 + 3H 2S(iii) 氨基腈化物(cyanamide )-22CN (氮代碳酸盐)CaC 2 + N 2~1100℃CaCN 2 + CH 2CN 2(Hydrogen dinitride carbonate )是无色晶体,易溶于水、alcohol 和ether ,显示弱酸性,在有机溶剂中可能存在互变异构(tautomerism )平衡:H N C N HHN HC NH 2CN 2在水中缓慢分解:H 2CN 2 + 3H 2O H 2CO 3 + 2NH 3 CaCN 2 + 3H 2OCaCO 3 + 2NH 322223l 3H CN ()(H CN )−−−→聚合3.[ +2 ]O.S. HCOOH浓H 2SO 4CO + H 2OCO (carbon monoxide )结构式:CO ,使μ减小 μ = 0.112D CO + PdCl 2 + H 2O Pd + CO 2 + 2HCl+23)Cu(NH 可以吸收CO ,所以CO 比N 2活泼O C OC O HOOCNCN CN NH 2NH 2H 2N§14-2 硅及其化合物 Silicon and its Compounds一、General Properties1.由于Si 的原子半径大、电离能低、电子亲合能和极化率高,因此Si 在化学性质上与碳有许多不同之处。
例如Si 和Si 之间基本上不形成p π-p π键,换言之,Si 的sp 或sp 2杂化不稳定。
2.由于Si 原子的价轨道存在3d 空轨道,所以Si 原子的最大配位数可以达到6,可以形成d -p π键,例如N(SiH 3)3中N 原子采取sp 2杂化,分子为平面三角形。
这是由于N 原子上的孤对电子对占有Si 原子的3d 空轨道,形成d -p π键所致。
显然N(CH 3)3与N(SiH 3)3的碱性也不同,前者的Lewis 碱性大于后者。
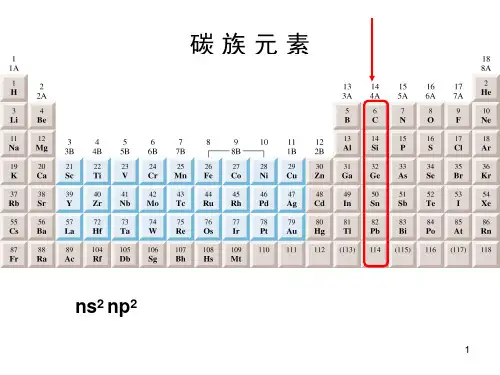
3.Si 在自然界中占第二位,仅次于氧。
About half the earth’s crust consists of silica (SiO 2)and silicate, aluminosilicate rocks.二、The Simple Substance1.Properties(1) 在通常情况下,硅非常惰性,但加热时与许多非金属单质化合,还能与某些金属反应⎪⎩⎪⎨⎧−−−−−→−−−−−−→−⎪⎭⎪⎬⎫−−−−−←−−−−−←︒︒︒︒2O C 6004Cl C 400N C 100043C C 2000SiO SiCl Si N Si SiC 322 2Mg + Si Mg 2Si(2) 硅遇到氧化性的酸发生钝化性(passivation),它可溶于HF -HNO 3的混合酸中3Si + 4HNO 3 + 18HF3H 2SiF 6 + 4NO + 8H 2O硅与氢氟酸反应:Si + 4HFSiF 4 + 2H 2,SiF 4 + 2HFH 2SiF 6(3) 硅溶于碱并放出H 2:Si + 2KOH + H 2O K 2SiO 3 + 2H 2↑ (4) 硅在高温下与水蒸气反应:Si + 2H 2O(g) H 2SiO 3 + 2H 22.Preparation: (1) SiCl 4 + 2ZnSi + 2ZnCl 2(2)SiO 2和C 混合,在电炉中加热:SiO 2(s) + 2C(s) 电炉Si(s) + 2CO(g)↑(3) SiO 2 + CaC 2Si + Ca + 2CO(4) 硅烷的分解:SiH4Si + 2H 2用作半导体用的超纯硅(super pure silicon ),需用区域熔融(zone melting )的方法提纯。
三、The Compounds1.[ - 4 ] O.S. 硅化物(silicides )(1) IA 、IIA 族硅化物:Ca 2Si 、CaSi 、CaSi 2不稳定,与水反应(2) 副族元素硅化物:Mo 3Si 、Mo 5Si 3、MoSi 、MoSi 2(2050℃)高熔、沸点,不溶于HF 和王水,仅溶于HF -HNO 3混合液或者在碱液中WSi 2(2165℃),Ti 5Si 3(2120℃),V 5Si 3(2150℃),f 元素的硅化物在反应堆中吸收中子。