碳族元素性质
- 格式:doc
- 大小:291.00 KB
- 文档页数:17

碳族元素知识点总结碳族元素是元素周期表中的第14组元素,包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)和铅(Pb)。
碳族元素具有许多重要的化学和物理性质,对于我们的日常生活和工业发展具有重要意义。
以下是关于碳族元素的几个主要知识点的总结:1.原子结构和电子配置:碳族元素位于周期表的p区,外层电子结构为ns2np2、碳原子的电子配置为1s2 2s2 2p2、在碳族元素中,碳和硅是典型的非金属,锗是半金属,锡是过渡金属,铅是主族金属。
2.原子半径和离子半径:碳族元素的原子半径有增大的趋势。
这是因为随着原子序数的增加,电子层的数量也增加,电子屏蔽效应增强,从而使得原子半径增加。
在同一族元素中,离子半径随着正电荷数的增加而减小。
3.化学反应性:碳族元素的化学反应性有较大差异。
碳和硅都是非金属,具有较高的电负性。
它们能够形成多种化合价的化合物,如碳的四价化合物和硅的四价和六价化合物。
锡和铅具有特殊的价态行为,可以形成多种化合价的化合物。
锡和铅通常表现出二郎功能。
4.晶体结构和物理性质:碳族元素的晶体结构和物理性质有明显的变化。
碳以钻石、石墨和富勒烯等多种晶体结构存在。
钻石具有非常高的硬度,石墨具有良好的导电性和润滑性,富勒烯则具有独特的球形结构。
硅具有金刚石样的晶体结构,可以形成多种晶体相。
锡和铅以金属晶体结构存在,具有良好的导电性和可塑性。
5.化合物和应用:碳族元素形成了众多的化合物,具有重要的应用价值。
最重要的化合物是碳的氧化物,如二氧化碳和一氧化碳。
二氧化碳在大气中起到重要的温室效应,一氧化碳是一种有毒气体。
锗和硅的氧化物是重要的半导体材料。
锡和铅的氧化物具有良好的导电性和光学性能,常用于制备导电玻璃和陶瓷材料。
此外,锡和铅还广泛用于合金制备和防腐剂。
6.生物学意义:碳族元素在生物学中具有重要的意义。
生命体中含有大量的碳和硅。
碳是有机物的组成要素,是地球上生物多样性的基础。
硅在植物细胞壁和一些动物骨骼中起到结构支持的作用。

碳族元素及其化合物碳族元素通性1、原子结构性质相似性:最外层电子构型:ns²np²气态氢化物的通式:RH4最高价氧化物对应的水化物通式为H2RO3或R(OH)4递变性+2价化合物主要氧化态稳定性:由上至下逐渐增强+4价化合物主要氧化态稳定性:由上至下逐渐减弱铅(Ⅱ)化合物稳定性高于铅(Ⅳ),铅(Ⅳ)本身为强氧化剂。
熔沸点降低(锡和铅反常),单质密度逐渐增大金属性增强,非金属性减弱,(由于半径不断增大,原子核对外层电子引力变小所致)最高价氧化物对应水化物的酸性减弱氢化物的稳定性减弱第一电离能:由碳至铅逐渐减小(同主族由上至下半径增大,更易失去最外层电子) 特殊:锡<铅熔沸点:由碳至铅逐渐减小(碳、硅为原子晶体,锗、锡、铅为金属晶体)二、元素的成键特性⒈碳:①共价键(sp:CO sp²:乙烯sp³:甲烷):碳碳,碳氢,碳氧键键能大,稳定,因此碳氢氧可形成多种有机化合物。
②以碳酸盐的形式存在于自然界中2.硅:①硅氧四面体形式存在(石英,硅酸盐矿)②硅硅,硅氧,硅氢键较弱,可形成有机化合物但数量较少3.锡铅:①离子键(+2氧化态,SnO、PbO +4氧化态,SnCl4)②共价键(+4氧化态,SnO、PbO2)碳及其化合物1.单质(三种同素异形体)①金刚石:结构:sp³杂化,原子晶体,五个碳原子构成正四面体性质:硬度最大,熔沸点很高(由于其为空间网状结构),无色透明,不导电,化学惰性,但800°C以上与空气反应成CO2②石墨:结构:sp²杂化,层状原子晶体,每层上的碳原子各提供一个含成单电子的p轨道形成大π键层与层之间靠分子见作用力结合在一起。
性质: 灰黑色,硬度小,熔沸点低于金刚石;化学惰性,500°C可被空气氧化成CO2,也可被浓热HClO4氧化成CO27C+4HClO4=2H2O+2Cl2↑+7CO2↑良好导电性(因为每个碳原子均为sp2杂化,并贡献剩余一个p轨道上的电子形成大π键,π电子可以自由移动)润滑剂(同一层晶面上碳原子间通过共价键结合,层与层之间以分子间作用力结合,由于层与层之间的作用力很小,故很容易在层间发生相对滑动。
碳族元素1、碳族元素的通性碳原子结构及特性碳族元素中,碳、硅是非金属,其余三种是金属,由于硅、锗的金属性和非金属性均不强,也有人称其为“准金属”。
碳族元素的外层电子构型为 ns 2np2碳族元素的基本性质碳族元素的电负性大,要失去价电子层上的 1-2 个 p 电子成为正离子是困难,它们倾向于将 s 电子激发到 p 轨道而形成较多的共价键,所以碳和硅的常见氧化态为+IV。
第一电离能在同组元素中,由上而下随着原子半径的增大,电离能减小,元素的金属性依次增强。
电子亲和能在同族元素中,自上而下原子半径逐渐增大,原子核对外来电子的吸引力逐渐减弱,自上而下,电子亲和能呈减小趋势。
可能是 Sn 的原子半径相对较小,外层电子云的密度小,对外来一个电子的排斥作用反而比 Ge 大,因而得到一个电子放出的的能量较大。
金刚石,晶体硅都为原子晶体,锗、锡、铅都为金属晶体。
碳元素的性质碳的成键特征①以 sp、sp2、sp3 三种杂化态与 H、O、Cl、N 等非金属原子形成共价化合物, C—C、 C—H、 C—O 键的键能分别为 331 KJ·m ol-1、415 KJ·mol-1、343 KJ·mol-1, 键能越大,稳定性越高。
因此,C、H、O 三种能形成数百万种的有机化合物,其中碳的氧化数从+4 变到-4②以碳酸盐的形式存在。
硅的成键特征①以硅氧四面体的形式存在,如石英和硅酸盐矿中。
②Si—Si、Si—H、Si—O 键的键能分别为197 KJ·mol-1、320 KJ·mol-1、386 KJ·mol-1,除 Si—O 键,前两者的键能分别小于C—C、C—H,因此 Si、H、 O 虽可以形成一些类似于 C、H、O 形成的有机物,但数量有限碳和硅可以用 sp、sp2和 sp3杂化轨道形成 1 到 4 个σ键,但 Si sp 和 sp2态不稳 sp、定。
碳的原子半径小,还能形成pπ—pπ键,所以碳能形成多重键碳的原子半径小,锡铅的成键特征①以+2 氧化态的形式存在于离子化合物中②以+4 氧化态的形式存在于共价化合物和少数离子型化合物中。

高中化学碳和硅的知识点介绍(一)碳族元素1、组成和结构特点(1)碳族元素包括碳、硅、锗、锡、铅五种元素,位于元素周期表的IVA族。
(2)碳族元素原子最外层有4个电子,在化学反应中不易得到或失去电子,易形成共价键。
主要化合价有+2和+4价,其中碳和硅有负价。
碳族元素在化合物中多以+4价稳定,而铅在化合物中则以+2价稳定。
碳族元素中碳元素形成的单质(金刚石)硬度最大;碳元素形成的化合物种类最多;在所有非金属形成的气态氢化物中,CH4中氢元素的质量分数最大;12C是元素相对原子质量的标准原子;硅在地壳中的含量仅次于氧,其单质晶体是一种良好的半导体材料。
2、性质的递变规律随着原子序数的增大,碳族元素的原子半径依次增大,由非金属元素逐渐转变为金属元素,即金属性逐渐增强,非金属性逐渐减弱;最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强;气态氢化物的稳定性逐渐减弱,还原性逐渐增强。
(二)碳及其化合物1、碳单质(1)碳的同素异形体金刚石石墨足球烯晶体类型原子晶体过渡性晶体分子晶体微粒间作用力共价键层内共价键,层间范德华力范德华力熔沸点很高很高低溶解性一般不溶难溶易溶于有机溶剂硬度最大质软很小导电性不导电导电不导电(2)碳的化学性质常温下碳的性质稳定,在加热、高温或点燃时常表现出还原性,做还原剂,温度越高,还原性越强,高温时的氧化产物一般为一氧化碳。
溶解性不同:一般情况下,所有的钾盐、钠盐和铵盐是可溶的,所有的酸式盐是可溶的,正盐的溶解度小于酸式盐的溶解度,但碳酸钠的溶解度大于碳酸氢钠的溶解度。
热稳定性不同:一般情况下,难溶的正盐和酸式盐受热易分解,可溶性碳酸盐稳定不易分解。
与酸反应的剧烈程度不同:两者都能与强酸(H+)反应产生CO2,但反应的剧烈程度不同,根据反应的剧烈程度可鉴别两者。
可溶性盐的水解程度不同:相同浓度的正盐溶液的pH值大于酸式盐溶液的pH值。
与碱反应不同:弱酸的酸式盐可与碱反应生成正盐。
与盐反应不同:碳酸钠可与氯化钙或氯化钡反应生成难溶性碳酸盐,但碳酸氢钠不反应。

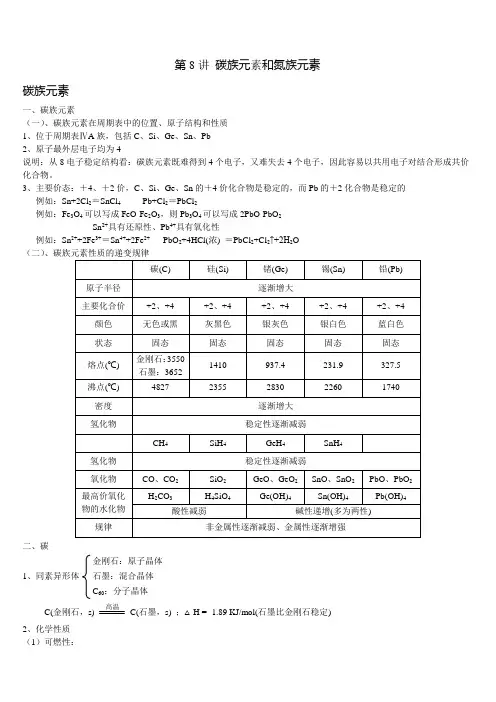
第8讲碳族元素和氮族元素碳族元素一、碳族元素(一)、碳族元素在周期表中的位置、原子结构和性质1、位于周期表ⅣA族,包括C、Si、Ge、Sn、Pb2、原子最外层电子均为4说明:从8电子稳定结构看:碳族元素既难得到4个电子,又难失去4个电子,因此容易以共用电子对结合形成共价化合物。
3、主要价态:+4、+2价,C、Si、Ge、Sn的+4价化合物是稳定的,而Pb的+2化合物是稳定的例如:Sn+2Cl2=SnCl4Pb+Cl2=PbCl2例如:Fe3O4可以写成FeO·Fe2O3,则Pb3O4可以写成2PbO·PbO2Sn2+具有还原性、Pb4+具有氧化性例如:Sn2++2Fe3+=Sn4++2Fe2+PbO2+4HCl(浓) =PbCl2+Cl2↑+2H2O(二)二、碳金刚石:原子晶体1、同素异形体石墨:混合晶体C60:分子晶体C(金刚石,s) 高温C(石墨,s) ;△H = -1.89 KJ/mol(石墨比金刚石稳定)2、化学性质(1)可燃性:C + O2点燃CO2 (O2足量) 2C + O2点燃2CO (O2不足) (2)还原性:C + 2CuO △2Cu + CO2 C + H2O 高温CO + H2(水煤气)CaO + 3C 通电CaC2 + CO↑(电石的制法)(3)与氧化性酸反应C + 2H2SO4(浓) △CO2↑+ 2SO2↑+ 2H2OC +4HNO3(浓)△CO2↑+4NO2↑+2H2O三、碳的化合物(一)CO的性质1、物理性质:无色无味气体,剧毒难溶于水。
中性氧化物(不成盐氧化物)2、化学性质(1)可燃性:2CO + O2点燃2CO2(用点燃的方法除去CO)(2)还原性:Fe2O3+3CO △+3CO2(炼铁)CuO+CO △Cu+CO2(除CO)CO+H2O 高温CO2+H2(工业上用于制H2)(3)毒性:CO能于人体中血红蛋白结合,使血红蛋白失去携氧的能力,使人缺氧死亡。


高中化学关于炭族元素的知识点详解1. 碳族元素性质的相似性和递变性:(1)相似性① 碳族元素原子结构最外层都为4个电子,C、Si为非金属元素,Ge、Sn、Pb为金属元素。
② 正价为4,负价为-4。
③ 非金属元素可形成气态氢化物RH4④ 非金属元素价氧化物对应的水化物为H2RO3,其水溶液呈酸性;金属元素低价氧化物对应水化物为、具两性偏碱性。
2. 碳单质(C)碳元素价态变化及重要物质:碳的同素异形体有金刚石和石墨两种。
(1)金刚石和石墨的晶体结构:金刚石晶体里,每个碳原子都处于四个碳原子的中心,以共价键跟四个碳原子结合成正四面体结构,正四面体结构向空间发展,构成一个空间网状晶体,为原子晶体。
石墨晶体是层状结构,每层内的碳原子排列成六边形,一个个六边形排列成平面网状结构,同一层内,相邻的碳原子以非极性共价键结合,层与层以范德华力相结合,因层与层之间易滑动,质软。
石墨晶体为层状晶体(看作混合型晶体)。
(2)物理性质:金刚石和石墨物理性质有较大差异。
(3)化学性质:碳单质常温下性质很稳定,碳的性质随温度升高,活性增大。
碳的同素异形体化学性质相似。
① 可燃性:在充足空气中燃烧C O2(足) 2CO② 高温下,与氢、硫、硅等发生化合反应:C+2S CS2(C表现还原性)C+Si SiC(C表现弱氧化性)C+2H2 CH4(C表现弱氧化性)③ 高温下,与钙、铁、铝、硅的氧化物发生反应,生成碳化物或还原出金属单质。
CaO+3C CaC2+CO(电石)CuO+C Cu+COSiO2+2C Si+2COFe2O3+3C 2Fe+3CO④ 高温下,与水蒸汽发生反应,⑤ 与氧化性酸发生反应:C 4HNO3(浓) CO2↑ 2SO2↑ 2H2O3. 二氧化碳(CO2)属于酸性氧化物,即为碳酸酸酐。
(1)分子组成和结构:二氧化碳分子是由两个氧原子和一个碳原子通过极性共价键结合成直线型的非极性分子;固态时为分子晶体。
(2)物理性质:二氧化碳是无色、无嗅的气体,密度比空气大,加压和降温下变为雪状固体叫干冰,若在压强为101帕,温度℃时,干冰可升华成气体;CO2可溶于水(通常状况下1:1)。


碳族元素碳及其化合物碳族元素是指位于元素周期表第14族的元素,包括碳(C),硅(Si),锗(Ge),锡(Sn)和铅(Pb)。
碳族元素在自然界中广泛存在,具有重要的地球化学和生物化学意义。
碳是最为重要的碳族元素,因为它是生命的基础,能形成无数种具有复杂结构的有机化合物。
1.碳的性质碳是一种非金属元素,具有原子序数6和相对原子质量12.01、它的外层电子构型为2s22p2,因此能形成四个共价键。
碳具有非常高的熔点和沸点,以及很高的硬度。
它可以形成纯净的晶体结构,比如钻石和石墨。
2.碳的化合物碳可以与其他元素形成大量的化合物,包括有机化合物和无机化合物。
有机化合物是以碳为主要成分的化合物,它们在自然界和生命体系中广泛存在。
有机化合物包括烷烃、烯烃、炔烃、醇、酮、酸、酯等等。
无机化合物则是碳与非金属元素和金属元素形成的化合物,比如一氧化碳(CO)、二氧化碳(CO2)和碳酸盐。
3.碳的地球化学意义碳是地球上最常见的元素之一,它在地壳中的储量很大。
地球上大部分的有机物质也含有碳,包括化石燃料、生物质和土壤有机质。
碳的循环在地球上起着重要的作用,包括碳的释放和吸收过程。
人类活动导致大量的碳排放,加速了全球变暖和气候变化。
4.碳在生物化学中的作用碳是生命体系中最为重要的元素,它构成了所有有机化合物,包括蛋白质、核酸、脂质和碳水化合物。
这些化合物在生物机体的结构和功能中起着重要的作用。
碳还参与能量代谢过程中的碳循环,包括光合作用和细胞呼吸。
5.碳的应用由于碳形成的有机化合物种类繁多,碳化合物在工业和生活中有广泛的应用。
有机化合物被用于制造塑料、橡胶、纤维和药物等。
碳纳米管和石墨烯等碳材料也具有重要的应用潜力,可用于电子器件、储能材料和生物传感器等。
此外,碳的同位素碳-14也被广泛应用于射击物体的定年和环境探测。
总结:碳族元素是地球上最重要的元素之一,在地球化学和生物化学中起着关键的作用。
碳的化合物形式多样,有机化合物是生命体系中的基本组成部分。

摘要本文简单粗略地介绍了Ⅳ主族,即碳族元素的基本通性,并对其中的碳元素和硅元素进行展开,分析了它们的单质,各类化合物的性质与制备方法,并揭示了它们在现实生活、工业等各个领域的用途及应用前景。
最后对碳、硅元素之间的异同作了进一步的阐述。
希望通过本文能够更深入地了解有关碳元素、硅元素以及碳族元素的扩展知识。
关键词:金刚石、石墨、富勒烯、碳纳米管、超导材料、沸石分子筛、半导体、高温结构陶瓷、纤维一.碳族元素的通性碳族元素是Ⅳ族元素,包括碳(carbon C)、硅(silicon Si)、锗(germanium Ge)、锡(tin Sn)、铅(lead Pb)、五个元素。
碳和硅是非金属元素,其余三种是金属元素。
本族元素基态原子的价电子结构为ns2np2。
碳和硅主要形成共价化合物,常见的氧化态为+4。
由于C-C单键的键能比C-H、C-O的键能低,所以含C-C键的化合物大量存在。
碳原子还有较强的形成多重键的倾向。
与碳相比,硅生成多重键的倾向明显减弱,在绝大多数化合物中硅原子常以sp3杂化形成4个单键,由于Si-O键能比Si-Si键能多,所以硅是亲氧元素。
随着本族元素原子序数的递增,过渡到第六周期元素铅时,由于原子核中有充满的4f亚层,有集中增强的核电场,加强了6s电子的穿透性,使6s能级显著降低,6s电子较不易成键,这就是所谓的“惰性电子对”。
因此,在锗、锡、铅中,随着元素原子序数的增大,稳定氧化态由+4变为+2。
+2氧化态的锗有很强的还原性,而+2氧化态的锡和铅离子在极性溶液中存在,+4氧化态的铅为强氧化剂。
碳和硅在自然界中分布很广,其中硅在地壳中的含量仅次于氧,锗的分布很分散,锡和铅矿藏较集中,易提炼。
锡在自然界中主要的矿石是锡石SnO2,我国有丰富的铅资源。
铅的主要矿石是方铅矿PbS。
碳族元素的单质都有十分重要的应用。
例如,高纯度的硅和锗是良好的半导体材料,在电子工业中用来制造各种半导体元件,锡和铅可用于制造合金,铅还可以作核反应推的防护屏等。
化一200900111143 杨晓碳族元素碳族元素碳族元素位于元素周期表中ⅣA族,包括碳(C)、硅(Si)、锗(Ge,分散元素)、锡(Sn)、铅(Pb)五种元素。
其中,碳、硅是非金属,其余三种是金属,由于硅、锗的金属性与非金属性均不强,也有人称其为准金属。
一、碳族元素的通性1、碳族元素在自然界中的分布:碳在自然界中主要以煤、石油、天然气、动植物等有机物存在,无机物矿藏主要有石灰石CaCO3、大理石CaCO3、白云石CaCO3·MgCO3、菱镁矿MgCO3等,空气中存在约0.03%(体积比)的CO2。
碳在地壳中的质量含量为0.027%。
碳主要有12C、13C、14C三种同位素,前两种的丰富度分别为98.892%和1.108%。
硅在地壳中的质量分数为28.2%,主要以硅酸盐的形式存在于土壤和泥沙中,自然界中也存在石英矿。
锗、锡、铅在地壳中的质量分数分别为0.0005%、0.0002%、0.0013%,主要以硫化物和氧化物的形式存在,其中锗、锡、以二氧化物存在,铅以硫化物居多。
2、元素结构与性质:3、元素的成键特征:⑴碳的成键特征①采取等性sp3杂化,形成4个共价单键。
如:CH4、金刚石等。
②采取等性sp2杂化,形成3个σ键和1个π键(或离域π键)。
如:石墨,COCl2等。
③ 采取等性sp 杂化,形成2个σ键和2个π键(或离域π键)。
如:CO 2、C 2H 2等。
④ 采取不等性sp 杂化,形成1个σ键和2个π键。
如:HCN 、CO 等。
⑤ 形成配位键。
如:CO 中有π配位键;Fe (CO )5中有σ配位键。
⑵ 硅的成键特征① 采取等性sp 3杂化,形成4个共价单键。
如:Si 4、SiCl 4等。
② 采取sp 3d 2杂化,形成六个共价单键。
如:SiF 62-等。
③ 形成配位键。
如:SiF 62-中有2个σ配位键。
Si-Si 、Si-H 、Si-O 键的键能分别为197kJ ·mol -1、320 kJ ·mol -1、368 kJ ·mol -1,除Si-O 键外前两者的键能分别小于C-C 键和C-H 键,因此,Si 、H 、O 可以形成一些类似于C 、H 、O 形成的有机物,但数量有限。
碳族元素1.碳族元素(1)碳族元素的特征在元素周期表中,碳族元素处在从活泼金属(IA)向活泼非金属(ⅦA)过渡的中间位置,其最外层电子数为4,既不容易失去电子,又不容易得到电子,所以碳族元素的成键特点是易形成共价键,难形成离子键。
这一特点以碳、硅最为典型,碳族元素从非金属性向金属性递变最为明显,是元素周期律和物质结构理论的典型体现。
碳族元素形成的非金属单质为原子晶体,在同周期中硬度最大(石墨例外),熔沸点最高(如金刚石、晶体硅)。
硅在地壳中含量仅次于氧,晶体硅是一种良好的半导体材料。
(2)碳族元素的化合价碳族元素的主要化合价有+2、+4,其中铅+2价稳定,其余元素+4价稳定。
价态的稳定与否,能很好地帮助我们判断物质的氧化性、还原性及稳定性。
如铅的+2价稳定,则铅的+4价的化合物不稳定。
易在氧化还原反应中生成稳定价态的+2价化合物而表现出强的氧化性;又如CO中的碳为+2价,而其+4价更稳定,则CO不如CO2稳定而有较强的还原性。
(3)碳族元素的性质及递变规律在元素周期表中,碳族元素位于活泼金属向活泼非金属过渡的中间位置,其最外层电子数为4,在性质相似的同时,从上到下电子层数增多,原子半径增大,原子核对最外层电子的吸引能力减弱,失电子的能力增强,从上到下由非金属递变为金属的变化非常典型,即由C→Pb,元素的非金属性逐渐减弱、金属性逐渐增强。
其中碳、硅是非金属,锗是半导体材料,锡、铅是金属。
碳族元素,随着原子序数逐渐增大,非金属性逐渐减弱,气态氢化物的稳定性逐渐减弱,最高价氧化物对应水化物的酸性逐渐减弱。
气态氢化物的稳定性:CH4>SiH4>GeH4最高价氧化物对应水化物的酸性:H2CO3>H2SiO3>H4GeO4(4)碳族元素在自然界里的存在在自然界里,碳的存在形式有游离态和化合态两种;硅在地壳上主要以硅酸盐矿石的形式存在;锗是不常见的金属;锡和铅两种金属都以化合态的形式存在。
(5)单质的性质:碳族元素的单质在室温下都是固体、颜色各不相同。
碳族元素知识点总结碳族元素的化学性质碳族元素的化学性质主要表现为它们的共价化合物。
由于这些元素外层电子结构的相似性,它们通常都具有4个价电子。
因此,这些元素可以形成类似的共价键结构,比如碳的四价、硅的四价等。
碳族元素共有6个电子,其中4个价电子。
另外2个电子则位于轨道的内层能级。
碳族元素形成的共价化合物具有一些共同的特点。
首先,它们的共价化合物通常是非极性分子,具有较强的共价键而不具有明显的电性差异。
其次,这些元素形成的化合物多为四配位结构,如CH4、SiH4、GeH4等。
此外,由于这些元素的大部分化合物都是非金属,因此它们的氧化状态多为正的。
碳族元素的物理性质碳族元素的物理性质也有很多共同之处。
首先,这些元素在常温下大多呈非金属性质,如碳为固体,硅为固体,锗为固体,锡为固液混合体,铅为液体。
此外,碳族元素的硬度逐渐增加,从碳的较硬的金刚石到锡、铅的较软的性质。
另外,碳族元素的密度也逐渐增加,从碳的2.26g/cm³到铅的11.34g/cm³。
此外,这些元素的熔点和沸点也随着原子序数的增加而增加,硅的熔点为1414℃,铅的熔点为327.5℃。
碳族元素的地球化学意义碳族元素具有重要的地球化学意义。
首先,碳族元素在地壳中广泛分布,如硅占地壳质量的27%。
其次,碳族元素在地球的物质循环中起着重要作用,如碳的存在形式有石墨、石英、石英等。
此外,碳族元素还是地壳中一些矿物的主要成分,如石英、硅铁矿等。
除了在地壳中的分布之外,碳族元素还在地球的化学演化中发挥重要作用。
如碳的生物地球化学循环和碳酸盐的形成等。
此外,碳族元素还在地球的构造和动力地质学过程中发挥着重要作用。
碳族元素的应用碳族元素在工业上有着重要的应用。
首先,碳族元素大多可以形成不同种类的化合物,这些化合物具有重要的工业用途。
比如碳的金刚石和石墨在工业上有着广泛的应用,锡在锡制品和合金中有重要的应用。
其次,这些元素的化合物也在冶金和材料领域有着广泛的应用。
第十三章碳族元素元素周期表中的IV A族元素包括碳、硅、锗、锡、铅及其化合物。
13.1 碳族元素的通性13.1.1 原子结构及性质碳族元素中,碳、硅是非金属,其余三种是金属,由于硅、锗的金属性和非金属均不强,也有人将其称为准金属。
M2+2213.1.2成键特点①碳以sp、sp2、sp3三种杂化状态为主,在自然界中以碳酸盐的形式存在。
②硅以硅氧四面体的形式存在于石英矿和硅酸盐矿中,也可以形成少数硅氧氢化合物。
③锡铅以+2氧化态存在于离子化合物中,以+4氧化态存在与共价化合物和少量离子化合物中。
+4氧化态的铅由于惰性电子对效应具有强氧化性。
13.1.3元素在自然界中的分布碳在自然界主要以化石燃料及动植物有机体形式存在,无机矿藏主要有石灰石、大理石、白云石、菱镁矿等,空气中存在约0.03%的二氧化碳。
碳在地壳中的含量为0.027%。
硅在地壳中的质量分数为28.2%,主要以硅酸盐的形式存在于土壤和泥沙中,自然界也存在石英矿。
锗、锡、铅在地壳中的含量都不高,主要以硫化物和氧化物的形式存在。
如硫银锗矿4Ag2S·GeS2、锡石矿SnO2、方铅矿PbS等。
13.2 碳及其化合物13.2.1 单质碳有三种同素异形体,金刚石、石墨、球型碳。
无定形碳中也有石墨的结构。
石墨结构金刚石结构①金刚石的性质金刚石就是我们常说的钻石(钻石是它的俗称),它是一种由纯碳组成的矿物。
金刚石是自然界中最坚硬的物质,因此也就具有了许多重要的工业用途,如精细研磨材料、高硬切割工具、各类钻头、拉丝模。
还被作为很多精密仪器的部件。
金刚石有各种颜色,从无色到黑色都有,以无色的为特佳。
它们可以是透明的,也可以是半透明或不透明。
多数金刚石大多带些黄色。
金刚石的折射率非常高,色散性能也很强,这就是金刚石为什么会反射出五彩缤纷闪光的原因。
金刚石在X射线照射下会发出蓝绿色荧光。
金刚石仅产出于金伯利岩筒中。
金伯利岩是它们的原生地岩石,其他地方的金刚石都是被河流、冰川等搬运过去的。
《化学》碳族元素碳族元素是元素周期表中的第14族元素,包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)和铅(Pb)。
这些元素的特点是在外层电子层中具有4个电子,因此它们通常能与其他元素形成强烈的化学键。
本文将分别介绍这些元素的性质和应用。
首先,让我们来看看碳。
碳是地球上广泛存在的元素之一,它是生命的基础。
它的原子结构包含6个质子和6个中子,因此在最外层电子层中有4个电子。
碳的全电子层配置是1s2,2s2,2p2、由于其外层电子数为4个,碳能形成多种化合物,包括有机化合物。
有机化合物是由碳和氢以及其他一些元素组成的化合物。
碳元素有独特的特点,能够与其他碳原子形成共价键,形成碳链结构,从而形成复杂的有机分子。
有机分子具有多样的性质和用途,包括生物分子、药物、塑料和燃料等。
同时,硅是碳族元素中的另一个重要成员。
它的原子结构包含14个电子,其中4个位于最外层电子层。
硅的全电子层配置是1s2,2s2,2p6,3s2,3p2、硅是地壳中第二丰富的元素,其化合物被广泛应用于电子工业和建筑业。
硅的一个重要特点是其半导体性质。
在纯净的晶体硅中,硅原子通过共价键结合成球状结构,但它们之间并不是完全连接的。
这使得硅具有在一定条件下导电性的特性,可以用于制造各种电子器件,如二极管和晶体管等。
此外,硅化合物也被用于太阳能电池的制造。
除了碳和硅外,锗、锡和铅也是碳族元素中的重要成员。
锗和锡在外层电子层分别有4个电子和2个电子,可与其他元素形成化学键。
它们被广泛用于半导体材料和电子器件的制造,如晶体管和太阳能电池。
铅是碳族元素中密度最高的元素,具有较高的电导率和延展性。
它的外层电子层有4个电子,可以形成化合物和锡类似。
铅在建筑和汽车制造等许多领域中得到广泛应用,但也因其毒性而受到一些限制。
综上所述,碳族元素包括碳、硅、锗、锡和铅,它们在外层电子层中具有4个电子,能够与其他元素形成强烈的化学键。
碳元素是生命的基础,能形成多种有机分子;硅是重要的半导体材料;锗、锡和铅也在电子和工业领域发挥重要作用。
碳族元素1、碳族元素的通性碳原子结构及特性碳族元素中,碳、硅是非金属,其余三种是金属,由于硅、锗的金属性和非金属性均不强,也有人称其为“准金属”。
碳族元素的外层电子构型为ns 2np2碳族元素的基本性质碳族元素的电负性大,要失去价电子层上的1-2 个p 电子成为正离子是困难,它们倾向于将s 电子激发到p 轨道而形成较多的共价键,所以碳和硅的常见氧化态为+IV。
第一电离能在同组元素中,由上而下随着原子半径的增大,电离能减小,元素的金属性依次增强。
电子亲和能在同族元素中,自上而下原子半径逐渐增大,原子核对外来电子的吸引力逐渐减弱,自上而下,电子亲和能呈减小趋势。
可能是Sn 的原子半径相对较小,外层电子云的密度小,对外来一个电子的排斥作用反而比Ge 大,因而得到一个电子放出的的能量较大。
金刚石,晶体硅都为原子晶体,锗、锡、铅都为金属晶体。
碳元素的性质碳的成键特征①以sp、sp2、sp3 三种杂化态与H、O、Cl、N 等非金属原子形成共价化合物,C—C、C—H、C—O 键的键能分别为331 KJ·mol-1、415 KJ·mol-1、343 KJ·mol-1, 键能越大,稳定性越高。
因此,C、H、O 三种能形成数百万种的有机化合物,其中碳的氧化数从+4 变到-4②以碳酸盐的形式存在。
硅的成键特征①以硅氧四面体的形式存在,如石英和硅酸盐矿中。
②Si—Si、Si—H、Si—O 键的键能分别为197 KJ·mol-1、320 KJ·mol-1、386 KJ·mol-1,除Si—O 键,前两者的键能分别小于C—C、C—H,因此Si、H、O 虽可以形成一些类似于C、H、O 形成的有机物,但数量有限碳和硅可以用sp、sp2和sp3杂化轨道形成1 到4 个σ键,但Si sp 和sp2态不稳sp、定。
碳的原子半径小,还能形成pπ—pπ键,所以碳能形成多重键碳的原子半径小,锡铅的成键特征①以+2 氧化态的形式存在于离子化合物中②以+4 氧化态的形式存在于共价化合物和少数离子型化合物中。
其中由于ns 电子对随n 增大(惰电子效应),铅在化合物中呈+2 氧化态的趋势增强,因此+4 氧化态的铅具有强的氧化性。
碳族元素在自然界中的分布碳、硅在地壳中的丰度分别为0.023%、29.50%。
硅的含量在所有元素中居第二位,它以大量的硅酸盐矿和石英矿存在于自然界。
碳的含量虽然不多,但它(除氢外)是地球上化合物最多的元素。
大气中有CO2;矿物界有各种碳酸盐、金刚石、石墨和煤,还有石油和天然气等碳氢化合物动植物体中的脂肪、蛋白质、淀粉和纤维素等等也都是碳的化合物。
如果说硅是构成地球上矿物界的主要元素,那么,碳就是组成生物界的主要元素。
锗、锡、铅在自然界中以化合状态存在。
如硫银锗矿4Ag2S·GeS2,锗石矿Cu2S·FeS·GeS2,锡石矿SnO2,方铅矿PbS 等碳及其化合物单质碳有三种同素异形体,金刚石、石墨和球碳。
木炭、焦炭、炭黑等都有石墨结构。
石墨结构金刚石结构(1)金刚石金刚石是典型的原子晶体,属于立方晶系。
金刚石中每个碳原子均以sp 杂化状态与相邻的四个碳原子结合成键。
金刚石的硬度为10,是硬度最高的物质。
金刚石也是熔点最高的物质,高达3823K。
纯金刚石透明无色,天然金刚石含杂质而多带颜色。
由于每个碳原子以sp3杂化所有价电子都参与了共价键的形成,晶体中没有离域π电子,所以金刚石不导点,几乎对所有的化学试剂显惰性。
在空气中加热到800℃以上时,燃烧生成CO2。
(2)石墨石墨的熔点略低于金刚石。
石墨硬度为1,是最软的晶体之一,呈灰黑色。
石墨具有层状结构,每个碳原子以sp2杂化轨道和邻近的 3 个碳原子以共价单键相联结,构成片状结构。
每层上的原子各提供一个含成单电子的p 轨道形成一个∏nn 大π键,这些离域电子使得石墨具有良好的导电性,常用作电极。
层与层之间靠分子间作用力结合在一起,但相互交错。
由于层间的分子间作用力很弱,所以层间易于滑动,故石墨可以作润滑剂。
石墨对一般化学试剂也显惰性,但比金刚石活泼,在500℃可被氧化成CO2,也可被浓热的HClO4氧化成CO2。
依此可以出去金刚石中的石墨。
(3)球碳科学家认为C60将是21世纪的重要材料(i) C60分子具有球形的芳香性,可以合成C60F n,作为超级润滑剂。
(ii) C60笼内可以填入金属原子而形成超原子分子,作为新型催化剂或催化剂载体,具有超导性,掺K的C60,T c =18K,Rb3C60T c = 29K,它们是三维超导体。
(iii) C60晶体有金属光泽,其微晶体粉末呈黄色,易溶于苯,其苯溶液呈紫红色。
C60分子特别稳定,进行化学反应时,C60始终是一个整体。
碳的氧化物一氧化碳CO 是一种无色无味的气体,不与水作用,属中性氧化物。
CO 可以与血液中的血红素中的铁元素结合生成羰基化合物,使血液失去运输氧的功能。
空气中若含有1/800 体积的CO 就使人在半小时内死亡。
CO 有还原性和加合性,将CO 通入PdCl2溶液,可立即生成黑色沉淀,此反应可用于CO 的定性检验。
CO+PdCl2+2H2O CO2+2HCl+Pd↓CO 与CuCl 的酸性溶液的反应进行得很完全,以至于可以用来定量吸收CO。
CO+CuCl+2H2O Cu(CO)Cl·2H2O冶金工业上CO 是重要的还原剂。
FeO+CO Fe+CO2CO 能与许多过渡金属结合生成羰基配合物,Fe(CO)5、Ni(CO)4,Cr(CO)6等。
这些羰基配合物的生成、分离、加热分解是制备这些高纯金属的方法之一。
工业上将空气和水蒸气交替通入红热炭层,混合气体含CO 40%,CO2 5%,H2 50%C+H2O 称之为水煤气。
C+H2O=Δ= CO+H2或碳的不完全燃烧,得到的气体含CO 25%,CO2 4%,N2 70%( 体积比) 这种混合气体称为发生炉煤气。
2C+O2= 2CO发生炉煤气和水煤气都是工业上的燃料气。
实验室中制备少量CO 是用浓硫酸使甲酸脱水来实现。
HCOOH +浓H2SO4=CO↑+ H2O二氧化碳CO2是一种无色无味的气体,无毒,但大量的CO2可令人窒息。
空气中CO2的体积分数为0.03%。
人呼出的的气体中CO2的体积分数为4%。
2 在5.2atm、CO -56.6℃时可冷凝为雪花状的干冰。
CO2中,C 原子采取sp 杂化,2 个含成单电子的sp 杂化轨道分别与 2 个O 原子的含成单电子的2p 轨道重叠形成 2 个σ键;中心C 原子上还有2 个含成单电子的2p 轨道,垂直于键轴,相互间也垂直;每个O 原子上还有1 个含成单电子的2p 轨道和一个含成对电子的2p 轨道,同样垂直于键轴,相互间也垂直,这样3 个原子对称性匹配的3 个2p 轨道相互重叠形成一个π键,另3 个对称性匹配的2p 轨道也重叠形成另一个π键。
CO2构型为直线型。
CO2可溶于水,常温下,饱和CO2溶液的浓度0.03~0.04mol·dm-3。
CO2 不助燃,可用于灭火,但不能扑灭燃着的Mg.2Mg + CO2=2MgO + CCO2通入石灰水中生成白色沉淀。
CO2 + Ca(OH)2 =CaCO3↓+ H2O由此可以鉴定CO2。
工业用CO2 主要来源于碳酸盐的热分解,如:CaCO3=CaO + CO2↑实验时可用碳酸钙与盐酸反应制备少量CO2CaCO3 +HCl=CaCl2+ CO2↑+ H2O碳酸及其盐碳酸人们习惯上将CO2的水溶液称为碳酸,实际上CO2在水中主要以水和分子的形式存在,只有极少部分生成H2CO3。
CO2 + H2O=H2CO3 K=1.8×10-3如果水中的CO2全部转化成CaCO3,则CaCO3的电离常数为K1=4.3×10 -7,K2=4.8×10-11,碳酸是一种中强酸。
但通常情况下,CO2水合与H2CO3的浓度比为600,CO2的水溶液仅显弱酸性。
H2CO3 = H + +CO32- K=2.4×10-4所以人们通常将碳酸看作弱酸。
碳酸很不稳定,只能存在于水溶液中。
在H2CO3 分子中,中心碳原子采用sp2 杂化,与端O 之间形成1 个σ键,个1 π键与羟基O 之间形成2 个σ键,因此,H2CO3 分子呈平面三角形。
碳酸盐碳酸正盐中除碱金属(Li+除外),铵及铊(Tl+)盐外,均难溶于水,但难溶的正盐其酸式盐溶解度均较大,易溶的正盐其酸式盐的溶解度反而减小。
氢键存在,形成二聚物或多聚物。
碳酸盐的热稳定性相对较低,阳离子的极化性和变形性越大,碳酸盐的热稳定性越低。
同一族金属的碳酸盐稳定性从上到下增加同一周期金属,从左到右,碳酸盐稳定性降低过渡金属碳酸盐稳定性差r(M2+) 愈小,M2+ 极化力愈大,MCO3 愈不稳定;M2+ 为18e_,(18+2)e_,(9-17)e_ 构型相对于8e_构型的极化力大,其MCO3相对不稳定。
金属离子电荷越高,半径越小,电负性越大,其极化能力越强,碳酸盐越易分解碳酸盐易水解。
硅及其化合物硅及其化合物单质单质硅有无定性和晶体两种,晶体硅结构与金刚石相同,属于原子晶体,可导电,导电率随温度的升高而增大,熔、沸点较高,硬而脆,呈灰色,有金属外貌,是典型的半金属。
常温下,硅不活泼,不与水、空气、酸反应,但能溶于碱液,但加热时与许多非金属单质化合,还能与某些金属反应。
Si + 2OH-+ H2O - SiO3 + 2H2↑(1)与金属和非金属反应2与钙、镁、铜、铁等化合生成硅化物2Mg + Si=MgSi(2)与酸反应硅遇到氧化性的酸发生钝化,它可溶于HF-HNO3的混合酸中。
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO↑ + 8H2O硅与氟化氢反应生成SiF4硅与氢氟酸反应H2SiF6(2)与浓碱反应无定形硅能与强碱反应放出氢气:Si+2NaOH+H2O=Na2SiO3+2H2↑(3)硅在高温下与水蒸气反应生成H3SiO3和H2SiO2与C 混合,在高温电炉中加热制备单质硅。
用作半导体用的超纯硅,需用区域熔融的方法提纯。
高纯硅主要用于制造半导体,当硅中掺杂磷时,因磷成键后尚多余一个电子,就构成n 型半导体,若硅中掺杂硼时,因硼成键后尚缺少一个电子,就构成了p 型半导体。
二氧化硅SiO2 是无色晶体,原子晶体,熔沸点分别为1713℃、2230℃,难溶于普通酸,但溶于热碱和氢氟酸中。
SiO2+2NaOH =Na2SiO3 + H2OSiO2(s) + 4HF(g) =SiF4(g)+2H2O(g)原因:Si-F 键能大,极其稳定(590 kJ·mol )SiO2以SiO4四面体为结构单元,“无限大分子”。