无机化学第三版下册答案第二十一章第十五章_碳族元素(1)
- 格式:doc
- 大小:255.00 KB
- 文档页数:10
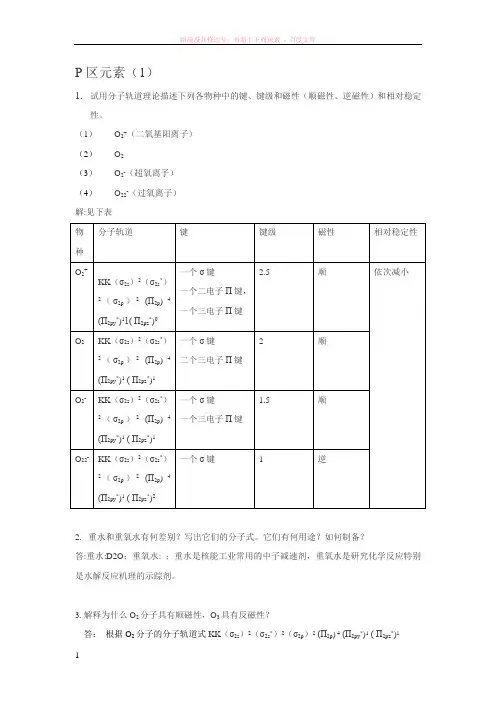
P区元素(1)1.试用分子轨道理论描述下列各物种中的键、键级和磁性(顺磁性、逆磁性)和相对稳定性。
(1)O2+(二氧基阳离子)(2)O2(3)O2-(超氧离子)(4)O22-(过氧离子)解:见下表物种分子轨道键键级磁性相对稳定性O2+KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)11( П2pz*)0一个σ键一个二电子П键,一个三电子П键2.5 顺依次减小O2KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)1( П2pz*)1一个σ键二个三电子П键2 顺O2-KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)1( П2pz*)1一个σ键一个三电子П键1.5 顺O22-KK(σ2s)2(σ2s*)2(σ2p)2(П2p)4(П2py*)1( П2pz*)2一个σ键 1 逆2. 重水和重氧水有何差别?写出它们的分子式。
它们有何用途?如何制备?答:重水:D2O;重氧水: ;重水是核能工业常用的中子减速剂,重氧水是研究化学反应特别是水解反应机理的示踪剂。
3. 解释为什么O2分子具有顺磁性,O3具有反磁性?答:根据O2分子的分子轨道式KK(σ2s)2(σ2s*)2(σ2p)2(П2p) 4(П2py*)1( П2pz*)1分子中两个П2p反键轨道各有一单电子,因此它具有顺磁性。
在O3分子中,每个氧原子各用一个P轨道组成一个成键П轨道,一个反键П轨道,一个非键П轨道,其中4各P电子,两个进入成键П轨道,两个进入非键П轨道,П键键级为一,分子没有成单电子,所以分子具有反磁性。
4.在实验室怎样制备O3?它有什么重要性?5.答:在实验室里制备臭氧主要靠紫外光(<185nm)照射氧或使氧通过静电放电装置而获得臭氧与氧的混合物,含臭氧可达10%。
臭氧发生器的示意图见图13-10。
它是两根玻璃套管所组成的,中间玻璃管内壁镶有锡锚,外管外壁绕有铜线,当锡箔与铜线间接上高电压时,两管的管壁之间发生无声放电(没有火花的放电),02就部分转变成了036.7.油画放置久后为什么会发暗、发黑?为什么可用H2O2来处理?写出反应方程式。


![武大吉大第三版无机化学教材课后习题答案18-23[2]](https://uimg.taocdn.com/795f5f2158fb770bf78a5512.webp)
第十八章1.用反应方程式说明下列现象:(1)铜器在潮湿空气中会慢慢生成一层铜绿;(2)金溶于王水中;(3)在CuCl2浓溶液逐渐加入稀释时,溶液颜色有黄棕色经绿色而变为蓝色。
(4)当SO2通入CuSO4与NaCl的浓溶液时析出白色沉淀;(5)往AgNO3溶液滴加KCN溶液时,先生成白色沉淀而后溶解,再加入NaCl 溶液时并无AgCl沉淀生成,但加入少许Na2S溶液时却析出黑色Ag2S沉淀。
答(1) 2Cu + O2 + H2O + CO2 = Cu2(OH)2CO3(2) Au + 4HCl + HNO3 = HAuCl4 + NO + 2H2O(3) [CuCl4]2- + 4H2O = [Cu(H2O)4]2+ + 4Cl-[CuCl4]2-为黄色[Cu(H2O)4]2+为蓝色,而当这两种离子共存时溶液呈绿色(4)2Cu2+ + 2Cl- + SO2 + 2H2O = 2CuCl + 4H+ + SO42-(5) Ag+ + CN- = AgCNAgCN + CN-=[Ag(CN)2]-2[Ag(CN)2]- + S2- = Ag2S + 4CN-2.解释下列实验事实:(1)焊接铁皮时,常先用浓ZnCl2溶液处理铁皮表面;(2)HgS不溶于HCl,HNO3和(NH4)2S中而能溶于王水或Na2S中,(3)HgC2O4难溶于水,但可溶于含有Cl 离子的溶液中;(4)热分解CuCl2·2H2O时得不到无水CuCl2;(5)HgCl2溶液中有NH4Cl存在时,加入NH3水得不到白色沉淀NH2HgCl。
答(1)ZnCl2 + H2O = H[ZnCl2(OH)]H[ZnCl2(OH)]有显著的酸性能清除金属表面的氧化物而不损害金属表面如:FeO + 2H[ZnCl2(OH)]2 + H2O(2)HgS不溶于HCl溶液中是因为HgS的容度积常数太小HgS不溶于HNO3是因为它与HNO3反应生成难溶的Hg(NO3)2HgSHgS不溶于(NH4)2S是因为(NH4)2S溶液水解为HS-,因而S2-浓度很低,不能形成配合物HgS溶于王水,它与王水反应生成HgCl42-和S3 HgS + 8H+ + 2NO3- + 12Cl- = 3HgCl42- + 3S + 2NO + 4H2OHgS溶于Na2S溶液反应生成可溶性的HgS22-HgS + S2- = HgS22-(3)为H2C2O4酸性比HCl 弱得多;而Cl-与Hg2+生成的配合物较稳定,因而HgC2O4溶于盐酸HgC2O4 + 4HCl = H2HgCl4 + H2C2O4(4)Cu2+离子极化能力很强,HCl又为挥发性酸,CuCl22H2O 热分解时发生水解,得不到无水CuCl22H2Cl + H2O↑ + HCl↑(5)NH4Cl存在抑制了生成NH2-,且NH2HgCl 溶解度较大,因而不能生成NH2HgCl沉淀HgCl2 + 4NH3 = Hg(NH3)42+ + 2Cl-3.试选用配合剂分别将下列各种沉淀溶解掉,并写出相应得方程式。



无机化学练习题(含答案)第1章原子结构与元素周期系1-1试讨论,为什么有的元素的相对原子质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-2Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
1-3氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?1-4周期系中哪一个元素的电负性最大?哪一个元素的电负性最小?周期系从左到右和从上到下元素的电负性变化呈现什么规律?为什么?1-5什么叫惰性电子对效应?它对元素的性质有何影响?1-6当氢原子的一个电子从第二能级层跃迁至第一能级层时发射出光子的波长是121.6nm;当电子从第三能级层跃迁至第二能级层时,发射出光子的波长是656.3nm。
问哪一个光子的能量大?1-7有A,B,C,D四种元素。
其中A为第四周期元素,与D可形成1:1和1:2原子比的化合物。
B为第四周期d区元素,最高氧化数为7。
C和B是同周期元素,具有相同的最高氧化数。
D为所有元素中电负性第二大元素。
给出四种元素的元素符号,并按电负性由大到小排列之。
1-8有A,B,C,D,E,F元素,试按下列条件推断各元素在周期表中的位置、元素符号,给出各元系的价电子构型。
(1)A,B,C为同一周期活泼金属元素,原子半径满足A>B>C,已知C有3个电子层。
(2)D,E为非金属元素,与氢结合生成HD和HE。
室温下D的单质为液体,E的单质为固体。
(3)F为金属元素,它有4个电子层并且有6个单电子。
第2章分子结构2-1键可由-、-p和p-p原子轨道“头碰头”重叠构建而成,试讨论LiH(气态分子)、HCl、Cl2分子里的键分别属于哪一种?2-2NF3和NH3的偶极矩相差很大,试从它们的组成和结构的差异分析原因。
2-3一氧化碳分子与酮的羰基(>C=O)相比,键能较小,键长较小,偶极矩则小得多,且方向相反,试从结构角度作出解释。

第二十一章过渡金属(II)1.解释下列问题:(1)在Fe3+离子溶液中加入KSCN溶液时出现了血红色,但加入少许铁粉后,血红色立即消失,这是什么道理?(2)为什么Fe3+盐是稳定的?而Ni+3盐尚未制得?(3)为什么不能在水溶液中由Fe3+盐和KI制得FeI3?(4)当Na2CO3溶液作用于FeCl3溶液时,为什么得到的是Fe(OH)3而不是Fe2(CO3)3?(5)变色硅胶含有什么成分?为什么干燥时呈蓝色,吸水后变粉红色?答:(1) Fe3+ + nSCN- = Fe(SCN)n3-nn= 1—6血红色,加入铁粉后,铁粉将 FeⅢ还原,生成的Fe2+不与SCN-生成有色的配合物,因而血红色消失2Fe(SCN)n3-n + Fe = 3Fe2+ + nSCN-(2)铁的外层电子构型为3d64s2,Fe3+的3d5半满电子构型使它比Fe2+的3d6电子构型稳定,镍的外层电子构型为3d84s2,其中3d的电子超过半满状态较难失去,所以一般情况下,镍表现为+2氧化态,在特殊条件下也可以得到不稳定的Ni(III)化合物,如Ni2O3和NiAl。
(3)ϕθ(Fe3+,Fe2+)>ϕθ(I2/I-),在水溶液中Fe3+将I-氧化得不到FeI3:2 Fe3+ + 2 I- = 2Fe2+ + I2(4)Na2CO3在水中发生水解: CO32- + H2O ⇔ HCO3- + OH-溶液中[CO32-]和[OH-]相差不大,而Fe(OH)3的溶解度远小于Fe2(CO3)3,故FeCl3与Na2CO3溶液想遇产生Fe(OH)3沉淀,而不是生成Fe2(CO3)3沉淀。
2Fe3+ + 3CO32- + 6H2O = 2 Fe(OH)3↓ + 3H2CO3(5)变色硅胶中含吸湿指示剂CoCl2,所含结晶水的数目不同,颜色不同。
CoCl2•6H2O ⇔ CoCl2•2 H2O ⇔ CoCl2• H2O ⇔ CoCl2粉红色紫红色蓝紫色蓝色所以无水CoCl2显蓝色,CoCl2结晶水较多时显粉红色。


第1章 原子结构与元素周期律1-1在自然界中氢有三种同位素,氧也有三种同位素,问:总共有多少种含有不同核素的水分子?由于3H 太少,可忽略不计,问:不计3H 时天然水中共有多少种同位素异构水分子?解: 共有18种不同核素的水分子 共有9种不同核素的水分子1-2.答:出现两个峰1-3用质谱仪测得溴的两种天然同位素的相对原子质量和同位素丰度分别为 79Br 78.9183 占 50.54%,81Br 80.9163 占 49.46%,求溴的相对原子质量。
解:1-4铊的天然同位素203Tl和205Tl 的核素质量分别为202.97u 和204.97u ,已知铊的相对原子质量为204.39,求铊的同位素丰度。
解: 设203Tl 的丰度为X ,205Tl 的丰度为1-X 204.39 = 202.97X + 204.97(1-X) X= 29.00%1-5等质量的银制成氯化银和碘化银,测得质量比m (AgCl ):m (AgI )= 1:1.63810,又测得银和氯的相对原子质量分别为107.868和35.453,求碘的原子量。
解: X= 126.911-8为什么有的元素原子量的有效数字的位数多达9位,而有的元素的原子量的有效数字的位数却少至3~4位?答:单核素元素只有一种同位素,因而它们的原子量十分准确。
而多核素元素原子量的准确性与它们同位素丰度的测量准确性有关(样品的来源、性质以及取样方式方法等)。
若同位素丰度涨落很大的元素,原子量就不可能取得很准确的数据。
1-13.解:(1)r=c /λ=(3×108)/(633×10-9) = 4.74×1014 Hz 氦-氖激发是红光(2)r=c/λ=(3.0×108)/(435.8×10-9) = 6.88×1014 Hz 汞灯发蓝光18)33(313131323=+⨯=⋅+⋅c c c c 9)21(313121322=+⨯=⋅+⋅c c c c 91.79%46.499163.80%54.509183.78)Br (=⨯+⨯=Ar X 107.86835.453107.86863810.11)AgI ()AgCl (++==m m(3)r=c/λ=(3.0×108)/(670.8×10-9) = 4.47×1014 Hz 锂是紫红1-14 Br 2分子分解为Br 原子需要的最低解离能为190kJ.mol -1,求引起溴分子解离需要吸收的最低能量子的波长与频率。

第15章 碳族元素一、判断题1.酸式碳酸盐比其正盐易分解,是因为金属离子与3HCO -离子的离子键很强。
[南京航空航天大学2012研]【答案】×【解析】根据极化理论,HCO 3-中的H +与O 2-之间的作用较强,削弱了C 与O 之间的共价键,导致键能减小,比较容易断裂,故酸式碳酸盐比其正盐易分解。
2.配制SnCl 2溶液,常在溶液中放入少量固体Sn 粒,其原因是防止Sn 2+水解。
[南京航空航天大学2011研]【答案】×【解析】Sn 2+容易被氧化为Sn 4+离子,而Sn 4+离子具有氧化性,又会把Sn 单质氧化为Sn 2+离子,所以加入Sn 单质,是为了防止Sn 2+被氧化。
二、填空题1.SiF 4水解产物是______和______;也可能是______和______。
[北京科技大学2012研]【答案】H 4SiO 4;HF ;H 2SiO 3;HF【解析】水解反应生成原硅酸H 4SiO 4和HF ,H 4SiO 4不稳定,分解成硅酸和水,反应方程式如下:4244SiF 4H O H SiO 4HF +=+44232H SiO H SiO H O =+2.写出2PbO 和浓盐酸反应的方程式______。
[南京航空航天大学2011研]【答案】2222PbO 4HCl()PbCl Cl 2H O +−−→+↑+浓三、选择题1.下列物质中熔点最高的是( )。
[北京科技大学2012研]A .SiO 2B .SO 2C .NaClD .SiCl 4【答案】A【解析】A 项为原子晶体,B 项为分子晶体,C 项为离子晶体,D 项为分子晶体,根据熔点的一般规律:原子晶体>离子晶体>分子晶体,可知,SiO 2熔点最高。
2.下列关于PbCl 2和SnCl 2的叙述中,错误的是( )[北京科技大学2012研]A .SnCl 2比PbCl 2易溶于水B .它们都能被Hg 2+氧化C .它们都可以与Cl -形成配合物D .在多种有机溶剂中,SnCl 2比PbCl 2更易溶【答案】B【解析】A 项:绝大多数Pb 2+的化合物是难溶于水的,而SnCl 2溶于小于本身重量的水;B 项:SnCl 2是重要的还原剂,能将HgCl 2还原为白色沉淀氯化亚汞Hg 2Cl 2,反应的方程式为: 2222262HgCl Sn 4Cl Hg Cl (s)[SnCl ]+--++→+,而PbCl 2的还原性比SnCl 2弱,在碱性溶液且较强的氧化剂条件下,才能将Pb 2+氧化为Pb 4+;C 项:Pb 2+和Sn 2+都可以与Cl -形成配合物,反应方程式为:224PbCl 2HCl H [PbCl ]+→和2222262HgCl Sn 4Cl Hg Cl (s)[SnCl ]+--++→+。
第十二章卤素1.卤素中哪些元素最活泼?为什么有氟至氯活泼性变化有一个突变?答:单质的活泼性次序为:F2>>Cl2>Br2>I2从F2到Cl2活泼性突变,其原因归结为F原子和F—离子的半径特别小。
F Cl Br I F—Cl—Br—I—r/pm 64 99 114 133 136 181 195 216(1)由于F的原子半径非常小,F—F原子间的斥力和非键电子对的斥力较大,使F2的解离能(155KJ/mol)远小于Cl2的解离能(240KJ/mol)。
(2)由于F-离子半径特别小,因此在形成化合物时,氟化物的离子键更强,键能或晶格能更大。
由于F-离子半径特别小,F-的水合放热比其他卤素离子多。
2.举例说明卤素单质氧化性和卤离子X-还原性递变规律,并说明原因。
答:氧化性顺序为:F2 >Cl2 >Br2>I2 ;还原性顺序为:I- >Br->Cl->F-.尽管在同族中氯的电子亲合能最高,但最强的氧化剂却是氟卤素单质是很强的氧化剂,随着原子半径的增大,卤素的氧化能力依次减弱。
尽管在同族中氯的电子亲合能最高,但最强的氧化剂却是氟。
一种氧化剂在常温下,在水溶液中氧化能ϕ值的大小和下列过程有关(见课本P524)力的强弱,可用其标准电极电势值来表示,θ3.写出氯气与钛、铝、氢、水和碳酸钾作用的反应式,并注明必要的反应条件。
答:(1)2Cl2+Ti =TiCl4加热,干燥(2)3Cl2+2Al =2AlCl3 加热,干燥(3)Cl2+H2 =2HCl 点燃(4)3Cl2+2P(过量)=2PCl3 干燥5Cl2(过量)+2P=2PCl5干燥(5)Cl2+H2O=HClO +HCl(6) Cl2+2K2CO3+H2O=KCl+KClO+2KHCO34.试解释下列现象:(1)I2溶解在CCl4中得到紫色溶液,而I2在乙醚中却是红棕色。
(2)I2难溶于水却易溶于KI中。
1、教材《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,2002年8月第4版。
2、参考书《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,1992年5月第3版。
《无机化学》邵学俊等编,武汉大学出版社,2003年4月第2版。
《无机化学》武汉大学、吉林大学等校编,高等教育出版社,1994年4月第3版。
《无机化学例题与习题》徐家宁等编,高等教育出版社,2000年7月第1版。
《无机化学习题精解》竺际舜主编,科学出版社,2001年9月第1版《无机化学》电子教案绪论(2学时)第一章原子结构和元素周期系(8学时)第二章分子结构(8学时)第三章晶体结构(4学时)第四章配合物(4学时)第五章化学热力学基础(8学时)第六章化学平衡常数(4学时)第七章化学动力学基础(6学时)第八章水溶液(4学时)第九章酸碱平衡(6学时)第十章沉淀溶解平衡(4学时)第十一章电化学基础(8学时)第十二章配位平衡(4学时)第十三章氢和稀有气体(2学时)第十四章卤素(6学时)第十五章氧族元素(5学时)第十六章氮、磷、砷(5学时)第十七章碳、硅、硼(6学时)第十八章非金属元素小结(4学时)第十九章金属通论(2学时)第二十章s区元素(4学时)第二十一章p区金属(4学时)第二十二章ds区元素(6学时)第二十三章d区元素(一)第四周期d区元素(6学时)第二十四章d区元素(二)第五、六周期d区金属(4学时)第二十五章核化学(2学时)1 .化学的研究对象什么是化学?●化学是研究物质的组成、结构、性质与变化的一门自然科学。
(太宽泛)●化学研究的是化学物质(chemicals) 。
●化学研究分子的组成、结构、性质与变化。
●化学是研究分子层次以及以超分子为代表的分子以上层次的化学物质的组成、结构、性质和变化的科学。
●化学是一门研究分子和超分子层次的化学物种的组成、结构、性质和变化的自然科学。
16. 完成并配平下列反应式:(1)H2S+H2O2→(2)H2S+Br2→(3)H2S+I2→(4)H2S+O2→+H+→(5)H2S+ClO-3(6)Na2S+Na2SO3+H+→(7)Na2S2O3+I2→(8)Na2S2O3+Cl2→(9)SO2+H2O+Cl2→(10)H2O2+KMnO4+H+→(11)Na2O2+CO2→(12)KO2+H2O→(13)Fe(OH)2+O2+OH-→(14)K2S2O8+Mn2++H++NO-→3(15)H2SeO3+H2O2→答:(1)H2S+H2O2=S+2H2OH2S+4H2O2(过量)=H2SO4+4H2O(2)H2S+Br2=2HBr+SH2S+4Br2(过量)+4H2O=8HBr+H2SO4(1)H2S+I2=2I-+S+2H+(2)2H2S+O2=2S+2H2O(3)3H2S+ClO3-=3S+Cl-+3H2O(4)2S2-+SO32-+6H+=3S+3H2O(5)2Na2S2O3+I2=Na2S4O6+2NaI(6)Na2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl(7)SO2+Cl2+2H2O=H2SO4+2HCl(8)5H2O2+2MnO4-+6H+=2Mn2++5O2+8H2O(9)2Na2O2+2CO2=2Na2CO3+O2(10)2KO2+2H2O=2KOH+O2+H2O2(11)4Fe(OH)2+O2+2H2O=4Fe(OH)3(12)5S2O82-+2Mn2++8H2O=10SO42-+2MnO4-+16H+(13)H2SeO3+H2O2=H2SeO4+H2O17.在标准状况下,50cm3含有O3的氧气,若其中所含O3完全分解后,体积增加到52 cm3。
如将分解前的混合气体通入KI溶液中,能析出多少克碘?分解前的混合气体中O3的体积分数是多少?解:5.68mg ,8.1%溶液退色,求碘溶18.每升含12.41克Na2S2O3·5 H2O的溶液35.00 cm3,恰好使50.00 cm3的I-3液的浓度?解:I3-+2S2O32-=S4O62-+3I-1.75×10-2mol/L19.下述反应在298K 时的△H θm 为284.5kJ ·mol -13O 22O 3已知此反应平衡常数为10-54,试计算该反应的△G θm 和△S θm 。
⼤学⽆机化学第⼗五章试题及答案解析第⼗⼆章氧族元素总体⽬标:1.了解氧化物的分类2. 握氧、臭氧、过氧化氢的结构、性质和⽤途3.掌握硫的多种氧化态所形成的重要化合物的结构、性质、⽤途以及它们之间的相互转化关系。
各节⽬标:第⼀节氧及其化合物1.掌握氧、臭氧的结构、性质、制备和⽤途;氧的成键特征2.了解氧化物的分类;掌握主要氧化物的结构、制备和性质(与⽔的作⽤、酸碱性)3.掌握过氧化氢的结构、实验室和⼯业制法、性质和⽤途第⼆节硫及其化合物1.了解硫的同素异形体、制备、性质和⽤途2.掌握硫化氢的制备、结构和性质;了解⾦属硫化物的主要性质3.掌握SO2、SO3、H2SO3、H2SO4和它们相应的盐、硫代硫酸及其盐、过⼆硫酸及其盐的结构、性质、制备和⽤途以及它们之间的相互转化关系第三节硒、碲及其化合物了解硒、碲及其化合物的结构和性质习题⼀选择题1.H2O2熔、沸点较⾼(分别为273K和423K),其主要原因是()A .H2O2相对分⼦质量⼤ B. H2O2分⼦极性⼤C. H2O2分⼦间氢键很强,在固液时均有存在缔和现象D. H2O2分⼦内键能⼤2.⽓态SO3分⼦的⼏何构型是()A.线性B.平⾯三⾓形C.弯曲形D.三⾓锥3.在293K,101.3KPa压⼒下,1体积⽔可溶解H2S⽓体2.6体积即饱和,此H2S饱和溶液pH值约为()A.2.5B.3.8C.3.5D.4.04.在分别含有0.1mol/L的Hg2+,Cu2+,Cr3+,Zn2+,Fe2+的溶液中,在酸度为0.3mol/L 条件下,通H2S⾄饱和都能⽣成硫化物沉淀的是()(吴成鉴《⽆机化学学习指导》)A.Cu2+,Hg2+B.Fe2+,Cr3+C.Cr3+,Hg2+D.Zn2+,Fe2+5.既能溶于Na2S⼜能溶于Na2S2的硫化物是()(吉林⼤学《⽆机化学例题与习题》)A.ZnSB.As2S3C. HgSD.CuS6.在空⽓中长期放置后,会产⽣多硫物的是()A.H2SB.Na2SC.Na2SO3D.Na2S2O47.热分解硫酸亚铁的最终产物是()A.FeO+SO3B.FeO+SO2+1/2O2C.Fe2O3+SO2D.Fe2O3+SO3+SO28.⽤于制备K2S2O8的⽅法是()A.在过量硫酸存在下,⽤KMnO4使K2SO4氧化B.在K+离⼦存在下,往发烟H2SO4中通⼊空⽓C.在K+离⼦存在下,电解使H2SO4反发⽣阳极氧化反应D.⽤Cl2氧化K2S2O39.下列含氧酸中酸性最弱的是()A.HClO3B.HBrO3C.H2SeO4D.H6TeO610.硫的含氧酸酸性递变规律是()A.H2SO4>H2SO3>H2S2O7>H2S2O4B.H2SO4>H2S2O7>H2SO3>H2S2O4C.H2S2O7>H2SO4>H2SO3>H2S2O4D.H2S2O7>H2SO4>H2S2O4>H2SO311.下列四种硫的含氧酸盐中,氧化能⼒最强的是();还原能⼒最强的是()A.Na2SO4B.Na2S2O3C.Na2S4O6D. K2S2O812.下列各种硫的含氧酸,可以是同多酸的是()A.H2S3O6B.H2S2O7C.H2S3O10D.H2S6O613.下列叙述中错误的是()(吉林⼤学《⽆机化学例题与习题》)A.⾃然界中只存在单质氧⽽没有单质硫B.氧既有正氧化态的化合物,⼜有负氧化态的化合物C.由H和18O组成的⽔叫做重氧⽔D. O2和O3为同素异形体14.常温下最稳定的晶体硫的分⼦式为()(吉林⼤学《⽆机化学例题与习题》)A.S2B.S4C.S6D.S815.为使已变暗的古油画恢复原来的⽩⾊,使⽤的⽅法为()A.⽤SO2⽓体漂⽩B.⽤稀H2O2溶液擦洗C.⽤氯⽔擦洗D.⽤O3漂⽩16.⼲燥H2S⽓体,可选⽤的⼲燥剂是()A.浓H2SO4B.KOHC.P2O5D.CuSO417.关于O3的下列叙述中正确的是()A.O3⽐O2稳定B.O3是⾮极性分⼦C.O3是顺磁性物质D.O3⽐O2的氧化性强18.不溶于Na2S2的硫化物是()(吉林⼤学《⽆机化学例题与习题》)A.ZnSB.As2S3C.Sb2S3D.SnS19.下列说法中错误的是()(吉林⼤学《⽆机化学例题与习题》)A.SO2分⼦为极性分⼦B.SO2溶于⽔可制取纯H2SO3C. H2SO3可使品红褪⾊D. H2SO3既有氧化性⼜有还原性20.⼯业上⽣产SO2的⽅法主要是()A.焙烧FeS2B.单质硫在空⽓中燃烧C.亚硫酸盐与酸反应D.浓硫酸与铜反应21.下列各对物质中,能发⽣反应的是()(吉林⼤学《⽆机化学例题与习题》)A.CuS 和HClB.Ag 和HClC.AlCl3和H2SD.Na2SO3和I222.对多硫化物的性质不正确的叙述是()(吴成鉴《⽆机化学学习指导》)A.H2S2的酸性⽐H2S要强⼀些B多硫化物的颜⾊⽐相应硫化物要深⼀些C 多硫化物中硫的氧化数为负⼀,因此多硫化物具有同等的氧化性及还原性D多硫化物遇酸分解有H2S⽓体及S析出23.硫酸盐具有的共性是()⿊龙江A.硫酸盐都是可溶性盐B.从溶液中析出的硫酸盐都含有结晶⽔C.具有⾼的热稳定性,且⾦属价态越⾼,硫酸盐越稳定D.硫酸盐有形成复盐的特性⼆填空题1.臭氧分⼦的结构为,O—O之间的键级为,所以它的化学性质⽐氧分⼦ .2.多硫酸的⽴体结构式为;连多硫酸的⽴体结构式为 .3.长期放置的Na2S或(NH4)2S,颜⾊会变浑,原因是 .4.氧族元素价电⼦层构型是;随着电离势降低,它们的减弱;硫、硒、碲常见氧化数为;在焦硫酸分⼦中硫的氧化数为;在硫代硫酸钠分⼦中硫的氧化数为;在连四硫酸钠分⼦中硫的氧化数为。
第十五章 碳族元素1.碳单质有哪些同素异形体?其结构特点及物理性质如何?答:碳单质有三种同素异形体:石墨,金刚石和C 60。
结构分为层状,网状和球状,见教材p730-732。
物理性质主要是石墨能导电,金刚石硬度大,C 60有超导性。
2.实验室里如何制取二氧化碳气体?工业如何制取二氧化碳气体? 答:实验室法:O H CO CaCl HCl 2CaCO 2223+↑+=+工业法:CaCO 3CaOCO 23.图15-6中,三条直线相交于一点,这是必然的还是偶然的,试讨论其原因。
答:是一种必然。
在Ellingham 图中,以ΔrG θ=ΔrH θ-TΔrS θ作ΔrG θ-T 图,斜率为ΔrS θ,截距为ΔrH θ。
反应:22CO O C =+ ΔrS θ≈ 0,所以为一直线 反应:22CO 2O CO 2=+ ΔrS θ< 0,直线上斜 反应:CO 2O C 22=+ ΔrS θ> 0,直线下斜 所以三线相交于一点是必然的。
3.分别向0.20mol·dm -3的Mg 2+和Ca 2+的溶液中加入等体积的0.20mol·dm -3的Na 2CO 3溶液,产生沉淀的情况有何不同,试讨论其规律性。
答:有CaCO 3沉淀,也有MgCO 3沉淀。
沉淀: CaCO 3 MgCO 3 Mg(OH)2K sp 2.9×10-9 3.5×10-8 1.8×10-11 溶液中122L mol 1.02120.0]Mg []Ca [-++•=⨯==加入Na 2CO 3后溶液浓度为0.1mol/L 。
溶液中-23CO []计算:11431112110[]0.1 4.22105.610b Kw COH K C mol L Ka -----⋅⨯=⋅==⨯=⨯•⨯ ∵ --+=+OH HCO O H CO 32_230.1-x x x1241.8100.1b x K x-==⨯-[CO -23]=0.1-x≈0.1 mol.L -1Q i =[Ca 2+][CO -23]=0.1×0.1 =0.01﹥K sp ,CaCO 3 =2.9×10-9Q i >Ksp ,所以有CaCO 3和MgCO 3沉淀。
Q i =[Mg 2+][OH -]2=0.1×(4.221×10-3)2=1.78×10-7>Ksp,Mg(OH)2= 1.8×10-11∴ 也有Mg(OH)2沉淀。
5.CCl 4不易发生水解,而SiCl 4较易水解,其原因是什么?答:C 为第二周期元素,只有2s ,2p 轨道可以成键,最大配位数为4,CCl 4无空轨道可以接受水的配位,因此不水解。
HCl 4SiO H O H 4SiCl 4424+=+↑SiCl 4中Si 为第三周期元素,有d 轨道,可以接受水分子中的氧原子的孤对电子形成配位键生成五配位的中间体而发生水解;而CCl 4中的C 原子无空d 轨道。
6.通过计算回答下述问题:(1)在298K ,1.013×105Pa 下生成水煤气的反应能否自发进行?(2)用ΔrS 0值判断,提高温度对生成水煤气反应是否有利?(3)在1.013×105Pa 下,生成水煤气的反应体系达到平衡时的温度有多高? 解:(1)水煤气反应:22H CO O H C +=+ 298K ,1.013×105Pa 时10)g ,O H (m f 0)s ,C (m f o )g ,H (m f 0)g ,CO (m f o m mol·kJ 8.90)6.228(002.137G G G G rG 22-=---+-=∆-∆-∆+∆=∆0rG o m >∆,所以常温下水煤气反应不能自发。
(2)提高温度时:C + H 2O = CO + H 20m S ∆ 5.73 188.7 197.6 1300m S ∆=197.6+130-5.73-188.7=133.17(J .mol -1.K -1)0m S ∆>0,所以,升高温度对反应有利。
(3)平衡温度:00rSrH T ∆∆=求0m rH ∆:C + H 2O = CO + H 20m f H ∆ 0 -241.8 -110.5 00m f H ∆=-110.5-(-241.8)=131.3 (kJ/mol))K (95.98517.133103.131rS rH T 30=⨯=∆∆=7.比较CO 和CO 2的性质。
如何除去CO 中含有的少量CO 2?如何除去CO 2中含有的少量CO ?答: CO CO 2还原性 强 无 配位性 有 无 毒性 有 无除去CO 中含有的少量CO 2,使气体通过Ca(OH)2溶液:O H CaCO CO )OH (Ca 2322+↓=+除去CO 2中含有的少量CO ,使气体通过CuCl 溶液(或PbCl 2溶液)COCuClH 2O Cu(CO)Cl H 2OHCl通过赤热的CuO 粉末:2CuO CO Cu CO +=+8.计算当溶液的pH 分别等于4,8,12时,H 2CO 3,-3HCO ,-23CO 所占的百分数。
答:当pH =4,8,12时,溶液中[H +]=10-4,10-8,10-12 mol/L-++⇔332HCO H CO H (1) Ka 1= 4.27×10-7 -+-+⇔233CO H HCO (2) Ka 2=5.6×10-11(1)pH =4时 [H +]=1×10-4 mol/L ,则 [-3HCO ]=1×10-4 mol/L因 2323Ka ]HCO []CO ][H [=--+ 所以: Lmol 106.5]CO [1123--⨯= H 2CO 3是二元弱酸,C ·Ka ]H [1=+)L /mol (042.0102.4)100.1(Ka ]H [C 72412=⨯⨯=≈--+ ∴ [H 2CO 3]=C 0-[H +]=0.042-1.0×10-4≈0.0399 mol/L95100042.00399.0CO H 32=⨯=% 24.0100042.00001.0HCO 3=⨯=-% 711231033.1100042.0106.5CO ---⨯=⨯⨯=%(2)pH =8时, [H +]=1×10-8 mol/L , [OH -]=1×10-6 mol/L--+⇔+OH CO H O H HCO 3223 81h 1038.2Ka KwK -⨯==已知: [OH -]=[H 2CO 3]=1×10-6 mol/L开始时 C NaHCO3 = [H 2CO 3]+[OH -] = 2[OH -] = 2×10-6 mol/L平衡时 [-3HCO ] = C NaHCO3-[OH -] =2×10-6-1×10-6=1×10-6 mol/L9. 烯烃能稳定存在,而硅烯烃如 H 2Si-SiH 2 却难以存在。
其原因是什么? 答:与C 和Si 的半径大小和电负性差别有关。
C 原子半径小,电负性大,除形成C -C σ键外,p 轨道按肩并肩在较大重叠,还可形成σ+π的C=C 双键或σ+2个π键的C≡C 叁键,而且键能大,故烯烃可稳定存在,且数量多,C 以sp 2和sp 杂化形成重键;Si 的半径大,电负性小,p 轨道肩并肩重叠很少,不能有效地形成π键,因而Si 只能形成Si -Si 单键,Si=Si 难以存在,Si 只能以sp 3杂化成键。
10.从水玻璃出发怎样制造变色硅胶? 答:将Na 2SiO 3溶液与适量酸混合生成硅酸:Na 2SiO 3 + 2H + = SiO 2.H 2O + 2Na +调节酸和Na 2SiO 3的用量,使生成的硅凝胶中含有8%~10%的SiO 2,将生成物放置一天,用热水洗去盐分如NaCl ,将凝胶在60-70℃下烘干,徐徐升温至300℃即得多孔硅胶。
将硅胶干燥活化前先用CoCl 2溶液浸泡,再经干燥得变色硅胶。
11.用化学方程式表示单质硅的制备反应,单质硅的主要化学性质,二氧化硅的制备和性质。
答:(1)制备单质Si :SiO 2C1600-1800℃2CO Si (95%)Si2Cl 2SiCl 4450-500℃SiCl 42H 2Si 4HCl1150-1200%Mo 丝(2)单质硅的主要化学性质SiO 2SiO 2Si2Cl 2SiCl 4Si 与F 反应燃烧Si2OH -2H 2OSiO 32-2H (3)SiO 2的制备:↑+=+=++++↑=+-23232222322622242CO SiO Na CO Na 2SiO OH SiO OH 2SiO O H 2SiF H (HF 6SiO OH SiF )g (HF 4SiO +液)=-(4)SiO 2的性质:SiO 2属于原子晶体,熔点高,硬度大,难熔化。
12.什么是沸石分子筛?试述其结构特点和应用?答:自然界中存在的某些网络状的硅酸盐和铝酸盐具有笼形结构,这些均匀的笼可以有选择地吸附一定大小的分子,即起到筛分子的作用,这种作用叫做分子筛作用。
通常把这样的含有结晶水的多孔结构的天然铝硅酸盐(Na 2O·Al 2O 3·2SiO 2·nH 2O )叫做沸石分子筛。
主要应用于吸收或失去能进入网孔通道的小分子,有些大分子则不能通过。
A 型分子筛中,所有硅氧四面体和铝氧四面体通过共用氧原子联结成多元环。
13.实验室中配制SnCl 2溶液时,要采取哪些措施?其目的是什么?答:因为氯化亚锡极易水解,生成Sn(OH)Cl 沉淀,此沉淀一旦生成很难再溶于HCl 中。
所以配置氯化亚锡溶液时,应先将固体溶于适量浓盐酸中,然后再加水稀释。
HCl Cl )OH (Sn O H SnCl 22+↓=+另外,配好的溶液久置或使用后Sn 2+易被空气中的氧气氧化为Sn 4+而失效: O H Sn H 2O Sn 22422+=+++++所以,配置好的溶液中应加几颗锡粒,以维持Sn 2+的浓度: Sn 4+ + Sn = 2Sn 2+14.单质锡有哪些同素异形体,性质有何异同?α-锡酸和β-锡酸的制取和性质方面有何异同?答:锡有三种同素异形体:脆锡白锡灰锡−−→←−−→←K434K 286(α) (β) (γ) 立方晶系 四方晶系 正交晶系在常温下白锡是稳定态,低于286K 时,灰锡是稳定态,高于434K 时脆锡稳定。
实验室中常用的是白锡。
锡与浓硝酸反应得β-H 2SnO 3:O H NO 4SnO H HNO 4Sn 22323+↑+=+ 而SnCl 4与NH 3·H 2O 反应可得α-H 2SnO 3: Cl NH 4)OH (Sn O H ·NH 4SnCl 44234+↓=+α-H 2SnO 3溶于酸碱,而β-H 2SnO 3是晶态的,不溶于酸碱:624)OH (Sn Na NaOH 2)OH (Sn =+ O H 4SnCl HCl 4)OH (Sn 244+=+ 15.试述铅蓄电池的基本原理。