我们周围的空气复习
- 格式:pdf
- 大小:1.60 MB
- 文档页数:22




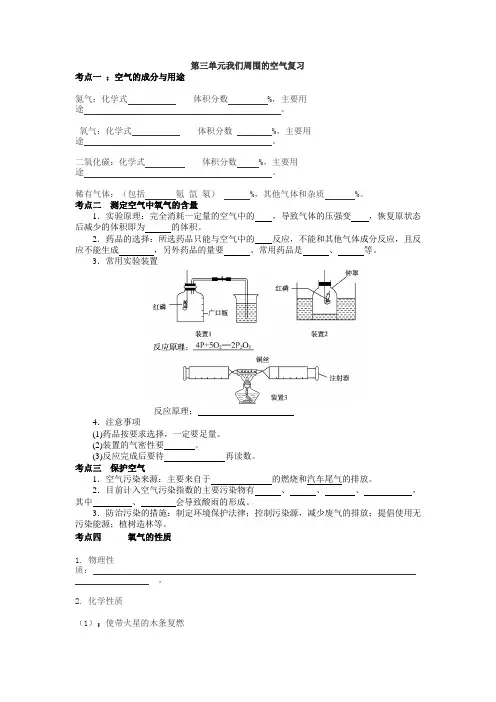
第三单元我们周围的空气复习考点一:空气的成分与用途氮气:化学式体积分数 %,主要用途。
氧气:化学式体积分数 %,主要用途。
二氧化碳:化学式体积分数 %,主要用途。
稀有气体:(包括氪氙氡) %,其他气体和杂质 %。
考点二测定空气中氧气的含量1.实验原理:完全消耗一定量的空气中的,导致气体的压强变,恢复原状态后减少的体积即为的体积。
2.药品的选择:所选药品只能与空气中的反应,不能和其他气体成分反应,且反应不能生成,另外药品的量要。
常用药品是、等。
3.常用实验装置反应原理:4.注意事项(1)药品按要求选择,一定要足量。
(2)装置的气密性要。
(3)反应完成后要待再读数。
考点三保护空气1.空气污染来源:主要来自于的燃烧和汽车尾气的排放。
2.目前计入空气污染指数的主要污染物有、、、,其中、会导致酸雨的形成。
3.防治污染的措施:制定环境保护法律;控制污染源,减少废气的排放;提倡使用无污染能源;植树造林等。
考点四氧气的性质1. 物理性质:。
2. 化学性质(1):使带火星的木条复燃(2)硫与氧气空气中燃烧现象化学方方程式:氧气中燃烧现象化学方方程式:(3)碳在氧气中燃烧:现象:化学方方程式:(4)铁丝在氧气中燃烧:现象:化学方方程:(5)蜡烛与氧气空气中:燃烧产生黄色火焰,放热,稍有黑烟。
氧气中:比空气中燃烧剧烈,发出白光,集气瓶内壁出现水珠,有使澄清石灰水变浑浊的无色无味气体产生(6)其他物质与氧气的反应某些物质在一些条件下,与氧气发生缓慢的氧化反应,不易被察觉到,称为如:动植物新陈代谢,金属的锈蚀,食物的腐烂等等。
考点五氧气的制备1.工业制法工业上常用的方法制备氧气。
首先通过降温加压,使空气,然后蒸发,利用各成分的不同将其分离开,从而得到氧气。
这个过程属于变化。
2.实验室制法(1)(2)实验装置(3)收集及验满方法①法:当有大量气泡冒出时说明已收集满;②法:将带火星的木条,木条复燃说明已收集满。
(4)检验方法将带火星的木条,木条复燃说明气体为氧气。
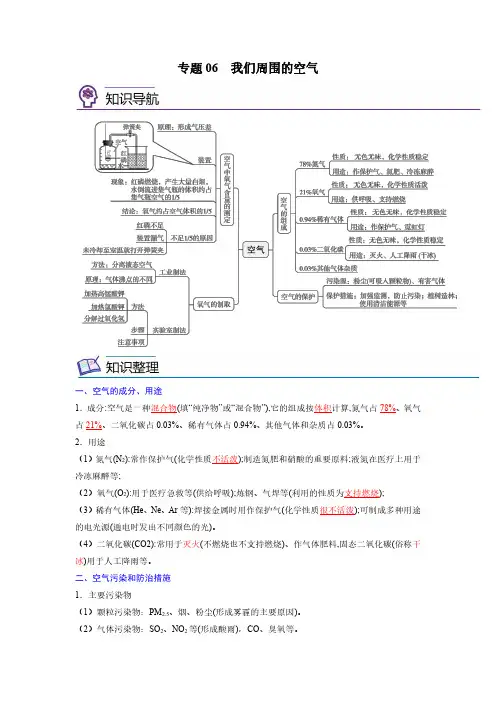
专题06我们周围的空气一、空气的成分、用途1.成分:空气是一种混合物(填“纯净物”或“混合物”),它的组成按体积计算,氮气占78%、氧气占21%、二氧化碳占0.03%、稀有气体占0.94%、其他气体和杂质占0.03%。
2.用途(1)氮气(N2):常作保护气(化学性质不活泼);制造氮肥和硝酸的重要原料;液氮在医疗上用于冷冻麻醉等;(2)氧气(O2):用于医疗急救等(供给呼吸);炼钢、气焊等(利用的性质为支持燃烧);(3)稀有气体(He、Ne、Ar等):焊接金属时用作保护气(化学性质很不活泼);可制成多种用途的电光源(通电时发出不同颜色的光)。
(4)二氧化碳(CO2):常用于灭火(不燃烧也不支持燃烧)、作气体肥料,固态二氧化碳(俗称干冰)用于人工降雨等。
二、空气污染和防治措施1.主要污染物(1)颗粒污染物:PM2.5、烟、粉尘(形成雾霾的主要原因)。
(2)气体污染物:SO2、NO2等(形成酸雨),CO、臭氧等。
2.治理:加强大气质量监测;使用清洁能源;积极植树造林、种草;安装汽车尾气净化装置等。
三、氧气的性质及用途1.氧气的物理性质:氧气是一种无色、无味的气体,密度比空气大,不易溶于水。
2.氧气的化学性质(助燃性、氧化性):氧气的化学性质比较活泼,在点燃的条件下能跟多种物质发生反应。
而炸裂集气瓶;吸收生成的P2O5(白烟),防止污染空气;②硫燃烧实验是为了吸收生成的SO2气体,防止污染空气(水也可以换成氢氧化钠溶液);③铁丝燃烧实验是为了防止熔融物溅落,炸裂瓶底。
实验探究一:空气中氧气含量的测定)把集气瓶液面以上容积分成实验探究二:氧气的实验室制取1.工业制法(物理变化):根据空气中各成分的沸点不同,用分离液态空气法制取氧气(低温条件下加压)。
2.催化剂概念:在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。
催化剂在化学反应中所起的作用叫催化作用。
3.催化剂特点(1)“一变二不变”:改变化学反应速率(有的加快反应速率,有的减慢反应速率);自身的质量和化学性质在反应前后均没有改变。


第2单元我们周围的空气单元复习精练学校:___________姓名:___________班级:___________考号:___________一、单选题1.下列物质属于纯净物的是()A.洁净的空气B.铅笔芯C.四氧化三铁D.澄清的石灰水【答案】C【解析】A、洁净的空气中含有氧气、氮气、二氧化碳等物质,属于混合物,故A错;B、铅笔芯中含有石墨、黏土等物质,属于混合物,故B错;C、四氧化三铁中含有一种物质,属于纯净物,故C正确;D、澄清石灰水中含有氢氧化钙和水,属于混合物,故D错。
故选:C。
2.空气污染指数(简称API)就是将常规监测的几种空气污染物浓度简化成单一的数值形式,并分级表示空气污染程度和空气质量状况。
下列不计入空气污染指数的污染物是()A.二氧化碳B.二氧化硫C.可吸入颗粒物D.臭氧【答案】A【解析】计入空气污染指数的污染物是二氧化硫、一氧化碳、二氧化氮、可吸入颗粒物、臭氧。
故选A。
考点:计入空气污染指数的污染物。
3.下列物质都能在氧气中燃烧,则这些物质与氧气发生的反应属于化合反应的是()①木炭②铁③石蜡④红磷⑤硫A.①②③④⑤B.②③④⑤C.①②③⑤D.①②④⑤【答案】D【解析】由多种物质发生化学反应生成一种物质的反应叫做化合反应。
①木炭在氧气中燃烧,属于化合反应②铁在氧气中燃烧,属于化合反应③石蜡在氧气中燃烧,生成二氧化碳和水两种物质,不属于化合反应④红磷在氧气中燃烧,属于化合反应⑤硫在氧气中燃烧,属于化合反应,故选D。
4.有关氧气的收集、检验、验满,下列叙述正确的是()A.甲装置为向下排空气法,可用于收集氧气B.利用乙装置收集氧气,气体从a通入C.用燃着的木条伸入丙中,若木条熄灭表明该气体是氧气D.将带火星的木条放置于丁装置d 处可检验氧气是否集满【答案】D【解析】A.氧气的密度比空气大,应用向上排空气法来收集,故A错误;B.氧气的密度比水小,利用乙装置收集氧气,气体从b通入,故B错误;C.氧气具有助燃性,用燃着的木条伸入丙中,若木条燃烧得更旺盛,表明该气体是氧气,故C错误;D.氧气的密度比空气大,用装置丁收集氧气时,氧气从长管进入,氧气具有助燃性,将带火星的木条放置于丁装置 d 处可检验氧气是否收集满,故D正确。
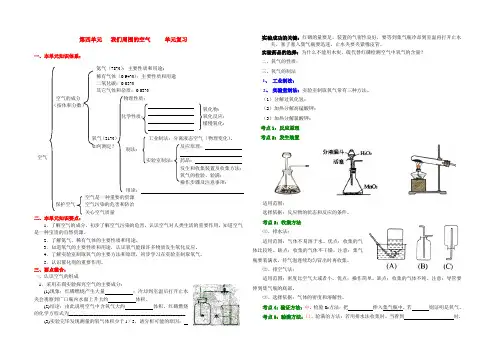
第四单元我们周围的空气单元复习一、本单元知识体系:二、本单元知识要点:1.了解空气的成分,初步了解空气污染的危害,认识空气对人类生活的重要作用,知道空气是一种宝贵的自然资源。
2.了解氮气、稀有气体的主要性质和用途。
3.知道氧气的主要性质和用途,认识氧气能跟许多物质发生氧化反应。
4.了解实验室制取氧气的主要方法和原理,初步学习在实验室制取氧气。
5.认识催化剂的重要作用。
三、要点整合:一、认识空气的组成1.采用右图实验探究空气的主要成分:(1)现象:红磷燃烧产生大量;冷却到室温后打开止水夹会观察到广口瓶内水面上升大约体积。
(2)结论:由此说明空气中含氧气大约体积,红磷燃烧的化学方程式为_______________________________________________(3)实验完毕发现测量的氧气体积少于l/5,请分析可能的原因:实验成功的关键:红磷的量要足,装置的气密性良好,要等到集气瓶冷却到室温再打开止水夹,塞子塞入集气瓶要迅速,止水夹要夹紧橡皮管。
实验药品的选择:为什么不能用木炭、硫代替红磷检测空气中氧气的含量?二、氧气的性质:三、氧气的制法1、工业制法:2、实验室制法:实验室制取氧气常有三种方法。
(1)分解过氧化氢:(2)加热分解高锰酸钾:(3)加热分解氯酸钾:考点1:反应原理考点2:发生装置适用范围:选择依据:反应物的状态和反应的条件。
考点3:收集方法⑴、排水法:适用范围:气体不易溶于水。
优点:收集的气体比较纯。
缺点:收集的气体不干燥。
注意:集气瓶要装满水,待气泡连续均匀冒出时再收集。
⑵、排空气法:适用范围:密度比空气大或者小。
优点:操作简单。
缺点:收集的气体不纯。
注意:导管要伸到集气瓶的底部。
⑶、选择依据:气体的密度和溶解性。
考点4:验证方法:中。
检验O2方法:把伸入集气瓶中,若则证明是氧气。
考点5:验满方法:口。
验满的方法:若用排水法收集时。
当看到时,空气空气的成分(按体积分数)氮气(78%):主要性质和用途;稀有气体(0.94%):主要性质和用途二氧化碳:0.03%其它气体和杂质:0.03%氧气(21%)如何测定?物理性质:化学性质:制法:工业制法:分离液态空气(物理变化)。

