《酸和碱的中和反应》教学素材(常用酸碱指示剂的变色原理)
- 格式:doc
- 大小:18.50 KB
- 文档页数:2

酸碱中和的指示剂酸碱滴定与颜色变化酸碱中和是我们在化学实验中常常遇到的一个概念。
而酸碱滴定则是一种常用的实验方法,用来确定溶液中的酸碱性质。
在酸碱滴定实验中,常常会使用到酸碱中和的指示剂,它能够在滴定过程中发生颜色变化,帮助我们判断溶液的中和点。
一、酸碱滴定实验的基本原理酸碱滴定实验是通过向待测溶液中滴加一种已知浓度的酸碱溶液,以达到化学反应的完全中和。
基于化学反应的等当点,我们可以利用物质的化学计量关系,计算出待测溶液中所含有的酸碱物质的浓度。
二、酸碱中和的指示剂及其作用原理在酸碱滴定实验中,为了判断溶液的中和点,我们通常会使用酸碱中和的指示剂。
酸碱中和指示剂是一种能够在酸碱中和反应中发生颜色变化的物质。
其作用原理主要是根据指示剂分子在酸碱溶液中的游离态和离子态之间的吸收光谱的变化。
常见的酸碱中和指示剂有酚酞、甲基橙、溴酚蓝等。
它们在不同酸碱性质的溶液中呈现出不同的颜色。
三、酸碱中和指示剂的颜色变化规律1. 酚酞是一种常用的指示剂,在酸性溶液中呈现无色或淡粉红色。
当滴加碱性溶液时,随着碱溶液的增加,酚酞逐渐呈现出深红色,直到完全中和。
2. 甲基橙是一种常用的酸碱指示剂,在酸性溶液中呈现橙色。
当滴加碱性溶液时,溶液会逐渐转变为黄色,直至中和点附近,出现由黄色到红色的过渡颜色。
超过中和点后,溶液呈现出红色。
3. 溴酚蓝是一种广泛应用于酸碱滴定的指示剂,在酸性溶液中呈现黄色或黄绿色。
当滴加碱性溶液时,溶液颜色逐渐转变为蓝色,直至达到中和点。
不同的酸碱中和指示剂在不同酸碱溶液中呈现出不同的颜色变化规律,通过观察颜色的改变,我们可以准确地判断滴定反应的中和点,从而计算出溶液中酸碱物质的浓度。
四、酸碱滴定实验的注意事项在进行酸碱滴定实验时,需要注意以下几点:1. 实验仪器要干净,避免对实验结果产生影响。
2. 滴定过程中要缓慢滴加滴定液,以避免过量滴加造成误差。
3. 指示剂的用量要适宜,过多会使溶液颜色变化过于剧烈,过少则可能无法准确判断中和点。
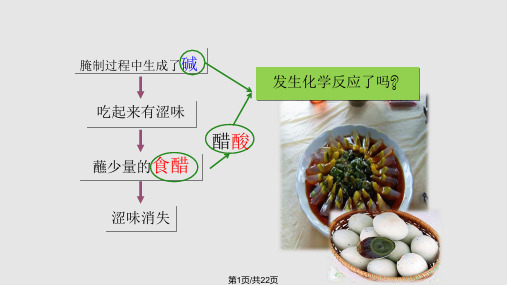


酸碱中和反应和指示剂酸碱中和反应是一种常见的化学反应,它产生水和盐。
在酸碱中和反应中,酸和碱反应后生成水和盐。
为了确定酸与碱的中和点,我们使用指示剂。
本文将介绍酸碱中和反应的原理、常用的指示剂及其作用。
一、酸碱中和反应的原理酸碱中和反应是一种氢离子(H+)和氢氧根离子(OH-)结合形成水的化学反应。
当酸与碱混合时,氢离子和氢氧根离子相互结合,生成水分子。
这个过程可以用下面的化学方程式表示:酸 + 碱→ 盐 + 水例如,将盐酸(HCl)与氢氧化钠(NaOH)混合,会产生氯化钠(NaCl)和水:HCl + NaOH → NaCl + H2O在酸碱中和反应中,酸和碱的摩尔量需要相等才能完全中和。
如果酸的摩尔量大于碱,则仍会有部分酸留下;反之,如果碱的摩尔量大于酸,则会有部分碱剩余。
二、常用的酸碱指示剂及其作用指示剂是一种化学物质,可以通过改变颜色来指示酸碱中和点的附近。
下面是几种常用的指示剂及其作用:1. 酚酞:酚酞是一种常用的酸碱指示剂,它可以在酸性溶液中呈现红色,在碱性溶液中呈现无色。
当酚酞颜色由红色转为无色时,表示酸和碱已完全中和。
2. 酸碱指示纸:酸碱指示纸是一种含有酸碱指示剂的纸片。
它可以通过改变颜色来指示溶液的酸碱性质。
常见的酸碱指示纸有红、蓝、绿三种颜色。
例如,蓝色的酸碱指示纸可以指示溶液是否为碱性,红色的酸碱指示纸可以指示溶液是否为酸性。
3. 酚酞 - 溴酚蓝指示剂:这种指示剂是酚酞和溴酚蓝两种指示剂的混合物。
它可以在酸性溶液中由红色转为黄色,然后再转为蓝色。
通过观察酸碱溶液中颜色的变化,可以确定酸碱中和点的大致范围。
4. 甲基橙:甲基橙是一种鲜橙色的指示剂,可以用来检测酸性和碱性溶液。
在酸性溶液中,甲基橙呈现红色或橙色;在碱性溶液中,甲基橙则呈现黄色。
三、酸碱中和反应的应用酸碱中和反应在生活和工业中有着广泛的应用。
下面是一些常见的应用领域:1. 酸碱中和反应在中药炮制中的应用:在中药炮制过程中,常常需要使用酸碱中和反应来提取药物中的有效成分。


酸碱指示剂变色原理酸碱指示剂是一种可以根据溶液的酸碱性质而改变颜色的化学试剂。
它在化学实验和工业生产中有着广泛的应用,常用于酸碱滴定、酸碱中和反应等过程中。
酸碱指示剂变色的原理是一种化学反应过程,下面我们来详细了解一下酸碱指示剂变色的原理。
酸碱指示剂的变色原理主要是基于指示剂分子结构的变化。
一般来说,酸性溶液和碱性溶液会影响指示剂分子的结构,从而导致颜色的变化。
酸碱指示剂通常是一种具有弱酸性或弱碱性的有机分子,它在不同的酸碱条件下会发生质子的加合或脱除,使得分子结构发生变化,从而呈现不同的颜色。
在酸性条件下,指示剂分子会接受质子,形成离子化的结构,这种结构具有不同的吸收光谱,因而呈现出不同的颜色。
而在碱性条件下,指示剂分子会失去质子,使得分子结构变为非离子化状态,其吸收光谱也会发生改变,颜色也随之改变。
以甲基橙为例,它是一种常用的酸碱指示剂。
在酸性溶液中,甲基橙呈现为红色,而在碱性溶液中则呈现为黄色。
这种颜色的变化正是由于甲基橙分子在不同的酸碱条件下发生了结构的改变,从而引起了吸收光谱的变化。
除了甲基橙,还有许多其他常用的酸碱指示剂,如酚酞、溴甲酚等,它们都具有类似的变色原理。
通过选择不同的酸碱指示剂,可以更准确地判断溶液的酸碱性质,从而在化学实验和工业生产中发挥重要作用。
总的来说,酸碱指示剂变色的原理是基于指示剂分子在不同酸碱条件下结构的变化,从而导致吸收光谱的改变,呈现出不同的颜色。
这种原理为我们准确判断溶液的酸碱性提供了重要的依据,也为化学实验和工业生产提供了可靠的手段。
通过深入了解酸碱指示剂的变色原理,我们可以更好地掌握其应用方法,提高实验和生产的准确性和效率。
酸碱中和反应的常见指示剂与选择原理酸碱中和反应是化学中常见的一种反应类型,通常需要使用指示剂来帮助判断溶液的酸碱性质。
本文将介绍酸碱中和反应中常见的指示剂以及选择原理。
一、酸碱中和反应的基本概念酸碱中和反应是指酸和碱之间发生的一种化学反应,其中酸会与碱中的氢氧根离子(OH-)结合形成水和盐。
在酸碱反应中,溶液的酸碱性质的浓度可以通过pH值来表示,pH值越低表示溶液越酸,pH值越高表示溶液越碱,pH值为7表示溶液为中性。
二、常见的酸碱指示剂1. 酚酞(Phenolphthalein)酚酞是一种常见的酸碱指示剂,它的溶液呈现无色的存在于酸性溶液中,而在碱性溶液中呈现粉红色。
这是因为酚酞分子在酸性溶液中呈现未离子化状态,而在碱性溶液中离子化形成粉红色盐酸盐。
酚酞常被用于测定酸碱中和反应的终点,当溶液中的酸已经完全与碱中的氢氧根离子中和时,酚酞的颜色从无色变为粉红色。
2. 甲基橙(Methyl Orange)甲基橙是另一种常见的酸碱指示剂,它的溶液呈现红色在酸性溶液中,而在碱性溶液中呈现黄色。
甲基橙的颜色变化基于其分子在酸性溶液中呈现阳离子状态,而在碱性溶液中呈现阴离子状态的特性。
当酸性溶液中的酸与碱中的氢氧根离子发生中和反应时,甲基橙的颜色从红色转变为黄色。
3. 酚红(Phenol Red)酚红也是常用的酸碱指示剂之一,它的溶液呈现黄色在酸性溶液中,而在碱性溶液中呈现红色。
酚红的颜色变化来源于其在酸性溶液和碱性溶液中的离子化状态的不同。
当酸性溶液中的酸与碱中的氢氧根离子发生中和反应时,酚红的颜色从黄色转变为红色。
三、酸碱指示剂的选择原理酸碱指示剂的选择依赖于所研究的酸碱体系的性质和条件。
在选择酸碱指示剂时,需要注意以下几点:1. pH范围:根据所研究的溶液的pH值变化范围来选择合适的指示剂,确保它在所需的pH范围内发生颜色变化。
2. 颜色强度:指示剂的颜色强度应适中,以便于肉眼观察。
颜色过淡会造成观察困难,颜色过浓则难以判断。
中考化学复习:《酸和碱的中和反应》考点汇总+精练!《酸和碱的中和反应》考点汇总1.中和反应的实质酸中的H+和碱中的OH-结合生成水的过程,即H++OH-=H2O。
2.实验操作、现象及结论3.实验拓展(1)指示剂的选择:酸碱中和反应的指示剂一般选用无色酚酞溶液,不选用紫色石蕊溶液,因为紫色石蕊溶液在碱性溶液中显蓝色,在中性溶液中显紫色,两种颜色的转化没有明显界限。
(2)滴定终点的判断:酸滴定碱时,酚酞作指示剂,当滴入最后一滴酸时,溶液颜色恰好由红色变为无色且半分钟内不再变色,则此时为滴定终点,酸和碱恰好完全反应。
二、知识+例题讲解知识点1.酸碱反应1.酸和碱发生反应的证据利用酸碱指示剂的变色反应进行判断,或用PH试纸测量。
如:在氢氧化钠溶液中滴加酚酞,溶液呈红色,逐渐滴加盐酸,直到红色刚好褪去,说明酸碱发生了反应;酸碱反应时,当溶液的PH等于7时,说明酸碱恰好完全反应。
2.氢氧化钠与盐酸反应生成氯化钠和水,与硫酸反应生成硫酸钠和水。
氯化钠和硫酸钠都属于盐,所以碱跟酸之间发生反应能生成盐和水。
NaOH +HCl=NaCl +H2O2NaOH +H2SO4=Na2SO4 +2H2O【注意】向滴有酚酞试液的氢氧化钠溶液中滴加盐酸时,一定要用滴管慢慢注入稀盐酸,并不断搅拌溶液,直到溶液颜色恰好变成无色为止,否则非常容易使稀盐酸过量,从指示剂的变色情况分析,当红色恰好变为无色时,溶液由碱性变为中性,说明中和反应常常伴随溶液酸碱性的改变,因此,可以利用中和反应改变溶液的酸碱性。
【例题1】下列各组物质的反应,需要加入酸碱指示剂才能判断反应是否发生的是()A.Fe和CuSO4溶液B.Zn和稀H2SO4C.NaOH溶液和稀盐酸D.澄清石灰水和CO2答案:C知识点2 酸碱反应的应用酸碱中和反应的实质是H++OH-→H2O,这一反应会放出热量。
酸碱发生反应时,溶液中的H+和OH-都减少,因而溶液的酸碱性也发生改变,因此常利用酸碱中和反应改变溶液的酸碱性并广泛应用于实际中。
酸碱指示剂与酸碱中和反应酸碱指示剂是一种常用于测定溶液酸碱性质的化学物质。
它能根据溶液的酸碱性质而呈现出不同的颜色变化,从而可以判断溶液的酸碱度。
本文将介绍酸碱指示剂的基本原理、常见的酸碱指示剂以及酸碱中和反应的相关知识。
一、酸碱指示剂的基本原理酸碱指示剂的基本原理是根据它在不同酸碱环境下的颜色变化。
酸碱指示剂通常是一种弱酸或弱碱,能够与溶液中的氢离子或氢氧根离子发生反应。
当溶液为酸性时,它会向溶液中释放出氢离子,从而导致酸碱指示剂发生颜色变化。
酸碱指示剂的颜色变化与其分子结构有关。
在酸性条件下,酸碱指示剂分子中的一个或多个基团被质子化,导致分子结构发生改变,从而呈现出不同的颜色。
在碱性条件下,酸碱指示剂会与氢离子发生中和反应,导致分子结构发生变化并展现出另一种颜色。
二、常见的酸碱指示剂1. 酚酞指示剂酚酞是一种常用的酸碱指示剂,它在酸性溶液中呈现出粉红色,在碱性溶液中呈现出黄色。
酚酞指示剂通常用于中性到弱酸性溶液的测定。
2. 甲基橙指示剂甲基橙是一种常见的酸碱指示剂,它在酸性溶液中呈现出红色,在碱性溶液中呈现出黄色。
甲基橙指示剂通常用于测定酸性溶液。
3. 酚酞蓝指示剂酚酞蓝是一种常用的酸碱指示剂,它在酸性溶液中呈现出红色,在中性溶液中呈现出紫色,而在碱性溶液中呈现出蓝色。
酚酞蓝指示剂通常用于测定酸碱中性的溶液。
4. 溴酚蓝指示剂溴酚蓝是一种常用的酸碱指示剂,它在酸性溶液中呈现出黄色,在中性溶液中呈现出绿色,而在碱性溶液中呈现出蓝色。
溴酚蓝指示剂通常用于测定中性溶液。
以上仅为常见的酸碱指示剂几种,不同的酸碱指示剂在不同的酸碱条件下会呈现出不同的颜色变化。
三、酸碱中和反应酸碱中和反应是指酸性溶液与碱性溶液反应生成盐和水的化学反应。
在酸碱中和反应中,酸性溶液中的氢离子与碱性溶液中的氢氧根离子结合,生成水分子,同时生成相应的盐。
酸碱中和反应是一种常见的化学反应,在生活和实验室中都有广泛应用。
酸碱中和反应可以通过酸碱指示剂来判断。
《酸和碱的中和反应》教学素材(常用酸碱指示剂的变色原理)
石蕊和酚酞是常用酸碱指示剂,它们都是弱的有机酸。
在溶液里,随着溶液酸碱性的变化,指示剂的分子结构发生变化而显示出不同的颜色。
石蕊能溶于水,不溶于酒精,变色范围是pH为5.0~8.0。
石蕊(主要成分用HL表示)在水溶液里能发生如下电离:
在酸性溶液里,红色的分子是存在的主要形式,溶液显红色;在碱性溶液里,上述电离平衡向右移动,蓝色的离子是存在的主要形式,溶液显蓝色;在中性溶液里,红色的分子和蓝色的酸根离子同时存在,所以溶液显紫色。
酚酞的变色范围是pH为8.0~10.O。
在酸性溶液中,H+浓度较高时,它形成无色分子;随着溶液中H+浓度的减小,OH-浓度的增大,酚酞结构发生改变,并进一步电离成红色离子,如下式所示:
这个转变过程是一个可逆过程,如果溶液中H+浓度增加,上述平衡向反方向移动,酚酞又变成了无色分子。
因此,酚酞在酸性溶液里呈无色,当溶液中H+浓度降低,OH-浓度升高时呈红色。
酚酞的醌式或醌式酸盐,在碱性介质中是很不稳定的,它会慢慢地转化成无色的羧酸盐式,如下式所示:。