金属氢氧化物的碱性与溶解度
- 格式:docx
- 大小:37.06 KB
- 文档页数:2

元素周期律碱土金属元素性质总结I•元素周期律1•周期表位置IIA族(第2纵列),在2、3、4、5、6、7周期上均有分布。
元素分别为铍(Be)-4,镁(Mg)-12,钙(Ca)-20,锶(Sr)-38,钡(Ba)-56,镭(Ra)-88。
2碱土金属的氢氧化物都是苛性较强的碱(除铍外),多存在于难用化学方法分解的化合物中,所以把它们被称为为碱土金属。
3•碱土金属在自然界均有存在且都以化合物的形式存在,前五种含量相对较多,镭为放射性元素,由居里夫妇在沥青矿中发现。
由于它们的性质很活泼,一般的只能用电解方法制取。
II.物理性质II.1物理性质通性(相似性)1•碱土金属单质皆为具金属光泽的银白色金属(铍为灰色),但暴露在空气中会因氧气的氧化作用生成氧化物膜使光泽度下降,呈现灰色。
常温下均为固态。
2•碱金属熔沸点均较低(但大于碱金属)。
硬度略大于碱金属,莫氏硬度均小于5,质软(可用小刀切割,新切出的断面有银白色光泽,空气中迅速变暗)。
•导电、导热性、延展性都较好。
3•碱金属单质的密度小(但大于碱金属),是轻金属。
II-2•物理性质递变性随着周期的递增,卤族元素单质的物理递变性有:1•金属光泽逐渐增强。
2•熔沸点逐渐降低。
3•密度逐渐增大。
硬度逐渐减小。
4•碱土金属元素晶体结构随着原子序数的增大呈现出六方密堆积〜面心立方堆积〜体心立方堆积的结构变化II.3•物理性质特性1•铍呈现灰色,属于轻稀有金属。
2•铍和镁没有焰色反应。
3•碱土金属熔沸点存在不规律性II-4.卤族元素物碱土金属熔点不规律变化的原因:影响熔点的因素有:1•价电子2•原子半径3•金属晶格结构对碱土金属来讲,晶格结构不很规律,Be,Mg为六方晶格(配位数为12),Ca\Sr为面心立方晶格(配位数12),Ba体心立方晶格(配位数8),因此变化存在不规律性II.5焰色反应1•碱土金属离子及其挥发性化合物在无色火焰中燃烧时会显现出独特的颜色(除铍、镁),这可以用来鉴定碱土金属离子的存在。

氢氧化镁综合介绍基本介绍: 氢氧化镁(化学式:Mg(OH)2、分子量58.32)是镁的氢氧化物,为白色晶体或粉末,难溶于水,广泛用作阻燃剂、抗酸剂和胃酸中和剂。
氢氧化镁在水中的悬浊液称为氢氧化镁乳剂,简称镁乳,用于中和过多的胃酸和治疗便秘。
水溶液,呈碱性。
用做分析试剂,还用于制药工业。
物化性质:白色晶体或粉末。
水溶液呈碱性。
2.36g/cm3。
溶于稀酸和铵盐溶液,几乎不溶于水和醇。
在水中的溶解度(18℃)为0.0009g/100g 。
易吸收空气中的二氧化碳。
在碱性溶液中加热到200℃以上时变成六方晶体系结晶。
在350℃分解而成氧化镁和水。
高于500℃时失去水转变为氧化镁。
沸水中碳酸镁可转变为溶解性更差的氢氧化镁。
粒径1.5-2μm ,目数10000,白度≥95。
生产工艺:1、水镁石磨细法由于由天然水镁石磨细生产氢氧化镁只是一个物理过程,因此需要较纯净的天然水镁石资源。
天然矿物水镁石的主要成分是氢氧化镁, 是一种层状结构的氢氧化物, 属于三方晶系, 常见的构造有块状、球状及纤维状, 是迄今自然界发现的含镁量最高的一种矿物。
水镁石磨细法制备氢氧化镁, 是将水镁石粉碎成水镁石粉 ( 150μm ) , 再将水镁石粉气流粉碎至 1~ 26μm 粉体 ( 由表面活性剂改性的氢氧化镁 ) 。
该氢氧化镁制造工艺简单, 价格也较低。
该方法生产的是重质氢氧化镁。
2、化学合成法化学合成法是利用含有氯化镁的卤水、卤矿等与苛性碱类物质在水介质中反应, 生成氢氧化镁浆料, 经过滤、洗涤、干燥制得氢氧化镁。
化学合成法中应用较多的方法包括氢氧化钙法、氨法、氢氧化钠法。
采用这些方法生产的是轻质氢氧化镁。
氢氧化钙法又称石灰乳法, 是以 Ca(OH)2为沉淀剂, 是一种传统的制备方法。
该法优点是原料易得, 生产工艺简单, 成本较低。
但是, 由于所得产品粒度小 (可达 0. 51μm 以下) , 聚附倾向大, 难于沉降、过滤及洗涤, 并且易吸附硅、钙、铁等杂质离子,因此产品纯度低, 只适用于对纯度要求不太高的行业, 如烟气脱硫和酸性废水中和等。

金属氢氧化物的制备和性质研究金属氢氧化物是金属元素和氢氧根离子组成的化合物,它们在化学反应中发挥着重要的作用。
本文将介绍金属氢氧化物的制备和性质研究。
一、金属氢氧化物的制备金属氢氧化物可以通过多种途径制备,比如水解、中和、氧化等。
1. 水解法水解是一种常见的制备方法,它适用于可溶性金属盐的制备。
水解的化学反应是:Mn+ + nH2O → Mn(OH)n。
2. 中和法中和法是一种将金属离子与氢氧化物中和生成金属氢氧化物的方法。
其中,氢氧化物可以是氢氧化钾、氢氧化钠、氢氧化铵等碱性物质。
3. 氧化法氧化法是将金属元素和氧气反应,生成对应的金属氢氧化物。
有些氧化物会在水中自动水解生成金属氢氧化物。
例如,氧化铝在水中水解生成氢氧化铝。
二、金属氢氧化物的性质研究金属氢氧化物的性质与其结构和化学成分有关。
本文将介绍金属氢氧化物的物理、化学性质及其应用。
1. 物理性质金属氢氧化物的物理性质与其晶体结构密切相关,在晶体中,金属离子和氢氧根离子通过氧键形成水化离子,水化离子又通过氢键和其他离子相互作用。
这些交互作用导致金属氢氧化物的热稳定性、晶体结构和颜色产生变化。
2. 化学性质金属氢氧化物的化学性质包括酸碱性、溶解度和化学反应等方面。
金属氢氧化物是一种典型的碱性物质,它们可与酸反应生成盐和水。
金属氢氧化物的溶解度通常很低,但是在一些特殊的条件下,它们可溶解于水,产生碱性溶液。
3. 应用金属氢氧化物在工业和生活中有广泛的应用。
例如,氢氧化铝是制备陶瓷的重要原料,氢氧化镁在制备医用电池、化妆品、橡胶等方面有广泛的应用。
结语本文介绍了金属氢氧化物的制备和性质研究。
金属氢氧化物是一种重要的化学物质,在工业和生活中有广泛应用。
对于金属氢氧化物的研究有助于深入了解其性质和应用,为其进一步的研究和应用提供参考。

金属溶解度ph
金属的溶解度与pH值之间存在一定的关系。
一般来说,金属的溶解度在酸性环境下较高,而在碱性环境下较低。
在酸性环境下,pH值较低,溶液呈酸性,金属离子容易与酸中的氢离子结合形成溶解态的金属离子,从而增加了金属的溶解度。
在碱性环境下,pH值较高,溶液呈碱性,金属离子容易与碱中的羟离子结合形成沉淀或固体物质,从而降低了金属的溶解度。
需要注意的是,并非所有金属在酸性环境下都会溶解,也不是所有金属在碱性环境下都会沉淀。
金属的溶解度还与金属的特性以及溶剂的性质有关。

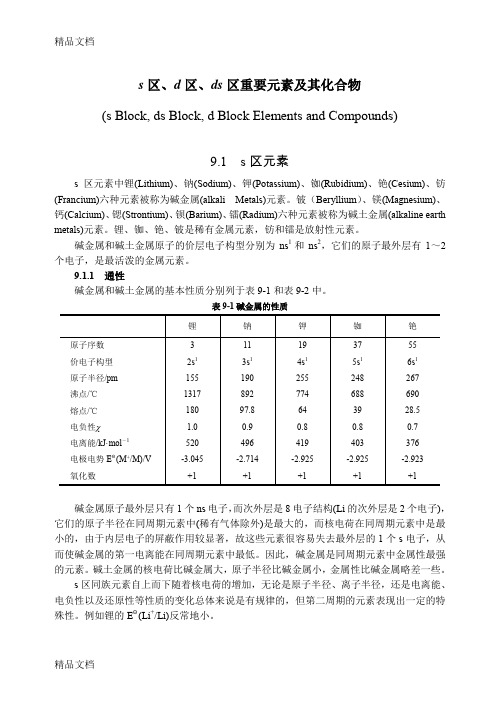
s区、d区、ds区重要元素及其化合物(s Block, ds Block, d Block Elements and Compounds)9.1 s区元素s区元素中锂(Lithium)、钠(Sodium)、钾(Potassium)、铷(Rubidium)、铯(Cesium)、钫(Francium)六种元素被称为碱金属(alkali Metals)元素。
铍(Beryllium)、镁(Magnesium)、钙(Calcium)、锶(Strontium)、钡(Barium)、镭(Radium)六种元素被称为碱土金属(alkaline earth metals)元素。
锂、铷、铯、铍是稀有金属元素,钫和镭是放射性元素。
碱金属和碱土金属原子的价层电子构型分别为ns1和ns2,它们的原子最外层有1~2个电子,是最活泼的金属元素。
9.1.1 通性碱金属和碱土金属的基本性质分别列于表9-1和表9-2中。
表9-1碱金属的性质碱金属原子最外层只有1个ns电子,而次外层是8电子结构(Li的次外层是2个电子),它们的原子半径在同周期元素中(稀有气体除外)是最大的,而核电荷在同周期元素中是最小的,由于内层电子的屏蔽作用较显著,故这些元素很容易失去最外层的1个s电子,从而使碱金属的第一电离能在同周期元素中最低。
因此,碱金属是同周期元素中金属性最强的元素。
碱土金属的核电荷比碱金属大,原子半径比碱金属小,金属性比碱金属略差一些。
s区同族元素自上而下随着核电荷的增加,无论是原子半径、离子半径,还是电离能、电负性以及还原性等性质的变化总体来说是有规律的,但第二周期的元素表现出一定的特殊性。
例如锂的EΘ(Li+/Li)反常地小。
表9-2碱土金属的性质s区元素的一个重要特点是各族元素通常只有一种稳定的氧化态。
碱金属的第一电离能较小,很容易失去一个电子,故氧化数为+1。
碱土金属的第一、第二电离能较小,容易失去2个电子,因此氧化数为+2。
在物理性质方面,s区元素单质的主要特点是:轻、软、低熔点。
金属氢氧化物的溶解度及规律
溶解度是指在一定量的溶剂中,溶质可以完全溶解所需的溶质所占容积百分比。
金属氢氧化物是以金属元素和氢氧化物元素组成的化合物,包括金属氢氧化物离子和氢氧化物离子,常见的金属氢氧化物包括氯化物、硫酸盐、氯化钡盐、氧化铜盐等等。
它们在溶剂中的溶解度取决于酸碱性,降低温度可以减小溶解度,而易溶物的溶解度也很高,尤其是大离子小质子的溶解度,包括氯化物、硫酸盐、氧氢化物等。
一般来说,金属氢氧化物的溶解度有如下规律:
(1)温度对溶解度有影响。
一般来说,随着温度升高,离子的溶解度会增加,溶质的溶解性也会增加。
然而,如果溶液的温度过高,金属氢氧化物的溶解度会急剧下降。
(2)酸碱性也会影响溶解度。
一般来说,金属氢氧化物在弱酸条件下,溶解度会比较高,强酸条件下,溶解度会比较低,甚至会达到不溶的程度。
(3)金属氢氧化物的类型也会影响溶解度。
易溶物的溶解度较大,特别是大离子小质子(如氯化物、硫酸盐、氧化物等)的溶解度会比较高,而不易溶物的溶解度较低。
(4)金属氢氧化物对溶质的溶解度会受到溶剂的影响。
在极性溶剂中,金属氢氧化物的溶解度会比较高,而在非极性溶剂中,金属氢氧化物的溶解度则会比较低。
总的来说,金属氢氧化物的溶解度由多种因素决定,包括温度、酸碱性、金属氢氧化物类型和溶剂类型等。
要正确测定金属氢氧化物的溶解度,需要考虑到上述各种因素,确保测试结果的准确性和可靠性。
碱土金属氢氧化物溶解度大小顺序碱土金属是指元素周期表中第2族元素,它们共有6个元素,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
这些元素都具有银白色的外观,在自然界中比较常见,具有一系列的重要应用。
此外,它们还有一个共同的特点,那就是在水中形成碱性溶液,这是因为它们的氢氧化物具有强碱性。
然而,这6个元素的氢氧化物不仅具有不同的强碱性,它们的溶解度也各不相同。
我将在本文中详细介绍这些元素的氢氧化物的溶解度大小顺序。
1. 氢氧化锶(Sr(OH)2)氢氧化锶是一种白色粉末,易溶于水,可在空气中吸收二氧化碳。
它在纯水中的溶解度约为12.8 g/100 mL,在25°C时,其pH值约为12.3。
由于氢氧化锶具有良好的溶解性,因此常用于制备其他锶化合物,如锶盐和锶铬酸盐等。
2. 氢氧化钙(Ca(OH)2)氢氧化钙是一种白色粉末,也称熟石灰。
它的溶解度很低,在20°C的水中溶解度仅为0.19 g/100 mL,在100°C的水中溶解度仅为0.63 g/100 mL。
然而,氢氧化钙的溶解度可被提高,方法是将其溶解在水中,使其与二氧化碳反应产生碳酸钙(CaCO3),然后再用酸将碳酸钙溶解,最终获得可溶性的氢氧化钙溶液。
3. 氢氧化镁(Mg(OH)2)氢氧化镁是一种白色粉末,也称轻质粉。
它的溶解度很低,在纯水中的溶解度约为0.008 g/100 mL,这也是为什么它常用于中和胃酸。
当氢氧化镁与胃酸反应时,会生成氯化镁和水,中和胃酸的同时减少胃酸的产生。
4. 氢氧化钡(Ba(OH)2)氢氧化钡是一种白色晶体,易溶于水。
在25°C时,氢氧化钡在水中的溶解度约为3.5 g/100 mL,其pH值约为12.4。
氢氧化钡也常用于制备其他钡化合物,如硫酸钡(BaSO4)等。
5. 氢氧化镭(Ra(OH)2)氢氧化镭是一种有放射性的白色晶体,溶解度和毒性都很高,具有较强的放射性,因此在实验室和工业生产中应谨慎使用。
氢氧化镍氢氧化铬氢氧化铁分级沉淀氢氧化镍、氢氧化铬和氢氧化铁是三种常见的金属氢氧化物,它们在水中具有一定的溶解度,可以通过分级沉淀的方式将其分离出来。
本文将详细介绍氢氧化镍、氢氧化铬和氢氧化铁的特性、分级沉淀原理及分级沉淀过程。
一、氢氧化镍氢氧化镍的化学式为Ni(OH)2,它是一种无机化合物。
氢氧化镍在水中具有一定的溶解度,溶液中含有镍离子(Ni2+)和氢氧根离子(OH-)。
氢氧化镍的溶解度与溶液的pH值有关,当溶液的pH值较低时,溶解度较高,反之溶解度较低。
氢氧化镍可以通过碱(如氢氧化钠)与镍盐(如硫酸镍)反应制备得到。
在水中,氢氧化镍会和氢氧根离子发生反应,生成固体的氢氧化镍沉淀:Ni2+ + 2OH- → Ni(OH)2↓二、氢氧化铬氢氧化铬的化学式为Cr(OH)3,它是一种无机化合物。
氢氧化铬在水中具有一定的溶解度,溶液中含有铬离子(Cr3+)和氢氧根离子(OH-)。
氢氧化铬的溶解度与溶液的pH值有关,在弱碱性条件下溶解度较高。
氢氧化铬可以通过碱(如氢氧化钠)与铬盐(如硫酸铬)反应制备得到。
在水中,氢氧化铬会和氢氧根离子发生反应,生成固体的氢氧化铬沉淀:Cr3+ + 3OH- → Cr(OH)3↓三、氢氧化铁氢氧化铁的化学式为Fe(OH)3,它是一种无机化合物。
氢氧化铁在水中具有相对较高的溶解度,溶液中含有铁离子(Fe3+)和氢氧根离子(OH-)。
氢氧化铁的溶解度与溶液的pH值有关,在酸性条件下溶解度较高。
氢氧化铁可以通过碱(如氢氧化钠)与铁盐(如硫酸铁)反应制备得到。
在水中,氢氧化铁会和氢氧根离子发生反应,生成固体的氢氧化铁沉淀:Fe3+ + 3OH- → Fe(OH)3↓分级沉淀是将多种金属离子通过逐级加入不同pH值的溶液中,使其逐步与氢氧根离子反应生成沉淀物,从而将不同离子分离出来的一种方法。
首先,将含有氢氧化镍、氢氧化铬和氢氧化铁的混合溶液逐步加入不同pH值的溶液中。
根据上述反应,当pH值较低时,氢氧化镍和氢氧化铁的溶解度较低,而氢氧化铬的溶解度较高。
一、介绍碱金属盐是指具有碱性的金属盐,主要包括氢氧化钠、氢氧化钾、氢氧化钙等。
由于碱金属盐的溶解度较小,因此在化学实验和工业生产中具有一定的特殊性。
二、溶解度较小的碱金属盐类化学式1. 氢氧化钠化学式:NaOH氢氧化钠是一种固体碱性化合物,在水中溶解度相对较小。
其溶解度为39.2g/100mL(20℃),在常温下呈固体状态。
氢氧化钠是一种强碱,在水中呈现碱性反应,常用于工业生产中的碱法制备工艺中。
2. 氢氧化钾化学式:KOH氢氧化钾是另一种常见的碱性化合物,其溶解度相对较小。
在20℃下,氢氧化钾的溶解度约为112g/100mL。
氢氧化钾具有强碱性,在工业上常用于肥皂制备、碱液制备等过程中。
3. 氢氧化钙化学式:Ca(OH)2氢氧化钙是一种固体碱性化合物,其在水中的溶解度较小。
在20℃下,氢氧化钙的溶解度约为1.7g/100mL。
氢氧化钙具有较强的碱性,在工业生产和农业生产中有着广泛的应用。
三、影响溶解度的因素1. 温度温度对碱金属盐的溶解度有一定影响。
一般来说,随着温度的升高,碱金属盐的溶解度会增加。
但是对于某些特定的碱金属盐,却可能存在溶解度随温度而减小的情况。
2. 其他物质的影响有些碱金属盐的溶解度还会受到其他物质(如盐酸、硫酸等)的影响。
这些物质会通过与碱金属盐发生化学反应或者物理作用,从而影响碱金属盐的溶解度。
四、应用由于溶解度较小的碱金属盐具有一定的特殊性,因此在实验室和工业生产中有着特定的应用:在化学合成实验中,可以利用碱金属盐的溶解度较小特点,进行相应的实验设计和操作。
在工业生产中,需要根据碱金属盐的溶解度特点,制定相应的工艺控制和生产流程。
五、结论就溶解度较小的碱金属盐而言,其化学式包括氢氧化钠(NaOH)、氢氧化钾(KOH)、氢氧化钙(Ca(OH)2)等。
在实验室和工业生产中,需要充分了解并合理应用碱金属盐的溶解度特点,从而实现更精确的实验结果和更高效的生产过程。
希望本文对您有所帮助。
金属氢氧化物的碱性与溶解度
金属氢氧化物是一类由金属离子和氢氧根离子组成的化合物,它们在水中溶解时会产生碱性溶液。
金属氢氧化物的碱性与溶解度是化学领域中一个重要的研究方向。
本文将从理论和实验两个方面探讨金属氢氧化物的碱性与溶解度。
一、金属氢氧化物的碱性
金属氢氧化物的碱性是由其离子性质决定的。
一般来说,金属离子在水溶液中会与水分子发生反应,生成金属氢氧化物和氢氧根离子。
这个反应过程可以用化学方程式表示为:
M+ + H2O → MOH + OH-
其中,M+代表金属离子。
在这个反应中,金属离子失去一个正电荷,形成了金属氢氧化物,而水分子失去一个负电荷,形成了氢氧根离子。
氢氧根离子具有碱性,因此金属氢氧化物的溶液呈碱性。
金属氢氧化物的碱性大小与金属离子的电荷和原子半径有关。
一般来说,离子电荷越大,其吸引和结合氢氧根离子的能力越强,金属氢氧化物的碱性也就越强。
此外,金属离子的原子半径也会影响其与氢氧根离子的结合能力,原子半径越小,金属离子与氢氧根离子的结合能力越强,金属氢氧化物的碱性也就越强。
二、金属氢氧化物的溶解度
金属氢氧化物的溶解度是指单位体积溶液中能溶解的金属氢氧化物的质量。
溶解度与溶剂的性质、温度和压力等因素有关。
一般来说,金属氢氧化物在水中的溶解度较高,因为水是一种极性溶剂,能够与金属离子和氢氧根离子形成氢键和离子键,促进金属氢氧化物的溶解。
金属氢氧化物的溶解度还与温度有关。
一般来说,温度升高,金属氢氧化物的溶解度会增大,因为温度升高会增加溶剂分子的运动速度和能量,促进溶质分子与溶剂分子的相互作用,有利于金属氢氧化物的溶解。
此外,金属氢氧化物的溶解度还受到压力的影响。
在常温下,压力对金属氢氧化物的溶解度影响较小,因为溶解过程中的体积变化不大。
但在高压下,金属氢氧化物的溶解度可能会有所增加。
结论
金属氢氧化物的碱性与溶解度是由金属离子的电荷和原子半径决定的。
电荷越大、原子半径越小的金属离子,其金属氢氧化物的碱性越强。
金属氢氧化物在水中的溶解度较高,且溶解度随温度的升高而增大。
压力对金属氢氧化物的溶解度影响较小。
这些研究对于理解金属氢氧化物的性质和应用具有重要的意义。
总之,金属氢氧化物的碱性与溶解度是一个复杂而有趣的研究领域。
通过深入研究金属离子的性质以及溶剂的特性,我们可以更好地理解金属氢氧化物的行为,并为其在工业和生物领域的应用提供理论基础。