最新必修二化学能与热能 导学案
- 格式:doc
- 大小:469.50 KB
- 文档页数:12

第2课时化学能与热能的相互转化
【考点要求】掌握化学能与热能的相互转化
【教学目标】学会判断吸热反应与放热反应
1.化学反应中的能量变化有多种形式,但通常主要表现为________的变化。
因此化学反应分为两类:__________反应和________反应。
请填写下表:
实验探究:按照下列各实验的操作步骤,完成各实验并将观察到的实验现象及其实验结论填入表中。
(1)铝与盐酸反应
(2)Ba(OH)2·8H2O与NH4Cl晶体反应
(3)NaOH与盐酸的反应
【归纳总结】
吸热反应与放热反应的判断方法:
(1)根据反应类型判断
①化合反应一般为________________;
②需要加热的分解反应一般为________________;
③中和反应为________________。
(2)记住一些特殊反应
①Ba(OH)2·8H2O晶体和NH4Cl晶体反应吸热;
②所有的燃烧反应都是________________;
③活泼金属与水或酸的反应为________________。
【活学活用】
1.下列反应中,属于放热反应的是________,属于吸热反应的是________(填序号)。
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO) ②燃烧蜂窝煤取暖③炸药爆炸④硫
酸与氢氧化钾溶液反应⑤生石灰与水作用制熟石灰⑥食物腐败⑦碳与水蒸气反应制得水煤气
2.下图中,能表示灼热的炭与二氧化碳反应的能量变化的是( )。

第2课时化学能与热能的相互转化1.通过实验认识化学能可以转化为热能。
2.认识常见的吸热反应和放热反应。
3.了解化学能转化为热能在生产、生活中的应用及其对人类文明发展的贡献。
4.了解测定中和热的方法。
5.树立能量守恒的化学思想。
考虑到学生学习的阶段性和层次性,课程标准中关于化学能与热能的转化及中和热测定的教学侧重定性分析和描述。
同时认真做好书本上的三个实验,让学生学会定性地研究化学反应中能量变化的科学方法。
1.两个基本的自然定律——质量守恒定律和能量守恒定律(1)质量守恒定律:自然界中的物质发生转化时①总质量保持不变。
(2)能量守恒定律:不同形式的能量发生转换时②总能量保持不变。
化学能是能量的一种形式,可以转化为③热能和④电能等。
2.吸热反应和放热反应化学能转化为热能时,化学反应通常可分为⑤吸热反应和⑥放热反应。
当反应物的总能量大于生成物的总能量时,该反应是⑦放热反应,当反应物的总能量小于生成物的总能量时,该反应是⑧吸热反应。
3.实验探究(1)铝和稀盐酸反应实验现象有⑨气体产生;用温度计测量,其水银柱⑩上升离子方程式2Al+6H+2Al3++3H2↑实验结论该反应是放热反应(2)氢氧化钡晶体与氯化铵反应实验现象闻到刺激性气味,烧杯壁变冷,玻璃片和烧杯粘在一起,混合物呈糊状化学方程式Ba(OH)2·8H2O+2NH4Cl BaCl2+2 NH3↑+10H2O实验结论该反应是吸热反应(3)盐酸与氢氧化钠反应实验现象混合后溶液比原两种溶液的温度高离子方程式H++OH-H2O实验结论该反应是放热反应1.化学反应中的能量变化除转化为热能外还可以有哪些形式?【答案】化学反应中化学能还可以转变为电能、光能等。
2.化学反应中有许多反应需要加热才能进行,是不是需要加热才能进行的反应一定是吸热反应?【答案】不一定;判断某反应是吸热反应还是放热反应,不能通过反应的条件(是否需要加热)来判断,需要加热才能进行的反应也有可能是放热反应,如铝热反应、燃烧反应等。

第二章第一节化学能与热能(第2课时)学习目标:1.理解能量变化的主要原因2. 在化学实验的基础上,理解化学能与热能的相互转化学习重、难点:通过实验理解化学能与热能的相互转化,了解中和热的测定实验和能源的分类【预习案】【导学流程】(一)基础过关1.化学能与热能的相互转化物质燃烧化学能热能加热KClO3分解※化学反应中的能量变化通常表现为热量的变化——吸热或放热(反应热)。
(1)反应热:①定义:②符号:△H③单位:kJ·mol-1④计算:△H == 生成物的总能量-反应物的总能量。
(2)放热反应:和吸热反应①放热反应:化学反应过程中反应叫放热反应.。
②吸热反应:化学反应过程中反应叫吸热反应.。
(3)中和热定义(二)我的疑问【探究案】一.对议【实验探究】化学能与热能的转化[实验2—1]在一支试管中加入2~3mL 6mol·L-1的盐酸,再插入用砂纸打磨光的铝条,观现象并用温度计测量温度变化,填表:[实验2—2]在50mL烧杯中加入20mL 2mol·L-1的盐酸,测其温度。
再另用一支量筒取20mL 2mol·L-1的NaOH溶液,测其温度,并缓缓地倾入烧杯中,边加边用玻璃棒搅拌,观察反应中溶液温度变化,并作好记录。
二.组议【实验2—3】将约20gBa(OH)2·8H2O晶体研细后与10gNH4Cl晶体,一起放入烧杯中,并将烧杯放在敌有几滴水的玻璃片(或小木板上),用玻璃棒搅拌,闻气味,用手触摸杯壁下部,试着用手拿起烧杯,观察现象,填表反应的化学方程式:Ba(OH)2·8H2O + 2NH4Cl == BaCl2+ 2NH3↑+ 10H2O【常见的放热反应和吸热反应】☆ 常见的放热反应:① 所有的燃烧反应② 酸碱中和反应③ 大多数的化合反应④ 金属与酸的反应⑤ 生石灰和水反应☆ 常见的吸热反应:①晶体Ba(OH)2·8H2O与NH4Cl 反应② 大多数的分解反应③ 以H2、CO、C为还原剂的氧化还原反应放出热量:浓硫酸稀释、氢氧化钠固体溶解等(强酸、强碱的水化热大)※溶解过程吸收热量:铵盐溶解等。
化学能与热能的相互转化学习目标1、掌握化学反应中能量变化的主要表现形式和化学反应中能量转化的实质,能说出常见的能量转化形式。
能根据事实判断吸热反应、放热反应。
b5E2RGbCAP2、在实验和探究学习的过程中,能够发现并提出化学能与热能的探究性问题,培养归纳总结的能力。
3、通过实验培养学习化学的兴趣,进一步形成交流、合作、反思、评价的学习习惯。
重点:吸热反应、放热反应的概念。
难点:准确判断吸热反应、放热反应和中和热。
课前预习使用说明和学法指导1、依据预习案通读教材,进行知识梳理;了解化学能与热能的相互转化,了解化学能转化为热能在生产、生活中的应用及其对人类文明发展的贡献。
plEanqFDPw2、认真完成预习自测,将预习中不能解决的问题标记出来,并填写到后面“我的疑惑”处。
3、利用15分钟高效完成。
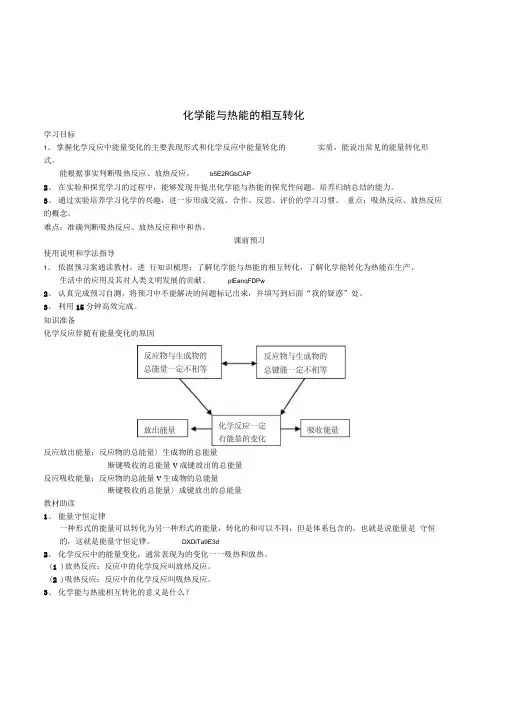
知识准备化学反应伴随有能量变化的原因反应放出能量:反应物的总能量〉生成物的总能量断键吸收的总能量v成键放出的总能量反应吸收能量:反应物的总能量v生成物的总能量断键吸收的总能量〉成键放出的总能量教材助读1、能量守恒定律一种形式的能量可以转化为另一种形式的能量,转化的和可以不同,但是体系包含的,也就是说能量是守恒的,这就是能量守恒定律。
DXDiTa9E3d2、化学反应中的能量变化,通常表现为的变化一一吸热和放热。
(1 )放热反应:反应中的化学反应叫放热反应。
(2 )吸热反应:反应中的化学反应叫吸热反应。
3、化学能与热能相互转化的意义是什么?4、人类利用能源包含哪三个阶段?我们现在处于哪个阶段?预习自测1、下列关于能量转化的认识中不正确的是()A、电解水生成氢气和氧气时,电能转化为化学能B、绿色植物进行光合作用时,太阳能转化为化学能C、煤燃烧时,化学能主要转化为热能和光能D 、白炽灯工作时,电能全部转化为光能2、人类对于能源的利用大致分为三个时期:柴草时期、化石能源时期、多能源结构时期。
以下说法正确的是()RTCrpUDGiTA、原始社会人类学会了利用火,他们以天然气取暖,吃熟食,从事生产活动B 、目前我国广大农村生活使用的能源都是化石燃料C、多能源结构时期指的是新能源时期,包括核能、太阳能、氢能等D 、化石燃料的燃烧没有污染我的疑惑请将预习中不能解决的问题写下来,供课堂解决。

优质资料---欢迎下载第一节化学能与热能【环节一】“感知冷暖”实验操作实验现象有关化学(或离子)方程式向一支试管中放入用砂纸打磨光亮的镁条,加入5 mL 2 mol•L-1盐酸,用手触摸试管外壁,有什么感觉?离子方程式:____________向双层保鲜袋加入约20g研磨的氢氧化钡晶体,再加入约10g氯化铵晶体,玻璃棒搅拌,使之充分混合。
扎紧袋口,用手触摸保鲜袋,有什么感觉?化学方程式:______________________在50mL烧杯中加入15mL2mol•L-1盐酸。
另取15mL 2 mol•L-1NaOH溶液,缓缓的倾入烧杯中,边加边用玻璃棒搅拌。
观察溶液温度与空气温度相同吗?离子方程式:____________结论化学反应伴随着____________变化,有的_________能量,有的___________能量。
化学上,把有______________的化学反应称为放热反应,把_____________的化学反应称为吸热反应。
【环节二】追根朔源1.宏观角度---化学反应的能量变化与物质内部能量的关系(1)图Ⅰ中反应物内部的总能量_______生成物内部的总能量,反应________能量。
(2)图Ⅱ中反应物内部的总能量_______生成物内部的总能量,反应________能量。
2.微观角度---从化学键的断裂与形成理解放热、吸热反应(右图)(1)若E1>E2,反应________能量;(2)若E1<E2,反应________能量。
(原理图)(原理图)【环节三】应用拓展1.根据下表的数据,通过计算判断天气燃烧反应CH4+2O2=CO2+2H2O是吸热反应还是放热反应?2.电影院的幕布用浓氯化铵溶液处理过而不易着火,原因在哪里?3.天然气燃烧是放热反应,为什么天然气要点燃才能燃烧?推而广之,需要加热的反应都是吸热反应吗?【环节四】联系生产我国煤炭资源十分丰富,煤转化为水煤气的主要反应: C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3 kJ·mol-1该反应式表示的意义是1molC转化为1molCO和H2吸收131.3kJ热量。

第二章化学反应与能量《第一节化学能与热能》导学案乾县二中李强班级:姓名:【学习目标】1、能从化学键的角度理解化学反应中能量变化的主要原因2、通过化学能与热能的相互转变,理解“能量守恒定律”3、、通过实验知道化学反应中能量变化的主要表现形式,能根据事实判断吸热反应、放热反应。
4、通过实验探究体验科学研究的一般过程,了解科学研究的基本方法【知识链接】一、化学反应和物质能量的关系【自学解答】自学教材P33页图2-1,解决以下问题。
1.各种物质都储存有_______能,不同的物质储存的_________不同。
2.当反应物总能量>生成物总能量时,反应为反应;当反应物总能量< 生成物总能量时,反应为反应。
根据能量守恒定律,反应物的总能量(E反)、生成物总能量(E生)、放出的能量(E)之间的关系:放热反应中:吸热反应中:二、化学键和化学反应中能量变化的关系【自学解答】阅读教材P32-33页内容,讨论、交流解决如下问题。
请你以H2和Cl2化合生成HCl的反应为例从化学键角度分析其中的能量变化。
1.断开化学键吸收能量1molH2中含有H—H键,常温常压下使1molH2变为2molH原子断开了H—H键,需要436KJ的热量。
2.形成化学键放出能量由2molH原子生成1molH2,有H—H键生成,生成过程中向外界436KJ的热量。
小结:形成1molH—H键释放的能量与断开1molH—H键吸收的能量。
3.化学变化中能量变化的主要原因——微观方面⑴化学键的和是化学反应中能量变化的主要原因。
⑵化学反应的实质是旧化学键的和新化学键的。
4.反应能量变化的判定——宏观方面(教材P33页图)⑴各种物质都储存有能。
⑵反应物的总能量>生成物的总能量,反应能量。
⑶反应物的总能量<生成物的总能量,反应能量。
5.两条基本的自然定律⑴质量守恒定律:。
⑵能量守恒定律:。
⑶质量与能量是相互联系的(),故统称为。
6.放热反应和吸热反应⑴化学反应中的能量变化,通常主要表现为的变化——或者。

必修2第二章化学反应与能量第一节化学能与热能导学案(第1课时)预习课本P32—P331、断开化学键能量,形成化学键能量;反应物的总能量〉生成物的总能量,反应能量,反应物的总能量〈生成物的总能量,反应能量。
2、放热反应:的化学反应;吸热反应:的化学反应。
【练习】:1.当两个原子形成化学键时,原子的能量将()A.升高B.降低C.保持不变D. 一个升高一个降低2.已知反应:2H2 + 0.2 = 2也0 +能量,请填写下列表格中空白处的总能量值,并注明吸收还是放出。
有关键能:H—H: 436 kj/mol 0—0: 496 kj/mol H—0: 463 kj/mol1.共消耗1368 kJ 共释放1852 kJ 放热484 kJ3.已知反应物的总能量高于产物的总能量,则反应是()A.放热反应B.吸热反应C.有催化剂作用D.无法判断4.已知反应A + B = C + D为放热反应,对该反应的下列说法中正确的是()A.A的能量一定局于CB.B的能量一定高于DC.A和B的总能量一定高于C和D的总能量D.该反应为放热反应,故不必加热就一定能发生5.在相同的条件下,使相同物质的量的下列物质分解,需要消耗能量最多的是:()A.HFB. HC1C. HBrD. Hl【小结与思考】:1、一个化学反应的实质是什么?2、那么这个化学反应的能量变化可以从哪些方面来判断?1: ______________________________________________________. 2:一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于的相对大小。
EE (反应物)>EE (生成物)——能量;EE (反应物)<EE (生成物)——能量。
A. 。
2的能量一定高于S02的能量B. SO,和0,的总能量一定高于S03的总能量C. S02的能量一定高于S03的能量D. 因该反应为放热反应,故不必加热就可发生3、如何理解这两个方面?化学能与热能第一课时练习题(A )1.下列各图中,表示正反应是吸热反应的图是: 能登( )2.放热反应一定是A. 断开反应物中的化学键吸收的总能量比形成生成物中的化学键放出的总能量 少 B. 贮存能量C. 反应物的总能量高于生成物的总能量D. 反应物的总能量低于生成物的总能量( )3 .已 知_^2S02+02 2SO3为放热反应,对该反应的下列说法中正确的是:)商应物生成物反应过程产物H 20所具有的总能量高于反应物H?和O2所具有的总能量 反应物也和d 所具有的总能量高于产物H.0所具有的总能量 反应物H,和所具有的总能量等于产物H ;:0所具有的总能量 反应物扇和。

第一节化学能与热能(第2课时)【学习目标】1.了解化学反应中热量变化的实质,理解化学反应吸热或放热的原因。
2.了解化学能与热能的相互转化,理解中和热的概念。
3.了解人类能源利用的历史和前景,提高节能意识。
【自主学习】二、化学能与热能的相互转化1.两个基本自然规律——“质量守恒”和“能量守恒”(1)质量守恒定律:自然界中的物质发生转化时________________保持不变。
(2)能量守恒定律:不同形式的能量发生转换时________________保持不变。
2.吸热反应和放热反应(1)定义吸热反应:________热量的化学反应;放热反应:________热量的化学反应。
(2)实验探究①铝和稀盐酸的反应实验现象有____产生;用温度计测量,水银柱____离子反应实验结论活泼金属与酸反应是________反应②Ba(OH)2·8H2O和氯化铵反应闻到________气味,烧杯壁________;玻璃片和烧杯______,混合物实验现象呈________化学反应实验结论该反应是________反应③盐酸与氢氧化钠反应实验现象混合后溶液温度比原两种溶液的温度高离子反应实验结论酸碱中和反应是________反应3.中和热酸和碱发生中和反应生成________水时所释放的热量。
4、常见的放热反应和吸热反应放热反应:_______________、_______________、_______________、_______________、及物质的缓慢氧化等。
吸热反应:大多数的_______ 反应、____________的氧化还原反应、___________的复分解反应等。
易错点提示(1)“三个不一定”。
①需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;②放热反应常温下不一定容易发生,如铝热反应;③吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。

第二章化学反应与能量2.1 化学能与热能2.1.1 化学键在化学反应中能量变化的关系【本课时学习目标(导)】1.知道化学键的断裂与形成是化学反应中能量变化的主要原因;2.知道反应物与生成物总能量的相对高低是反应过程中能量变化的决定因素【自主思考(思)】阅读课本P32正文第一段,完成下列内容:1.化学反应中能量变化的原因——微观角度(1)化学反应的实质化学反应的过程就是旧化学键的断裂和新化学键的形成过程。
(2)化学反应中的能量变化①原因②实例断裂1 mol 键③436 kJ能量;形成1 mol 键④436 kJ能量。
断裂4 mol 键⑤1660 kJ能量;形成1 mol 键⑥415 kJ能量。
结论:化学反应中能量变化的主要原因是⑦。
阅读课本P32正文第二、三段以及P33图2-1,完成下列内容:2.化学反应中能量变化的决定因素——宏观角度结论:化学反应中的能量变化取决于⑩。
【小组合作学习(议、展)】1.试从化学键的角度阐释化学反应中是否一定有能量的变化?为什么?[学习笔记]2. 从化学键角度如何理解吸热和放热反应?从总能量的角度如何判断放热与吸热反应?3. 常温常压下,断开1molH-H 键变成H 原子要 436 kJ 的热量; 断开1molC-H 键要 415 kJ 的能量,那么断开1molCH 4中的所有 C-H 键要吸收 kJ 的能量。
H 2和CH 4谁更活泼?4. 物质的能量(即物质所储存的化学能)与其化学活性(即化学性质稳定 /活泼)的关系?5.如下图所示,A 图表示 放 热反应,B 图表示 吸 热反应。
试分析a b c 表示的含义?a b cA 图B 图【课堂训练(检)】探究:定量分析反应中能量的变化1、判断1 mol A 2分子与2 mol A 原子的能量大小?2、若已知反应:A 2+B 22AB 放出a kJ 能量,则反应:2ABA 2+B 2的能量变化情况如何?3、化学反应A 2+B 2=2AB 的能量变化如图所示,则下列说法正确的是( )[学习笔记]A.该反应过程吸收能量B.断裂1molA-A键和1molB-B键可放出x kJ能量C.断裂2molA-B 键需要吸收y kJ能量D.2molAB 的总能量高于1mol A2和1molB2的总能量4、已知H—H键、Cl—Cl键和H—Cl键的键能分别为436 kJ·mol-1、243 kJ·mol-1和431 kJ·mol-1,由此可知,由1 mol Cl2和1 mol H2生成2 mol HC l的反应过程中( )。

第二章第一节化学能与热能导学提纲(2)化学能与热能的相互转化【学习目标】1.了解能量守恒定律2.会判断常见的吸热反应与放热反应3.理解中和热的定义及了解中和热测定的实验操作4.了解人类利用能源的情况及一次能源与二次能源的概念【重点】会判断常见的吸热反应与放热反应,中和热的定义的理解。
【难点】中和热的定义的理解【导学流程】一.了解感知(导1,思18)导:我们在初中学习过“质量守恒定律”,知道自然界的物质可以发生转化,但是总质量保持不变,那么能量是否也可以转化呢?思:先看视频,后阅读教材P323-36,完成下列问题:1、填写教材P34的实验2-1、2、3表格。
2、两条基本的自然定律(1)质量守恒定律:自然界的物质发生转化时,不变。
(2)能量守恒定律:一种形式的能量可以转化为另一种形式的能量,但体系的不变。
3.写出实验2-1、2-3的离子方程式及2-2的化学反应方程式:、,。
4.化学能与热能的相互转化化学物质中的通过化学反应转化成,是人类生存和发展的动力之源。
转化成是人们进行化工生产、研究新物质不可缺少的条件和途径。
5.人类利用能源的三个阶段(1).时期该时期从火的发现至18世纪产业革命,以树枝杂草为主要能源。
(2).时期从18世纪中期到现代,以为主要能源。
(3)时期以可再生能源和清洁能源( 能源)为主要能源,主要包括等。
6.中和热的定义:。
二.深入学习(议8、展6、评7)1.常见的放热反应有哪些(5点):。
2.常见的吸热反应有哪些(4点):。
3.中和热的定义中要注意哪些关键词。
三、迁移运用(5)1.整理记忆(2分钟)2.下列说法正确的是()A.1mol硫酸与足量氢氧化钠溶液充分反应放出的热量为中和热B.浓硫酸溶于水是放热反应C.水蒸汽变为液态水不是放热反应,这个变化过程要放热D. 吸热反应需要加热才能进行,而放热反应不需加热就可以进行3.教材P37第4、5、6、8、10题。

第二章第一节化学能与热能【学习目标】1.认识化学键断裂与形成是化学反应中能量变化的主要原因;了解物质总能量是化学反应中能量变化的决定因素;2.理解并掌握判断吸热和放热反应的两条理论根据;了解化学能与热能的相互转化关系;【学习重难点】理解并掌握判断吸热和放热反应的两条理论根据;会判断吸热和放热反应课前预习案(限时25分钟)【问题导学】一、化学键与化学反应中能量的变化的关系(认真阅读教材,完成以下问题)1.物质中的原子之间是通过相结合的。
化学反应从化学键的角度分析,就是旧的化学键的断裂、新的化学键的形成的过程。
断键和成键都伴随着能量的变化。
当物质发生反应时,断开反应物中的化学键要能量,而形成生成物的化学键要能量。
如:2H→H-H 436 kJ能量H-H→2H 436 kJ能量C-H→C+H 415kJ能量CH4→C+4H 吸收kJ能量2.化学反应中能量变化的主要原因是:,断裂化学键要吸收能量,形成化学键要放出能量,物质的化学反应与体系的能量是发生的。
各个物质因为具有不同的组成、结构,所含不同,反应时能量变化也就不同。
3.断键吸收的总能量___ 成键放出的总能量,则化学反应放出能量;断键吸收的总能量_____ 成键放出的总能量,则化学反应吸收能量。
4. 一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的_________与生成物的_________的相对大小∑E(反应物)_______∑E(生成物)——放出能量∑E(反应物)________∑E(生成物)——吸收能量二、放热反应和吸热反应6.化学反应过程中遵循两个守恒:守恒和守恒。
化学反应中的能量变化可以通过光能、电能、热能等形式表现出来,通常主要表现为的变化。
7.化学上把有热量放出的化学反应叫做反应;由热量吸收的反应叫做反应。
查阅资料,举例说明放热反应有哪些?吸热反应呢?【预习检测】1.下列有关化学反应中能量变化的理解,正确的是()A.凡是伴有能量的变化都是化学变化B.在化学反应过程中,能量的变化只能表现为热量的变化C.在确定的化学反应中,反应物的总能量一定不等于生成物的总能量D.在确定的化学反应中,反应物的总能量总是高于生成物的总能量2.下列物质加入水中显著放热的是( )A.生石灰B.固体NaCl C.无水乙醇D.固体NH4NO3 3.对于放热反应,下列说法正确的是( )A.产物H20所具有的总能量高于反应物H2和O2所具有的总能量B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量D.反应物H2和O2具有的能量相等4.下列对化学反应的认识错误的是()A.会引起化学键的变化B.会产生新的物质C.必然引起物质状态的变化D.必然伴随能量的变化课内探究案〖合作探究1〗是否任何化学反应中都会有能量的变化?〖合作探究2〗已知:断开1molH-H键,需要吸收436KJ能量,断开1molCl-Cl键需要吸收243KJ能量,形成1molH-Cl键需要释放431KJ能量。
化学能与热能学案(第一课时)班级姓名学习目标1、能从化学键的角度理解化学反应中能量变化的主要原因2、通过化学能与热能的相互转变,理解“能量守恒定律”3、能从微观的角度来解释宏观化学现象,进一步发展想象能力。
4、初步建立起科学的能量观,加深对化学在解决能源问题中重要作用的认识。
【知识回顾】1、什么是化学键?化学反应的本质是什么?(化学键观点)【学与问】煤、石油、天然气的主要化学成分是烃类等有机物,它们燃烧所产生的热能从何而来?这种热能与化学物质及化学反应有什么关系?石灰石要经过高温煅烧才能变成生石灰,高温提供的热能在石灰石的分解反应中起什么作用?【自主学习】一、化学键与化学反应中能量变化的关系1、化学键的断裂和形成与化学反应中能量的变化[学生思考、讨论] 从化学键断裂和形成角度分析氢气和氯气反应过程中吸收还是放出能量(阅读课本32页)。
【提示】断开1molH-H键要吸收436kJ的能量; 断开1molCl —Cl键要吸收243kJ 的能量;形成1molH —Cl键要放出431kJ的能量。
[归纳小结](1)化学反应中能量变化的主要原因(化学键角度)(2) 断键吸收的总能量____成键放出的总能量,则化学反应放出能量断键吸收的总能量_____成键放出的总能量,则化学反应吸收能量2、从化学反应中反应物和生成物的总能量的大小考虑【阅读课本32-33页能量变化图】【小结】(1)、一个确定的化学反应在发生过程中是吸收能量还是放出能量取决于(2)、画出反应物、生成物总能量的大小与反应中能量变化的关系示意图反应物的总能量___生成物的总能量,则化学反应放出能量反应物的总能量___生成物的总能量,则化学反应吸收能量3、放热反应和吸热反应(化学反应中的能量变化一般表现为热量变化)放热反应:吸热反应:[课堂小结]放热反应:化学反应中_____能量的反应。
断键吸收的总能量_____成键放出的总能量的反应或反应物的总能量____生成物的总能量的反应。
第一节《化学能与热能》导学案【学习目标】1、知道化学键的断裂和形成是化学反应中能量变化的主要原因。
了解吸热反应和放热反应。
通过生产、生活中的实例了解化学能与热能的相互转化。
2、通过实验活动及结果分析获得正确的认识。
通过逐步深入的讨论交流建立知识结构。
通过实际应用检验学习成果,体验学习成就。
3、在实践中获得学习成果,体验科学认知过程。
共享信息,形成互助的学习氛围,提高个体学习的责任感。
【重点难点】重点:化学反应中能量变化的主要原因以及化学能转化为热能的重大意义。
难点:从本质(微观结构角度)上理解化学反应中能量的变化,从而建立起科学的能量变化观。
【学法指导】问题探究、比较推理、讨论归纳【知识链接】已经学习过的化学反应过程中伴随的热量变化【学习过程】一、实验探究实验目的:探究化学反应过程中的能量变化【思考】:物质发生化学反应的同时还伴随着能量的变化,而这些能量变化通常又表现为热能变化。
为什么有的化学反应吸热,而有的化学反应放热?二、预测分析1、各种物质都储存有化学能,不同的物质储存的化学能不同。
..........................看书33页图示:当反应物总能量>生成物总能量时,反应为反应;当反应物总能量< 生成物总能量时,反应为反应。
根据能量守恒定律,反应物的总能量(E反)、生成物总能量(E生)、放出的能量(E)之间的关系:放热反应中:吸热反应中:例:已知H2和Cl2反应生成HCl是放热反应,比较反应物H2和Cl2的总能量(E反)与生成物HCl的总能量(E生)之间的大小关系:2、强酸与强碱反应的实质是H++OH-=H2O,中和反应是放热反应。
酸与碱发生生成称为中和热。
3、大胆预测:化学反应中的能量从哪里来?.............请你以H2和Cl2化合生成HCl的反应为例从化学键角度分析其中的能量变化。
已知该反应为放热反应,则拆开化学键需要的总能量(E拆)、形成化学键的总能量(E成)与放出的能量(E)之间的关系:。
第一节化学能与热能重点:化学能与热能之间的内在联系以及化学能与热能的相互转化。
中和热的测定。
难点:1、从本质上〔微观结构角度〕理解化学反响中能量的变化,从而建立起科学的能量变化观。
2、理解运用吸热反响和放热反响的定义 探究一 化学反响中的能量变化1.宏观:化学反响中能量变化的原因—— 和 的总能量相对大小①反响物的总能量 生成物的总能量,反响 能量。
②反响物的总能量 生成物的总能量,反响吸 能量。
化学反响中的能量变化遵循能 。
2. 微观:化学反响中能量变化的原因——化学键的 和 一个化学反响的的过程,本质上就是 和 的过程 拆开化学键: 热量〔吸收或放出〕 形成化学键: 热量〔吸收或放出〕 所以:一个化学反响是放热还是吸热取决于什么呢?取决于所有的总能量与所有的总能量的相对大小例如:H2+Cl2==2HClH2〔H-H 〕断裂成为要热量〔吸收或放出〕Cl2〔Cl-Cl 〕断裂成为要 热量〔吸收或放出〕由 和 结合成H-Cl要热量〔吸收或放出〕①断开化学键吸收的总能量 形成化学键释放出的总能量,反响 能量。
②断开化学键吸收的总能量 形成化学键释放出的总能量,反响 能量。
练习:化学键变化 能量变化拆开1molN≡N 吸收942kJ拆开1molH —H吸收436kJ形成1molN —H 放出391kJ那么反响:N +3H===2NH 的能量变化即该过程要〔吸收或放出〕kJ热量。
2 2 33.键能在,25℃条件下,断开1molAB 为A 、B 时 的能量称为A-B 键的键能。
通常,键能越大,键越 ,由该键构成的分子也愈 , 该分子能量就愈 。
Q=反响物的键能之和-生成物的键能之和Q>0 ,要 热量〔吸收或放出〕Q<0 ,要 热量〔吸收或放出〕 练习:在反响H+Cl 2 =2HCl 中,H -H 键能为436kJ ,Cl -Cl 键能为247kJ ,H -Cl 键能为431kJ ,判断 2该反响是〔〕A.吸热反响 B.放热反响 C.吸收179kJ热量 D.放出179kJ热量探究二化学能与热能的相互转化1、两条根本的自然定律;。
人教版高中化学必修二第二章第一节化学能与热能【学习目标】1.知道化学键的断裂和形成是化学反应中能量变化的主要原因2.通过生产、生活中的实例了解化学能与热能的相互转化3.理解中和热的概念,学会定性和定量的研究化学反应中热量变化的科学方法2.拓宽学生的科学视野,使学生建立正确的能量观,提高节能意识。
【学习重点】化学能与热能之间的内在联系以及化学能与热能的相互转化[基础知识]一、化学键与化学反应中能量变化的关系[复习] 化学键:_____________________________________________*键能:拆开 1 mol某键所需的能量叫键能。
单位:kJ/mol。
化学键的形成蕴涵着能量变化,在进行反应时化学键要断裂,吸收能量,反应后形成新化学键要放出能量,反应前反应物能量与反应后生成物能量不相等。
[分析]2H→H2中能量变化?1mol H2中含有1molH-H,在250C 101kPa条件下,由H原子形成1molH-H要_______436kJ的能量,而断开1molH-H重新变为H原子要_______436kJ的能量。
[类比分析]CH4→4C+4H(吸收4mol×415kJ/mol=1660kJ)[小结]:化学键的_____________是化学反应中能量变化的主要原因。
[小结]:化学反应的特点:1.有新物质生成,新物质和反应物总能量不同。
2.反应中要遵循能量守恒。
3.反应物与生成物的能量差若以热能形式表现即为放热和吸热。
如果二者能量比较接近,则放热和吸热不明显。
[讨论]为什么有的化学反应会放出热量,而有的化学反应却需要吸收热量呢?[结论] 一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的_________与生成物的_________的相对大小∑E(反应物)_______∑E(生成物)——放出能量∑E(反应物)________∑E(生成物)——吸收能量二、化学能与热能的相互转化放热反应:______热的化学反应化学反应吸热反应:______热的化学反应[实验2-1][实验记录]实验步骤*眼睛看到的现象用手触摸的感觉用温度计测量的数据在一支试管中加入2~3mL6mol/L的盐酸溶液向含有盐酸溶液的试管中插入用砂纸打磨光的铝条结论[思考讨论]1.铝与盐酸反应的化学方程式:___________________ 。
第二章化学反应与能量第一节化学能与热能【学习目标】1、能从化学键的角度理解化学反应中能量变化的主要原因2、通过化学能与热能的相互转变,理解“能量守恒定律”学习重点:化学反应中能量变化的主要原因以及化学能转化为热能的重大意义。
学习难点:从本质上(微观结构角度)理解化学反应中能量的变化,从而建立起科学的能量变化观。
【自主预习】梳理知识,夯实基础[温故]1.化学键的分类:2.化学反应的本质(从化学键的角度分析):一、化学键与化学反应中能量变化的关系1.化学反应中能量变化的原因(1)物质中的原子之间是通过________结合的。
(2)断开反应物中的化学键要_______能量;形成生成物中化学键要_______能量。
(3)化学键的_____________________是物质在化学反应中发生能量变化的主要原因。
二、化学能与热能的相互转化1.两条基本的自然定律(1)质量守恒定律:自然界的物质发生转化时,_______不变(2)能量守恒定律:一种能量可以转化为另一种能量,但是体系包含的_______不变。
2、各种物质都储存有化学能,不同的物质因为组成、结构的不同,储存的化学能也不同.....................................。
3、化学反应是吸收能量还是放出能量取决于。
①反应物的总能量>生成物的总能量,反应________能量,为_________反应,由(稳定/不稳定)变为(稳定/不稳定)②反应物的总能量<生成物的总能量,反应________能量,为_________反应,由(稳定/不稳定)变为(稳定/不稳定)3、根据能量守恒定律,反应物的总能量(E反)、生成物总能量(E生)和热量(E)之间的关系(用式子表示)放热反应中:吸热反应中:__________________________ 设反应物的总能量为E1,生成物的总能量为E2.(1)若E1>E2,则该反应为(填“放热”或“吸热”)反应.该反应可用图(填“A”或“B”)表示.(2)若E1<E2,则该反应为(填“放热”或“吸热”)反应.该反应可用图(填“A”或“B”)表示.三、人类利用能源的三个阶段1.柴草时期:该时期从火的发现至18世纪产业革命,以树枝杂草为主要能源。
化学能与热能学案【学习目标】⑴了解化学键与化学反应中能量变化的关系;⑵了解化学能与热能的相互转化及其应用;⑶了解生物体中的能量转化及人类利用能源的三个阶段。
【知识梳理】一、化学键与化学反应中能量变化的关系1、断开化学键吸收能量:1molH2中含有 H—H键,常温常压下使1molH2变为2molH原子断开了 H—H键,需要 436KJ的热量。
2、形成化学键放出能量:由2molH原子生成1molH2,有 H—H键生成,生成过程中向外界 436KJ的热量。
小结:形成1molH—H键释放的能量与断开1molH—H键吸收的能量。
3、化学变化中能量变化的主要原因——微观方面⑴化学键的和是化学反应中能量变化的主要原因。
⑵化学反应的实质是分子的和原子的,用化学键理论可表述为旧化学键的和新化学键的。
思考:为什么许多放热反应一开始要加热才能进行呢?4、反应能量变化的判定——宏观方面(教材P29页图)⑴各种物质都储存有能。
⑵反应物的总能量>生成物的总能量,反应能量。
⑶反应物的总能量<生成物的总能量,反应能量。
5、两条基本的自然定律⑴质量守恒定律:。
⑵能量守恒定律:。
⑶质量与能量是相互联系的(),故统称为。
6、放热反应和吸热反应⑴化学反应中的能量变化,通常主要表现为的变化———或者。
⑵放热反应:的化学反应。
⑶吸热反应:的化学反应。
二、化学能与热能的相互转化1、化学能转化为热能——铝和盐酸的反应2、热能转化为化学能——氢氧化钡晶体与氯化铵晶体的反应3、中和热——化学能变为热能(氢氧化钠与盐酸反应)4、化学能与热能相互转化的应用⑴化学能转化为热能的应用:、、。
⑵热能转化为化学能的应用:、。
5、生物体中的能量转化6、人类利用能源的三个阶段能源时期→能源时期→多能源结构时期【典型例题】例1:下列说法正确的是…………………………………………………()A、物质发生化学反应都伴随着能量变化B、伴有能量变化的物质变化都是化学变化C、在一个确定的化学反应体系中,反应物的总能量总是高于生成物的总能量D、在一个确定的化学反应体系中,反应物的总能量与生成物的总能量一定不同例2:石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石,已知12g 石墨完全转化为金刚石时,要吸收EKJ的热量,下列说法正确的是…………………………………()A、石墨不如金刚石稳定B、等质量的石墨与金刚石完全燃烧,金刚石放出的的热量多C、金刚石不如石墨稳定D、等质量的石墨与金刚石完全燃烧,石墨放出的的热量多【随堂巩固】1、物质之间发生化学反应时,一定发生变化的是……………………()A、颜色B、状态C、原子核D、化学键2、下列物质溶于水,温度降低的是……………………………………………………()A、浓硫酸B、烧碱C、食盐D、硝酸铵3、下列过程一定释放出能量的是………………………………………………………()A、化合反应B、分解反应C、分子拆成原子D、原子组成分子4、下列说法正确的是……………………………………………………………………()A、需要加热才能发生的反应叫吸热反应B、放热反应在常温下很容易进行C、反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小D、化学反应释放出的能量一定是热能5、已知反应X+Y=M+N为放热反应,对该反应的说法正确的是………………………()A、X的能量一定高于MB、X和Y的总能量一定高于M和N的总能量C、Y的能量一定高于ND、因为该反应为放热反应,故不必加热就可发生6、下列关于吸热反应说法正确的是……………………………………………………()A、凡需加热的反应一定是吸热反应B、只有分解反应才是吸热反应C、使用催化剂的反应是吸热反应D、CO2与CaO化合是放热反应,则CaCO3分解是吸热反应7、已知某反应是放热反应,下列说法正确的是………………………………………()A、该反应发生时,一定不需要加热B、该反应中反应物的总能量大于生成物的总能量C、该反应中反应物的总能量小于生成物的总能量D、如果该反应开始后停止加热,反应一定能继续进行8、下列能源通过化学反应产生的是……………………………………………………()A、太阳能B、潮汐能C、风能D、氢气燃烧产生的热能9、氢气是一种很有前途的能源物质,以水为原料大量制取氢气的最理想的途径是()A、利用太阳能直接使水分解产生氢气B、以焦炭和水制取水煤气分离出氢气C、用铁和盐酸反应放出氢气D、由热电站提供电力电解水产生氢气10、已知31g白磷变为31g红磷释放能量。
第二章化学反应与能量12第一节化学能与热能3【学习目标】41、能从化学键的角度理解化学反应中能量变化的主要原因52、通过化学能与热能的相互转变,理解“能量守恒定律”6学习重点:化学反应中能量变化的主要原因以及化学能转化为热能的重大7意义。
8学习难点:从本质上(微观结构角度)理解化学反应中能量的变化,从而建9立起科学的能量变化观。
10【自主预习】梳理知识,夯实基础11[温故]121.化学键的分类:132.化学反应的本质(从化学键的角度分析):14一、化学键与化学反应中能量变化的关系151.化学反应中能量变化的原因16(1)物质中的原子之间是通过________结合的。
17(2)断开反应物中的化学键要_______能量;形成生成物中化学键要_______ 18能量。
(3)化学键的_____________________是物质在化学反应中发生能量变化的19主要原因。
20二、化学能与热能的相互转化211.两条基本的自然定律22(1)质量守恒定律:自然界的物质发生转化时,_______不变23(2)能量守恒定律:一种能量可以转化为另一种能量,但是体系包含的24_______不变。
252、各种物质都储存有化学能,不同的物质因为组成、结构的不同,储存的化................................26学能也不同.....。
273、化学反应是吸收能量还是放出能量取决28于。
29①反应物的总能量>生成物的总能量,反应________能量,为_________30反应,由(稳定/不稳定)变为(稳定/不稳定)31②反应物的总能量<生成物的总能量,反应________能量,为_________32反应,由(稳定/不稳定)变为(稳定/不稳定)333、根据能量守恒定律,反应物的总能量(E反)、生成物总能量(E生)和热量34(E)之间的关系(用式子表示)35放热反应中:吸热反应中:36__________________________37设反应物的总能量为E1,生成物的总能量为E2.3839(1)若E1>E2,则该反应为(填“放热”或“吸热”)反应.该反40应可用图(填“A”或“B”)表示.41(2)若E1<E2,则该反应为(填“放热”或“吸热”)反应.该反42应可用图(填“A”或“B”)表示.4344三、人类利用能源的三个阶段451.柴草时期:该时期从火的发现至18世纪产业革命,以树枝杂草为主要能源。
462.化石能源时期:从18世纪中期到现代,以________________为主要能源。
473.多能源结构时期:以可再生能源和清洁能源(______能源)为主要能源,48主要包括______、______、______、______、______、生物质能等。
Si49四.中和热50.强酸与强碱反应的实质是H++OH-=H2O,中和反应是放热反应。
酸与碱发生51生成称为中和热。
5253【讨论小结】决定化学反应中能量变化的因素54(1)从化学键的角度55①断开化学键吸收的能量﹥形成化学键释放的能量时,反应_______能量。
56②断开化学键吸收的能量﹤形成化学键释放的能量时,反应_______能量。
57(2)从反应物的总能量与生成物总能量的角度58①反应物的总能量﹥生成物的总能量,反应_______能量。
59②反应物的总能量﹤生成物的总能量,反应_______能量。
60【合作探究二】放热反应和吸热反应61化学反应中的能量变化,通常主要表现为_______的变化——吸热或者放热62(1)铝与盐酸反应63现象:铝条表面有______产生,反应后温度______。
结论:反应过64程中______热量。
65(2)Ba(OH)2·8H2O与NH4Cl反应66现象:有_______气体产生,烧杯壁_____,烧杯与玻璃片粘到一起。
结论:67反应过程中______热量。
68(3)盐酸与NaOH溶液反应的能量变化69①盐酸与NaOH溶液的中和反应70现象:反应过程中,混合溶液的温度逐渐______。
结论:反应过程中______ 71热量。
72②中和热:酸与碱发生中和反应生成______时所释放的热量。
73【小结】常见的放热反应和吸热反应74(1)常见的放热反应:75①所有的燃烧反应76②大多数的化合反应;(CO2+C2CO为吸热反应)77③酸碱中和反应;78④金属与酸或水反应79⑤铝热反应80(2)常见的吸热反应:81①大多数的分解反应;82②以下几个反应是吸热反应:83Ba(OH)2·8H2O+2NH4Cl=2NH3↑+BaCl2+10H2O ;84CO2+C2CO ; C+H2O CO+H285注意:1.有热量放出未必是放热反应,放热反应和吸热反应必须是化学变化。
862.反应条件与热量变化没有必然的关系,需要点燃或加热的反应不一定是吸87热反应。
8889【随堂检测】901.下列说法中错误的是 ( )91A.化学反应中的能量变化通常表现为热量的变化92B.化学键的断裂和形成是化学反应中能量变化的主要原因93C.需要加热才能发生的反应一定是吸热反应94D.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸95收能量962.氢气在氯气中燃烧时产生苍白色火焰。
在反应过程中,破坏1mol氢气中的97化学键消耗的能量为Q1kJ,破坏1mol氯气中的化学键消耗的能量为Q2kJ,形成981mol氯化氢中的化学键释放的能量为Q3kJ。
下列关系式正确的是()99A.Q1+Q2>Q3B. Q1+ Q2>2Q3C. Q1+Q2<Q3D.100Q1+ Q2<2Q31013.下列各图中,表示正反应是吸热反应的图是 ( )1021034、已知金刚石在一定条件下转化为石墨是放热的。
据此,以下判断或说法正104确的是()105A 需要加热方能发生的反应一定是吸热反应106B 放热反应在常温下一定很容易发生107C反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小108D吸热反应不加热不可能发生109训练案(练一练,学习再上新台阶)110【达标检测】1111.下列说法不正确的是 ( )112A.化学反应除了生成新物质外,还伴随着能量的变化113B.物质燃烧和中和反应均放出热量114C.分解反应肯定是吸热反应115116D.化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能117量1182.(上海理综)下列对化学反应的认识错误的是()119A.会引起化学键的变化B.会产生新的物质120C.必然引起物质状态的变化D.必然伴随着能量的变化1213.已知反应:X + Y =M + N 为放热反应,对该反应的下列说法中正确的是122( )123A.X 的能量一定高于 MB.X 和 Y 的总能量一定高于 M 和 N 的总能量124125C.Y 的能量一定高于 ND.因为该反应是放热反应,故不必加热反应就126一定能发生1274.已知某反应是放热反应,下列说法正确的是 ( )128A.该反应发生时,一定不需要加热B.该反应中反应物的总能量小于生成129物的总能量C.该反应中反应物的总能量大于生成物的总能量D.如果该反应开始后停止130131加热,反应一定能继续进行1325.一种“即食即热型快餐”适合外出旅行时使用。
其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动133134预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包135化学物质最合适的选择是 ( )A.浓硫酸与水 B.生石灰与水 C.熟石灰与水D.氯136137化钠与水6.在相同的条件下,一定量的氢气在氧气中充分燃烧并放出热量。
若生成液138态水放出的热量为Q1kJ;若生成气态水放出的热量为Q2 kJ。
那么Q1,与Q2之139间的关系是 ( )。
140A.Q1>Q2 B.Q1<Q2 C.Q1=Q2 D.不能确定1417.下列选项中说明乙醇作为燃料的优点是 ( ) ①燃烧时发生氧化反应②142充分燃烧的产物不污染环境③乙醇是一种再生能源④燃烧时放出大量热143A.①②③B.①②④C.①③④D.②③④1448.下列反应中属吸热反应的是 ( )145A.镁与盐酸反应放出氢气B. 氢氧化钠与盐酸的反应146C.硫在空气或氧气中燃烧D. Ba(OH)2•8H2O与NH4Cl反应1479. “摇摇冰”是一种即用即冷的饮料,吸食时将饮料罐隔离层中的化学物质148和水混合后摇动即会制冷,该化学物质可能是( ) A.氯化钠 B.固体硝149酸铵 C.生石灰 D.蔗糖15010.关于吸热反应的说法正确的是 ( )151A.凡需加热的反应一定是吸热反应B.只有分解反应才是吸热反应152C.使用催化剂的反应是吸热反应D.CO2与CaO化合是放热反应,则CaCO3153分解是吸热反应15411.下列说法不正确的是( )155A.由H原子形成1 mol H-H键要放出热量156B.所有燃烧反应都是放热反应157C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O时所释放的热量称为中和158热159D.凡经加热而发生的化学反应都是吸热反应16012.下列反应既属于氧化还原反应,又是吸热反应的是 ( ) 161A.锌粒与稀硫酸的反应B.灼热的木炭与CO2反应162C.甲烷在氧气中的燃烧反应D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应16313.“可燃冰”又称“天然气水合物”,它是在海底的高压、低温条件下形成164的,外观像冰。
1体积“可燃冰”可贮载100~200体积的天然气。
下面关于“可165燃冰”的叙述不正确的是 ( )166A.“可燃冰”有可能成为人类未来的重要能源B.“可燃冰”是一种167比较洁净的能源168C.“可燃冰”提供了水可能变成油的例证D.“可燃冰”的主要169可燃成分是甲烷17014.下列说法不正确的是 ( )171A.化学反应除了生成新物质外,还伴随着能量的变化172B.水汽化需要吸收能量,所以水汽化属于吸热反应173C.可燃物的燃烧都是放热反应174D.1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和175热。
17615.航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧177化放热引发氯酸铵反应,其化学方程式可表示为: 2NH4ClO4= N2↑+ 4H2O↑+178Cl2↑+ 2O2↑ (该反应为放热反应)179下列对此反应的叙述中错误的是( )180A.上述反应属于分解反应181B.上述反应瞬间产生大量高温气体推动航天飞机飞行182C.反应从能量变化上说,主要是化学能转变为热能和动能183D.在反应中高氯酸铵只起氧化剂作用18416.(上海理综10)右图是一个一次性加热杯的示意图。