4共轭二烯烃
- 格式:ppt
- 大小:1.39 MB
- 文档页数:33

油品中共轭二烯烃的气相色谱法测试研究摘要:本文采用气相色谱法结合气相色谱质谱法,对油品中六种常见C4、C5和C6共轭二烯烃进行测试,检测时间约为100分钟,加标回收率104.9%,不需要进行样品加成反应的前处理过程,检测速度快、检出限低、检出的目标化合物浓度范围宽,覆盖的品种多、结果重复性好,并且能够识别出具体二烯烃化物成分,由于不使用有毒有害试剂,分析过程几乎不产生污染、对人员的依赖程度低,顺丁烯二酸酐加成反应测得二烯值与本方法测得的共轭二烯烃结果比值在2~5之间,符合该值的理论区间。
关键词:共轭二烯烃、二烯值、气相色谱质谱引言国标 GB 17930-2016《车用汽油》对汽油中的烯烃提出了一定的限制要求,从国VI A到国VI B,烯烃的限制要求从大不大于18%(V/V)降低为不大于15%(V/V)。
我国的汽油主要是催化裂化汽油(FCC),占到了汽油总产量的 80%以上,受催化裂化等加工工艺影响,成品汽油中会含有少量的碳数为4到6的共轭二烯烃(根据我们对流通领域成品汽油的测试经验,极少情况下会含有碳7及以上的二烯烃物质),共轭二烯烃含量高,会导致汽油的抗氧化性降低,实际胶质增加,并对诱导期产生不利影响。
因而对共轭二烯烃的控制也成了中石化销售公司对外采成品油质控技术指标之一,虽然现行国标中并未对该指标进行技术限定。
目前用于检测油品中的共轭二烯烃的技术手段主要有顺丁烯酸酐法(UOP326-2008)、气相色谱法(ASTM D6730-01(2016))、中红外光谱法、极谱法、分光光度法和高效液相色谱法。
这里就其中部分业界常见的测试方法作简要分析。
(1)顺丁烯二酸酐加成法UOP 326顺丁烯二酸酐加成反应法测定二烯值最为普遍,是国际公认的权威的对二烯烃含量的测试手段,该方法利用Diels-Alder 双烯加成反应来测定二烯烃的含量(结果以二烯值表示,即与100 g 试样反应所消耗的马来酸酐等当量的I2的克数),该方法时间较长,完成一次测试一般需要3~4小时,并且过程中对人工的依赖性强,测试过程中需要使用到大量的挥发性溶剂例如苯,甲苯,乙醚等有毒有害试剂,这使得该方法的推广收到极大的制约,该方法的由于存在复杂的前处理,数据的误差引入环节较多,使得不同的实验室测试的结果经常发生较大的差异,难以把控数据的稳定性和准确性;我国行业标准 NB/SH/T 0969-2018修改采用了UOP 326-2008标准,并做了一定的改进,采用自动电位滴定代替人工滴定,但本质上并无太大的差异。






河北科技⼤学有机化学精品教案--第四章共轭⼆烯烃第 8 次课 2 学时第四章⼆烯烃共轭体系【教学要求】1.掌握⼆烯烃的命名。
2.理解共轭体系、共轭效应的概念。
3.掌握共轭体系的类型:π-π共轭,p-π共轭,超共轭(σ-π超共轭,σ-p超共轭)。
并根据共轭效应判断不同的碳正离⼦或⾃由基的稳定性。
4.掌握共轭⼆烯烃化学性质:(1)1,2-和1,4-亲电加成(2)双烯合成(Diels—Alder反应)。
【教学重点】1.共轭体系、共轭效应的概念。
2.共轭体系的类型:π-π共轭,p-π共轭,超共轭(σ-π超共轭,σ-p超共轭)。
3.共轭效应的应⽤。
4.共轭⼆烯烃化学性质。
【教学难点】1.共轭体系的类型:π-π共轭,p-π共轭,超共轭(σ-π超共轭,σ-p超共轭)。
2.共轭效应的应⽤。
【教学时间】2学时引⾔:⼆烯烃是含有两个碳碳双键的开链不饱和烃,亦称双烯烃。
通式C n H2n-24.1⼆烯烃的分类和命名4.1.1⼆烯烃的分类根据双键的相对位置将⼆烯烃分为三类1.隔离双键⼆烯烃两个双键被两个或两个以上单键隔开的⼆烯烃,称为隔离(孤⽴)双键⼆烯烃。
2.累积双键⼆烯烃两个双键连接在同⼀个碳原⼦上的⼆烯烃,称为累积双键⼆烯烃。
3.共轭双键⼆烯烃两个双键被⼀个单键隔开的⼆烯烃,称为共轭双键⼆烯烃。
4.1.2⼆烯烃的命名⼆烯烃的命名与单烯相似,选取含有⼆个双键的最长碳链为主链,尽量使双键的位次最低。
双键的位置要标明。
C H2C H3C H3C H C H C H2C H C H2C H2C C H C H2C H3C H3C H C H C C H21,4-⼰⼆烯1,2-戊⼆烯2-⼄基-1,3-戊⼆烯由于双键间的单键可以旋转∴存在构象异构体或S-(E)-1,3-丁⼆烯C C H 2CC H 2HHC CHH H 2CC H 2S-顺-1,3-丁⼆烯S-反-1,3-丁⼆烯S 表⽰双键间的单键以S-反为主共轭⼆烯双键两端碳原⼦连接的原⼦或基团不相同时,也存在顺反异构现象,要逐渐标明其构型。
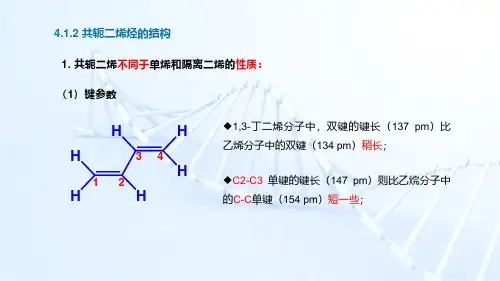
1. 共轭二烯不同于单烯和隔离二烯的性质:(1)键参数H HHH H H 1234◆1,3-丁二烯分子中,双键的键长(137pm )比乙烯分子中的双键(134pm )稍长;◆C2-C3单键的键长(147pm )则比乙烷分子中的C-C 单键(154pm )短一些;4.1.2共轭二烯烃的结构(2)氢化热◆共轭的1,3-丁二烯在结构上比非共轭的1,4-戊二烯更稳定。
∆H 0= -254 kJ/molCH 2CHCH 2CH CH 2+ 2H 2PtCH 3(CH 2)3CH 31,4-戊二烯1,4-pentadiene∆H0= -226 kJ/molCH 2CHCH + 2H 2PtCH 3(CH 2)3CH 3CHCH 31,3-戊二烯1,3-pentadiene1. 共轭二烯不同于单烯和隔离二烯的性质:4.1.2共轭二烯烃的结构(3)加成和聚合反应1,2-加成(1,2-Addition )1,4-加成(1,4-Addition )CH 2CH CH CH 2+ HBr CH 3CH CH CH 2Br CH 3CH CH CH 2Br3-溴-1-丁烯(3-bromo-1-butene )1-溴-2-丁烯(1-bromo-2-butene )1 2 3 4H 2CH CH CH2+ HBr CH 3CH CH CH 2BrCH 3CH CH CH 2Br3-溴-1-丁烯(3-bromo-1-butene )1-溴-2-丁烯(1-bromo-2-butene )1 2 3 4H 2CH CH CH 2+ HBr CH 3CH CH CH 2Br CH 3CH CH CH 2Br 3-溴-1-丁烯(3-bromo-1-butene )1-溴-2-丁烯(1-bromo-2-butene )1 2 3 41. 共轭二烯不同于单烯和隔离二烯的性质:4.1.2共轭二烯烃的结构CH 2CH CH CH 2CH 2CH CH CH 2n 1,2-加聚产物n 顺-1,4-加聚产物反-1,4-加聚产物1 2 3 4CH 2H CH 2H n H CH 2CH 2H H 2CH CH CH 2CH 2CH CH CH 2n 1,2-加聚产物n 顺-1,4-加聚产物反-1,4-加聚产物1 2 3 4CH 2H CH 2H n H CH 2CH 2H H 2CH CH CH 2CH 2CH CH CH 2n 1,2-加聚产物n顺-1,4-加聚产物反-1,4-加聚产物1 2 3 4CH 2H CH 2H nH CH 2CH 2HH 2CH CH 2CH 2CH CH CH 2n 1,2-加聚产物n 顺-1,4-加聚产物反-1,4-加聚产物1 2 3 4CH 2H CH 2H n H CH 2CH 2H H 2CH CH CH 2CH 2CH CH CH 2n 1,2-加聚产物n 顺-1,4-加聚产物反-1,4-加聚产物1 2 3 4CH 2H CH 2H n H CH 2CH 2H (3)加成和聚合反应1. 共轭二烯不同于单烯和隔离二烯的性质:4.1.2共轭二烯烃的结构(4)Diels –Alder reaction◆Diels-Alder 反应于1928年被发现,并于1950年获诺贝尔化学奖。


3.2.2 共轭二烯烃的结构和共轭效应Structures and Conjugative Effects ofConjugated Dienes(1)共轭二烯烃的结构。
在共轭二烯烃中,最简单的是1,3-丁二烯,下面我们就以它为例来说明共轭二烯烃的结构。
根据近代物理方法测定,1,3-丁二烯中碳碳双键的键长是0.135nm,碳碳单键的键长是0.148 nm,也就是说,它的双键比乙烯的双键(0.134 nm)长,而单键却比乙烷的单键(0.154 nm)短。
这说明1,3-丁二烯的单、双键较为特殊,键长趋于平均化。
杂化轨道理论认为,在1,3-丁二烯中,4个sp2杂化轨道的碳原子处在同一平面上(图3.6),每个碳原子上未杂化的p轨道相互平行,且都垂直于这个平面。
这样,在分子中不仅C1、C2和C3、C4间各有一个π键,C2、C3间的p 轨道从侧面也有一定程度的重叠(图3.6),使4个p电子扩展到四个碳原子的范围内运动,每两个碳原子之间都有π键的性质,组成一个大π键,这种共轭体系称为π-π共轭体系。
在共轭体系中,π电子Array不再局限于成键两个原子之间,而要扩展它的运动范围,这种现象称为电子离域。
电子离域范围愈大,体系的能量愈低,分图3.6 1,3-丁二烯分子中π键所在平面与纸面垂直子就愈稳定。
共轭体系的各原子必须在同一平面上,每一个碳原子都有一个未杂化且垂直于该平面的p轨道,这是形成共轭体系的必要条件。
按照分子轨道理论,4个p电子可以组成4个分子轨道,两个成键轨道(ψ1、ψ2)、两个反键轨道(ψ3、ψ4),如图3.7。
图3.7 1,3-丁二烯的原子轨道和π分子轨道图形从图中可以看出,ψ1在键轴上没有节面,而ψ2、ψ3、ψ4各有1个、2个、3个节面。
节面上电子云密度等于零,节面数目越多能量越高。
ψ4有3个节面,所有碳原子之间都不起成键作用,是能量最高的强反键;ψ3有2个节面,能量比只有1个节面的ψ2高,ψ3为弱反键;ψ2为弱成键分子轨道;ψ1没有节面,所有碳原子之间都起成键作用,是能量最低的成键轨道。