高中化学第三章金属及其化合物第一节金属的化学性质讲义必修1
- 格式:doc
- 大小:1001.00 KB
- 文档页数:25

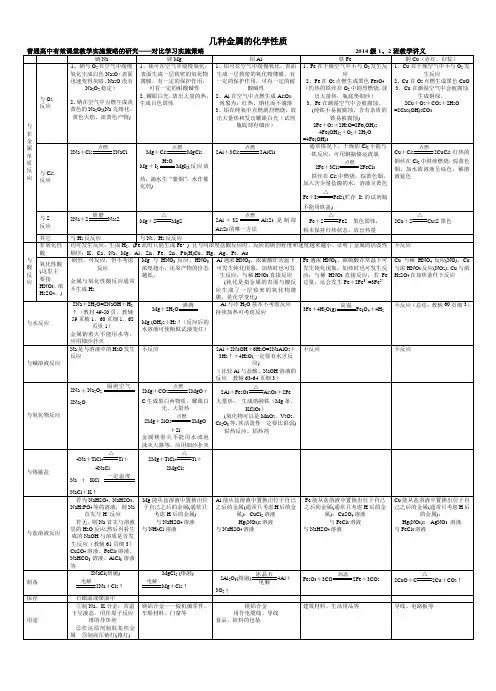



高中化学必修一第三章知识点总结一、金属及其化合物(一)金属的化学性质1. 金属与非金属的反应- 钠与氧气反应- 常温下:4Na + O_{2}=2Na_{2}O,氧化钠为白色固体。
- 加热时:2Na+O_{2}{}{=!=!=}Na_{2}O_{2},过氧化钠为淡黄色固体。
- 铝与氧气反应- 在常温下,铝能与空气中的氧气反应,表面生成一层致密的氧化铝薄膜,4Al + 3O_{2}=2Al_{2}O_{3}。
这层薄膜可以阻止内部的铝进一步被氧化。
2. 金属与酸和水的反应- 钠与水反应- 化学方程式:2Na + 2H_{2}O = 2NaOH+H_{2}↑。
- 现象:“浮(钠的密度比水小)、熔(反应放热,钠的熔点低)、游(有气体生成)、响(反应剧烈)、红(溶液呈碱性,使酚酞变红)”。
- 铁与水蒸气反应- 化学方程式:3Fe + 4H_{2}O(g){高温}{=!=!=}Fe_{3}O_{4}+4H_{2}。
3. 铝与氢氧化钠溶液反应- 化学方程式:2Al+2NaOH + 2H_{2}O=2NaAlO_{2}+3H_{2}↑。
(二)几种重要的金属化合物1. 氧化物- 氧化钠和过氧化钠- 氧化钠(Na_{2}O)- 属于碱性氧化物,与水反应:Na_{2}O + H_{2}O = 2NaOH;与酸反应:Na_{2}O+2HCl = 2NaCl + H_{2}O。
- 过氧化钠(Na_{2}O_{2})- 与水反应:2Na_{2}O_{2}+2H_{2}O = 4NaOH+O_{2}↑。
- 与二氧化碳反应:2Na_{2}O_{2}+2CO_{2}=2Na_{2}CO_{3}+O_{2},因此过氧化钠可用于呼吸面具和潜水艇中作为氧气的来源。
- 氧化铝(Al_{2}O_{3})- 两性氧化物,既能与酸反应:Al_{2}O_{3}+6HCl = 2AlCl_{3}+3H_{2}O,又能与碱反应:Al_{2}O_{3}+2NaOH = 2NaAlO_{2}+H_{2}O。




高一化学必修一第三章金属的化学性质(第一课时)说课5篇第一篇:高一化学必修一第三章金属的化学性质(第一课时)说课金属的化学性质(第一课时)说课稿一、教材分析(一)教材的地位和作用“金属的化学性质”是人教版化学必修Ⅰ《第三章金属及其化合物》第一节的内容,是学习元素化合物知识的起始节。
金属单质的性质是金属元素性质的反映,是了解金属化合物性质的基础。
本节以学生在初中学过的有关金属的性质及金属的活动性顺序为基础,选取典型的金属如钠、铝进一步学习拓展金属的性质。
通过本节以及后面章节的元素化合物知识的学习,既可以为前面两章所学的实验和理论知识补充感性认识的材料,又可以为在化学2中学习物质结构、元素周期律、化学反应与能量等理论知识打下重要的基础。
另外,在本节学习中所用到的许多方法如观察法、实验法、比较法、归纳法等也是学习元素化合物知识的重要方法,所以学好本节内容可为后继元素化合物知识的学习奠定坚实的方法论基础。
(二)教材处理本节内容分三课时进行教学,第一课时为金属与非金属的反应,第二课时为金属与水和酸的反应,第三课时为物质的量在化学方程式计算中的应用。
本节课要说的是第一课时的教学设计思路。
(三)第一课时教学目标 1.知识与技能:(1)通过阅读课本中的图片、书写有关反应的化学方程式,巩固和加深初中有关金属化学性质的知识和规律。
(2)通过观察了解金属钠的物理性质及其保存方法。
(3)了解活泼金属(Na、Mg、Al)与O2的反应;探索金属的性质和金属的原子结构的关系,了解反应条件对反应产物的影响;了解金属氧化膜在生活、生产中的运用。
2.过程与方法目标:通过对金属钠、铝与氧气反应的实验探究活动,初步体验科学探究的过程,并学习观察法、实验法、比较法、归纳法等重要的化学学习方法。
3.情感态度和价值观目标:通过奇妙的化学实验的操作(如钠的切割)和精彩的化学实验现象(如钠的燃烧反应)感受化学世界的美妙变化,提高学习化学的兴趣;通过了解金属及金属氧化膜在生活、生产中的运用,知道用化学的视角去观察身边的物质和发生的事情。


第三章 金属及其化合物 第一节 金属的化学性质一、钠1、结构:原子易失电子 → 强还原性2、物理性质:银白、质软、密度小、熔点低3、化学性质:⑴ 钠与氧气(或其它非金属)反应 ① 常温: ② 点燃:③ 与氯气: ④ 与硫:⑵ 钠与水反应 ⑶ 钠与酸反应 ⑷ 钠与盐反应① 钠与硫酸铜溶液反应:② 钠与氯化铁溶液反应:二、 铝1、结构:原子易失电子 → 表现还原性 (金属性弱于钠,表现出两性)2、物理性质:银白(铝粉俗称”银粉”)、质软、熔点较高、易导电3、化学性质:⑴ 与非金属单质反应 ⑵ 与酸反应⑶ 与强碱反应⑷ 与盐反应2Na + Cl 2 ===== 2NaCl 点燃 2Na + S===== Na 2S (条件也可以研磨) △思考: 物质燃烧出4Na + O 2 ===== 2Na 2O (白色固体)2Na + O 2 ===== Na 2O 2 (淡黄色固体;火焰黄色)点燃2Na + 2H 2O ===== 2NaOH+H 2↑ 思考: 浮、游、熔、响、旋、红?2Na + 2HCl ===== 2NaCl + H 2↑ 反应速率更快,并伴有爆鸣声,按先酸后水反应,因为酸中氢离子浓度更大。
2Na + 2H 2O + CuSO 4 === Cu(OH)2↓+ Na 2SO 4 + H 2↑6Na + 6H 2O + 2FeCl 3=== 2Fe(OH)3↓+ 6NaCl + 3H 2↑ 先与水反应,生成碱后再与盐溶液反应。
前边写的是合成反应。
而在熔融状态下钠与盐直接发生置换反应。
2Al + 3CuSO 4 === Al 2(SO 4)3 + 3Cu4Al + 3O 2 ===== 2Al 2O 3 (白色固体)2Al + 3Cl 2 ===== 2AlCl 32Al + 3S ===== Al 2S 3点燃△ △2Al + 6HCl ===== 2AlCl 3 + 3H 2↑ 2Al + 3H 2SO 4 ===== Al 2(SO 4)3 + 3H 2↑2Al + 2NaOH + 2H 2O === 2NaAlO 2 + 3H 2↑(还原剂) (介质) (氧化剂) 反应原理:2Al + 6H 2O ===== 2Al(OH)3 + 3H 2↑ 2Al(OH)3 + 2NaOH ===== 2NaAlO 2 + 4H 2O 2Al + 2OH - + 2H 2O ==== 2AlO 2-+ 3H 2↑⑸ 与金属氧化物反应(铝热反应) 三、铁1、物理性质:银白[ 还原铁粉:灰黑色;铁粉:深灰色 ]、熔沸点较高、易磁化2、化学性质:⑴ 与非金属单质反应⑵ 与酸反应 ⑶ 与盐反应⑷与水反应Fe + CuSO 4 === FeSO 4 + Cu (古代湿法冶铜原理)3Fe + 2O 2 ===== Fe 3O 4 (黑色)[ 在氧气中剧烈燃烧 ]4Fe + 3O 2 ===== 2Fe 2O 3(红棕色)[在空气中缓慢氧化 ]2Fe + 3Cl 2 ===== 2FeCl 3(棕黄色液;棕褐色烟)△点燃点燃 Fe + 2HCl === FeCl 2 + H 2↑ Fe + H 2SO 4 (稀)=== FeSO 4 + H 2↑Fe (不足)+ 4HNO 3(稀) === Fe(NO 3)3 + NO↑ + 2H 2O 3Fe (过量)+ 8HNO 3(稀)=== 3Fe(NO 3)2 + 2NO↑ + 4H 2O 钝化在常温下浓H 2SO 4、浓HNO 3使铁钝化。
3Fe + 4H 2O(g) ==== Fe 3O 4 + 4H 2△2021届新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。
相关电解槽装置如左下图所示,用Cu—Si合金作硅源,在950℃下利用三层液熔盐进行电解精炼,并利用某CH4燃料电池(如下图所示)作为电源。
下列有关说法不正确的是A.电极c与b相连,d与a相连B.左侧电解槽中;Si优先于Cu被氧化C.a极的电极反应为CH4-8e—+4O2— ===CO2+2H2OD.相同时间下,通入CH4、O2的体积不同,会影响硅的提纯速率2.物质性质的差异与分子间作用力有关的是A.沸点:Cl2<I2B.热稳定性:HF>HClC.硬度:晶体硅<金刚石D.熔点:MgO>NaCl3.N A表示阿伏加德罗常数的值。
室温下,下列关于1 L 0.1 mol/L FeCl3溶液的说法中正确的是A.溶液中含有的Fe3+离子数目为0.1N AB.加入Cu 粉,转移电子数目为0.1N AC.加水稀释后,溶液中c(OH-) 减小D.加入0. 15 mol NaOH 后,3c(Fe3+)+c(H+) = c(Na+) + c(OH-)4.下列各项中的两个量,其比值一定为2∶1的是()A.在反应2FeCl3+Fe =3FeCl2中还原产物与氧化产物的质量B.相同温度下,0.2 mol·L-1CH3COOH溶液与0.1 mol·L-1CH3COOH溶液中c(H+)C.在密闭容器中,N 2+3H22NH3已达平衡时c(NH3)与c(N2)D.液面均在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛溶液的体积5.下列方程式不能正确表示某沉淀溶解过程的是A.热的浓盐酸洗涤试管内壁的MnO2:MnO2+4H++2Cl-ΔMn2++Cl2↑+2H2OB.热的NaOH溶液洗涤试管内壁的S:3S+6NaOH Δ2Na2S+Na2SO3+3H2OC.向石灰石粉的悬浊液中持续通CO2:Ca(OH)2+2CO2=Ca(HCO3)2D.稀硫酸可除去铁锈:Fe2O3+6H+=2Fe3++3H2O6.科学家采用碳基电极材料设计了一种制取氯气的新工艺方案,装置如图所示:下列说法错误的是()A.反应过程中需要不断补充Fe2+B.阳极反应式是2HCl- 2e- =Cl2+2H+C.电路中转移1 mol电子,消耗标况下氧气5.6 LD.电解总反应可看作是4HCl(g)+O2(g)=2Cl2(g)+ 2H2O(g)7.设N A为阿伏加德罗常数的值。
下列有关叙述正确的是()A.常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中阳离子的数目相等B.标准状况下,22.4LHF所含有的分子数目为N AC.常温常压下,NO2与N2O4的混合气体46g,原子总数为3N AD.0.1mol-NH2(氨基)中所含有的电子数为N A8.下列说法正确的是A.纺织品上的油污可以用烧碱溶液清洗B.用钢瓶储存液氯或浓硫酸C.H2、D2、T2互为同位素D.葡萄糖溶液和淀粉溶液都可产生丁达尔效应9.下列实验操作与预期实验目的或所得实验结论一致的是选项实验操作和现象预期实验目的或结论A 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀KI3溶液中存在平衡:I3-I2+ I-B 向1 mL浓度均为0.05 mol·L-l NaCl、NaI的混合溶液中滴加2滴0.01 mol·L-l AgNO3溶液,振荡,沉淀呈黄色K sp(AgCl)<K sp(AgI)C室温下,用pH 试纸分别测定浓度为0.1mol/L NaClO溶液和0.1mol/L CH3COONa溶液的pH比较HC1O和CH3COOH的酸性强弱D浓硫酸与乙醇180℃共热,制得的气体通入酸性KMnO4溶液,溶液紫色褪去制得的气体为乙烯A.A B.B C.C D.D10.下列有关物质用途的说法,错误的是()A.二氧化硫常用于漂白纸浆B.漂粉精可用于游泳池水消毒C.晶体硅常用于制作光导纤维D.氧化铁常用于红色油漆和涂料11.下列有关有机物的说法不正确的是A.苯与浓硝酸、浓硫酸共热并保持5060-℃反应生成硝基苯B.用32CH CH OH与183CH CO OH发生酯化反应,生成的有机物为C.苯乙烯在合适条件下催化加氢可生成乙基环己烷D.戊烷()512C H的一溴取代物共有8种(不含立体异构)12.海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示)。
下列有关说法正确的是()A.大量的氮、磷废水排入海洋,易引发赤潮B.在③中加入盐酸溶解得到MgCl2溶液,再直接蒸发得到MgCl2·6H2OC.在④⑤⑥中溴元素均被氧化D.在①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH 溶液→BaCl2溶液→过滤后加盐酸13.下列物质溶于水后溶液因电离而呈酸性的是()A.KCl B.Na2O C.NaHSO4D.FeCl314.用“吸收—电解”循环法脱除烟气中的SO2,可减少对大气的污染。
室温下,电解液K再n(SO):n(HSO)变化的关系见下表,下列对此判生的装置如图所示,其中电解液的pH随2--33断正确的是电解液n(SO32-):n(HSO3-) pHK 9:91 6.2L 1:1 7.2M 91:9 8.2c(Na)>c(SO)>c(HSO)>c(OH)A.当电解液呈中性时溶液中:+2---33SO+OH=HSOB.再生液M吸收SO2主反应的离子方程式为:--23HSO+H O-2e=SO+3HC.HSO3-在b极发生的电极反应式为:--2-+324D.若产生标准状况下2.24L气体N,则d膜上共通过0.2mol阳离子15.天然海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。
火力发电时燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:下列说法错误的是()A.天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同二、实验题(本题包括1个小题,共10分)16.铜是人类最早使用的金属,在生产生活中应用及其广泛。
工业上以黄铜矿(主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。
已知:反应II的离子方程式:Cu2++CuS+4Cl-=2[CuCl2]-+S回答下列问题:(1)FeCuS2中S的化合价____。
(2)反应I在隔绝空气、高温煅烧条件下进行,写出化学方程式____。
(3)为了反应I充分进行,工业上可采取的措施是____。
(4)反应III的离子方程式为____。
(5)向反应III后的溶液中加入稀硫酸的目的是____。