4多组分体系热力学
- 格式:pdf
- 大小:112.24 KB
- 文档页数:2

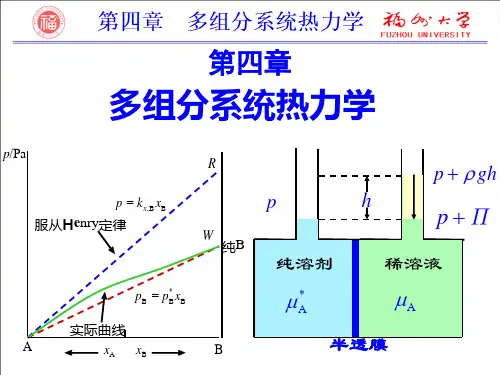

第四章多组分体系热力学一、选择题1. 在298K时,A和B两种气体单独溶解在某一溶剂中,均遵守亨利定律,亨利常数分别为kА和k B,且知kА> k B,则当A和B的平衡压力相同时,在一定量的该溶剂中所溶解的关系为( ) (A) A 的量大于 B 的量;(B) A 的量小于 B 的量;(C) A 的量等于 B 的量;(D) A 的量与 B 的量无法比较。
2. 在恒温抽空的玻璃罩中封入二杯液面相同的糖水 (A) 和纯水 (B)。
经历若干时间后,二杯液面的高度将是:( )(A) A 杯高于 B 杯; (B) A 杯等于 B 杯; (C) A 杯低于 B 杯;(D) 视温度而定。
3. 在温度T时,纯液体A的饱和蒸气压为P A*,化学势为μA*,并且已知在P⊖压力下的凝固点为T f*,当A 中溶入少量与A不形成固态溶液的溶质而形成为稀溶液时,上述三物理量分别为P、μA、T f则( ) (A) P < P,μA*<μA ,T f*< T f(B) P A*> P A ,μA*<μA ,T f*< T f(C) P < P,μA*<μA ,T f*> T f(D) P A*> P A ,μA*>μA , T f*> T f4.已知在 373K 时液体A 的饱和蒸气压为66662Pa,液体B的饱和蒸气压为1.01325×105 Pa,设 A 和 B 构成理想液体混合物,则当A在溶液中的物质的量分数为0.5 时,气相 A 的物质的量分数应为:( )(A) 0.200 (B) 0.300 (C) 0.397 (D) 0.6035. 对于理想液体混合物,下列偏微商小于零的是:(A) [∂(△mix F m)/ ∂T]p(B) [∂(△mix S m)/ ∂T]p(C) [∂ (△mix G m)/T]/ ∂T]p(D) [∂ (△mix G m)/ ∂P]T6. 假设A、B 二组分混合可以形成理想液体混合物,则下列叙述中不正确的是:( )(A)A、B 分子之间的作用力很微弱;(B) A、B 都遵守拉乌尔定律;(C) 液体混合物的蒸气压介于A、B 的蒸气压之间;(D) 可以用重复蒸馏的方法使A、B 完全分离。






第三章多组分系统热力学一、填空题1、只有系统的____性质才具有偏摩尔量。
而偏摩尔量自身是系统的____性质。
偏摩尔量的值与系统中各组分的浓度____。
混合适物系统中各组分的同一偏摩尔量间具有两个重要的性质,分别是____与____。
2、如同温度是热传导的推动力一样,化学势是____传递的推动力。
在恒温恒压下多相平衡的条件是________________。
以焓表示的组分i的化学势可写成µi=____。
3、混合理想气体中任一组分B的化学势________;理想溶液中任一组分B的化学势________;稀溶液中溶剂A的化学势________。
4、由纯组分在恒温恒压下组成理想混合物时,△mix S=__0;△mix G__0;△mix H__0;△ix V__0。
5、理想溶液混合时,∆mix V ,∆mix S ,∆mix G ,∆mix H 。
6、比较水的化学势的大小(此处p=101.325kPa):(填>、< 或=)①μ(l,100℃,p)____μ(g,100℃,p)②μ(l,100℃,p)____μ(l,100℃,2p)③μ(g,100℃,p)____μ(g,100℃,2p)④μ(l,100℃,2p)____μ(g,100℃,2p)⑤μ(l,101℃,p)____μ(g,101℃,p)7、非理想溶液溶质的化学势表示式____,其标准态为____。
8、在一定的温度及压力下,某物质液汽两相达平衡,则两相的化学势μB(l)与μB(g)_____若维持压力不变,升高温度,则μB(l)和μB(g)都______;但μB(l)比μB(g)______。
9、理想溶液中任意组分B的化学势:μB=_______________。
10、298K、101.325kPa,有两瓶萘的苯溶液,第一瓶为2升,溶有0.5mol萘,第二瓶为1升,溶有0.25mol 萘,若以μ1和μ2表示两瓶中萘的化学势,则它们的关系为__________。


多组分体系热力学课后习题一、是非题下述各题中的说法是否正确?正确的在题后括号内画“√”,错的画“⨯”1. 二组分理想液态混合物的总蒸气压大于任一纯组分的蒸气压。
( )2. 理想混合气体中任意组分B 的逸度B ~p 就等于其分压力p B ~。
( )3.因为溶入了溶质,故溶液的凝固点一定低于纯溶剂的凝固点。
( ) 4.溶剂中溶入挥发性溶质,肯定会引起溶液的蒸气压升高。
( ) 5.理想溶液中的溶剂遵从亨利定律;溶质遵从拉乌尔定律。
( ) 6. 理想液态混合物与其蒸气达成气、液两相平衡时,气相总压力p 与液相组成x B 呈线性关系。
( )7. 如同理想气体一样,理想液态混合物中分子间没有相互作用力。
( )8. 一定温度下,微溶气体在水中的溶解度与其平衡气相分压成正比( )9. 化学势是一广度量。
( )10. 只有广度性质才有偏摩尔量( )11. )B C C,(,,B ≠⎪⎪⎭⎫⎝⎛∂∂n V S n U 是偏摩尔热力学能,不是化学势。
( ) 二、选择题选择正确答案的编号,填在各题题后的括号内1. 在α、β两相中都含有A 和B 两种物质,当达到相平衡时,下列三种情况, 正确的是:( )。
(A)ααμ=μB A ; (B) βαμ=μA A ; (C) βαμ=μB A 。
2. 理想液态混合物的混合性质是:( )。
(A)Δmix V =0,Δmix H =0,Δmix S >0,Δmix G <0;(B)Δmix V <0,Δmix H <0,Δmix S <0,Δmix G =0;(C)Δmix V >0,Δmix H >0,Δmix S =0,Δmix G =0;(D)Δmix V >0,Δmix H >0,Δmix S <0,Δmix G >0。
3. 稀溶液的凝固点T f 与纯溶剂的凝固点*f T 比较,T f <*fT 的条件是:( )。
(A )溶质必需是挥发性的;(B )析出的固相一定是固溶体;(C )析出的固相是纯溶剂;(D )析出的固相是纯溶质。
多组分体系热力学
1、不挥发的溶质溶于溶剂中形成溶液之后将会引起 蒸汽压降低 。
2、“在1θp 下,有0.002mol 的气体溶解在1000g 水中,当在相同温度下压力增大为2θp 时,就有0.004mol 该气体溶于1000g 水中”描述这一实验规律的定律是 亨利(Henry )定律 。
4、稀溶液的凝固点降低公式f m ⋅中,m 所代表的是稀溶液中f T K Δ= 溶质的质量摩尔浓度 。
6、25℃时,0.01m 糖水的渗透压为π1,0.01m 食盐水的渗透压为π2,则 π1<π2 。
7、若要使CO 2在水中的溶解度为最大,应选择的条件是 低温高压 。
8、理想溶液的通性是: 000V H S G Δ=Δ=Δ>Δ<混合混合混合混合0 。
9、在讨论稀溶液的蒸汽压降低规律时,溶质必须是 非挥发性物质 。
11、25℃时A 和B 两种气体在某一溶剂中溶解的亨利系数分别为k A 和k B ,且知
k A >k B ,则当A 和B 压力相同时在该溶剂中所溶解的量是 A 的量<B 的量 。
10、对于A 和B 两种液体,在1θp 下,纯A 的沸点较纯的B 的沸点为高。
当A 和B 组成二元溶液时具有一恒沸混合物,则对于该恒沸混合物,其呈平衡的气相组成y 1与液相组成x 1之间 y 1=x 1 。
11、苯和甲苯能形成理想溶液,在20℃时,当1mol 苯和1mol 甲苯混合时,过程所对应的G Δ是 -3377J 。
23、在20℃时,将压力为θp 的1mol 气态NH 3溶解到大量组成为NH 3:H 2O=1:21的溶液中。
已知此溶液上NH 3的蒸气分压为27mmHg ,则该转移过程的为G Δ -8130J 。
26、0.005mol/kg 的硫酸钾水溶液其沸点较纯水的沸点升高了0.0073℃,已知水的质量摩尔凝固点降低常数K f 和沸点升高常数K b 分别为1.86及0.52,则该溶液的凝固点(以℃表示)为 0.00731.86C 0.52
−×° 。
27、在T 时,某纯液体的蒸气压为88mmHg ;当0.2mol 的一非挥发性溶质溶于0.8mol 的该液体中应形成溶液时,溶液的蒸气压为40mmHg 。
假设蒸气是理想的,则在该溶液中溶剂的活度系数是 0.568 。
28、A 和B 能形成理想溶液。
已知在100℃是纯液体A 的蒸气压为1000mmHg ,纯液体B 的蒸气压为500mmHg ,当A 和B 的二院溶液中A 的摩尔分数为0.5时,与溶液平衡的蒸气中A 的摩尔分数是 2/3 。
29、溶剂服从拉乌尔定律及溶质服从亨利定律的二元溶液是 稀溶液 。
26、常利用稀溶液的依数性来测定溶质的分子量,其中最常用来测定高分子溶质分子量的是 渗透压 。
27、已知环己烷、醋酸、萘、樟脑的摩尔凝固点降低常数K f 分别为6.5、16.60、
80.25及173,今有一未知物能在上述四种溶剂种溶解,欲测定该未知物的分子量,最适宜的溶剂是 樟脑 。
35、40℃时纯液体A 的饱和蒸气压是纯液体B 的21倍,且A 和B 能形成理想溶液。
若气相中A 和B 的物质的量分数(摩尔分数)相等,则液相中A 和B 的物质的量分数之比B A x x :应
该为 1:21 。
f (溶质饱和蒸气逸度) A B 1=m →B x
图1 36、由A 和B 组成二元溶液,
以稀溶液为参考物系,以质量摩尔浓度m 表示组
成时,溶质的标准态相当
于图1上 1点 。
39、在15℃时,纯水的蒸气压
为12.788mmHg 。
当1mol
的不挥发溶质溶解在
4.559mol 的水中形成溶
液时蒸气压4.474mmHg ,
则溶液中和纯水中水的
化学位之差θ11μμ−为-2515J 。
34、氯仿(1)和丙酮(2)形成的非理想溶液,在T 时测的总蒸气压为220.5mmHg ;
蒸气中丙酮的物质的量分数y 2=0.818,而该温度纯氯仿的饱和蒸气压为221.8mmHg ,则在溶液中氯仿的活度a 1为 0.181 。
44、人的血浆可视为稀溶液,其凝固点为-0.56℃;已知水的摩尔凝固点降低常数
K f 为1.86,则37℃时血浆的渗透压为 7.65θp 。
46、已知35℃时纯丙酮的饱和蒸气压为323mmHg ,当氯仿的物质的量分数为0.30
时,测得丙酮-氯仿二元溶液上丙酮的蒸气压为200.8mmHg ,则此溶液 对丙酮为负偏差 。
47、在298K 时,向甲苯的物质的量分数为0.6的苯-甲苯的1mol 理想溶液中加
入微分量的纯苯,则对每摩尔的苯来说其
2270/07.618/G J mol H S J K Δ=−Δ=Δ=⋅、、mol 48、在298K 时,将0.4mol 苯与0.6甲苯混合形成理想溶液,则对每摩尔溶液此
过程的1667/0 5.595/G J mol H S J K mol −Δ=Δ=⋅、、Δ=。