化学鉴别试验(一)
- 格式:docx
- 大小:37.03 KB
- 文档页数:2

初中化学鉴别物质的方法初中化学是一门探索物质结构与性质的学科,鉴别物质的方法是其中的重要内容之一。
本文将从化学实验中常用的鉴别物质的方法入手,详细介绍其原理和实施步骤,帮助读者更好地理解和掌握这些方法。
一、溶解性鉴别法溶解性是物质的重要性质之一,通过观察物质在溶剂中的溶解现象可以初步鉴别物质的特性。
常用的溶解性鉴别法包括:1.溶解性试验:将待鉴别物质分别与水、酸、碱等溶剂接触,观察其是否溶解或反应产生气体、沉淀等变化。
2.溶解度试验:在已知溶液中逐渐加入待鉴别物质,观察其溶解度的变化。
根据溶解度的大小,可以初步判断物质的性质。
二、颜色鉴别法物质的颜色是其吸收和反射特定波长光线的结果,通过观察物质的颜色可以初步鉴别其成分。
常用的颜色鉴别法包括:1.火焰颜色鉴别法:将待鉴别物质分别放入火焰中加热,观察火焰颜色的变化。
不同的元素或化合物在火焰中燃烧时产生的颜色是不同的,可以根据颜色的差异初步判断物质的成分。
2.试剂颜色反应法:使用适当的试剂与待鉴别物质反应,观察反应后产生的颜色变化。
不同物质与试剂反应时常会出现颜色变化,通过对比颜色的差异可以初步鉴别物质的性质。
三、气味鉴别法物质的气味是其挥发性和化学性质的表现,通过嗅闻物质的气味可以初步鉴别其成分。
常用的气味鉴别法包括:1.嗅闻法:将待鉴别物质接近鼻部,轻轻吸气,观察气味的特点和变化。
不同的物质具有不同的气味,可以根据气味的特征初步判断物质的性质。
四、燃烧鉴别法物质的燃烧性质是其化学性质的重要表现,通过观察物质在燃烧时的现象可以初步鉴别其成分。
常用的燃烧鉴别法包括:1.燃烧试验:将待鉴别物质放入火焰中加热,观察其燃烧特点和产物变化。
不同的物质在燃烧时会产生不同的火焰、气味和残余物,可以根据这些特征初步判断物质的性质。
五、沉淀鉴别法物质的溶解度是其化学性质的表现,通过观察物质在溶液中是否产生沉淀可以初步鉴别其成分。
常用的沉淀鉴别法包括:1.沉淀试验:将待鉴别物质与适当试剂混合,观察是否产生沉淀。



化学分析一般鉴别试验(二)---芳香第一胺类\苯甲酸盐\乳酸盐\枸橼酸盐\钙盐\钡盐芳香第一胺类取供试品约50mg,加稀盐酸1ml,必要时缓缓煮沸使溶解,放冷,加0.1mol/L亚硝酸钠溶液数滴,滴加碱性β-萘酚试液数滴,视供试品不同,生成由橙黄到猩红色沉淀。
苯甲酸盐 (1) 取供试品的中性溶液,加三氯化铁试液,即生成赭色沉淀;加稀盐酸,变为白色沉淀。
(2) 取供试品,置干燥试管中,加硫酸后,加热,不炭化,但析出苯甲酸,在试管内壁凝结成白色升华物。
乳酸盐取供试品溶液5ml(约相当于乳酸5mg),置试管中,加溴试液1ml与稀硫酸0.5ml,置水浴上加热,并用玻棒小心搅拌至退色,加硫酸铵4g,混匀,沿管壁逐滴加入10%亚硝基铁氰化钠的稀硫酸溶液0.2ml 和浓氨试液1ml,使成两液层;在放置30分钟内,两液层的接界面处出现一暗绿色的环。
枸橼酸盐 (1) 取供试品溶液2ml(约相当于枸橼酸10mg),加稀硫酸数滴, 加热至沸,加高锰酸钾试液数滴,振摇,紫色即消失;溶液分成两份,一份中加硫酸汞试液1滴,另一份中逐滴加入溴试液,均生成白色沉淀。
(2) 取供试品约5mg,加吡啶-醋酐(3∶1)约5ml,振摇,即生成黄色到红色或紫红色的溶液。
钙盐 (1) 取铂丝,用盐酸湿润后,蘸取供试品,在无色火焰中燃烧,火焰即显砖红色。
(2) 取供试品溶液(1→20),加甲基红指示液2滴,用氨试液中和,再滴加盐酸至恰呈酸性,加草酸铵试液,即生成白色沉淀;分离,沉淀不溶于醋酸,但可溶于盐酸。
钠盐 (1) 取铂丝,用盐酸湿润后,蘸取供试品,在无色火焰中燃烧,火焰即显鲜黄色。
(2) 取供试品的中性溶液,加醋酸氧铀锌试液,即生成黄色沉淀。
钡盐 (1) 取铂丝,用盐酸湿润后,蘸取供试品,在无色火焰中燃烧,火焰即显黄绿色;通过绿色玻璃透视,火焰显蓝色。
(2) 取供试品溶液,加稀硫酸,即生成白色沉淀;分离,沉淀在盐酸或硝酸中均不溶解。

实验一化学药物的鉴别一、实验目的1. 掌握几种常见化学药物的鉴别方法和原理2. 熟练地进行几种常见化学药物的鉴别试验的操作3. 能做出正确的结果判断二、实验原理(一)异烟肼片的鉴别异烟肼分子中的酰肼基具有还原性,可与氨制硝酸银试液反应生成异烟酸和单质银沉淀,肼基则被氧化成氮气。
(二)维生素C的鉴别维生素C具有强还原性可以使硝酸银还原为单质银。
(三)阿司匹林片的鉴别1、阿司匹林分子结构中无游离的酚羟基,与三氯化铁试液不发生显色反应。
但其水溶液加热(或较长时间放置,或加碱),水解后产生具有酚羟基的水杨酸,可与三氯化铁试液作用,生成紫堇色的配合物。
2、阿司匹林分子结构中具有酯键,与碳酸钠试液共热,水解生产水杨酸钠和醋酸钠,放冷后用稀硫酸酸化,析出白色的水杨酸沉淀,并产生醋酸的臭气。
(四)盐酸普鲁卡因注射液的鉴别1、本品水溶液显氯化物的鉴别反应(1)本品在稀硝酸酸性中,与硝酸银反应生成氯化银沉淀,沉淀溶液氨试液,再加稀硝酸酸化后,氯化银沉淀复生成。
(2)本品与二氧化锰、硫酸加热发生氯气,氯气能使湿润的碘化钾淀粉试纸显蓝色。
2、显芳香第一胺的鉴别反应盐酸普鲁卡因分子结构中具有芳香第一胺,可发生重氮化-偶合反应。
在盐酸溶液中与亚硝酸钠进行重氮化反应,生成的重氮盐,再与碱性β-奈酚偶合生成有色的偶氮颜料。
(五)维生素B1片的鉴别维生素B1在碱性溶液中,可被铁氰化钾氧化生成硫色素,硫色素溶于正丁醇中,显蓝色荧光。
(六)硫酸链霉素的鉴别1、麦芽酚反应:链霉素在碱性溶液中,两个苷键水解断键,其中生成的链霉糖经分子重排,生成麦芽酚。
麦芽酚可在微酸性条件下与硫酸铁铵作用,生成紫红色配合物。
2、显硫酸盐鉴别反应(1)与氯化钡反应:本品溶液与氯化钡试液反应生成硫酸钡的白色沉淀;沉淀在盐酸后硝酸中均不溶解。
(2)与醋酸铅反应:本品溶液与醋酸铅试液反应生成硫酸铅的白色沉淀;沉淀在醋酸铵试液或氢氧化钠试液中溶解。
(3)与盐酸反应:不生成白色沉淀,从而与硫代硫酸盐区别。

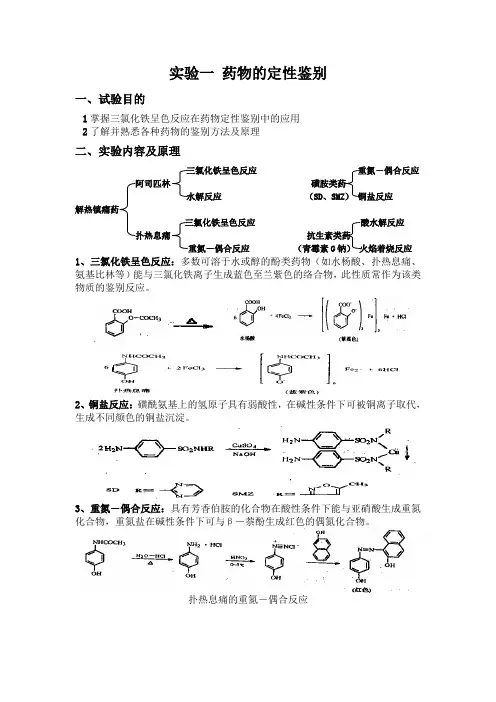
实验一药物的定性鉴别一、试验目的1掌握三氯化铁呈色反应在药物定性鉴别中的应用2了解并熟悉各种药物的鉴别方法及原理二、实验内容及原理三氯化铁呈色反应重氮-偶合反应磺胺类药水解反应(SD、SMZ)铜盐反应解热镇痛药三氯化铁呈色反应酸水解反应抗生素类药(青霉素G钠)火焰着烧反应1、三氯化铁呈色反应:多数可溶于水或醇的酚类药物(如水杨酸、扑热息痛、氨基比林等)能与三氯化铁离子生成蓝色至兰紫色的络合物,此性质常作为该类物质的鉴别反应。
2、铜盐反应:磺酰氨基上的氢原子具有弱酸性,在碱性条件下可被铜离子取代,生成不同颜色的铜盐沉淀。
3、重氮-偶合反应:具有芳香伯胺的化合物在酸性条件下能与亚硝酸生成重氮化合物,重氮盐在碱性条件下可与β-萘酚生成红色的偶氮化合物。
扑热息痛的重氮-偶合反应磺胺类药物的重氮-偶合反应4 水解反应:在水溶液中,有些化合物(如阿司匹林、青霉素盐类等物质)容易在酸、碱、热等条件下发生水解,生成具有不同颜色的难溶性物质。
阿司匹林的水解反应青霉素钠(钾)的酸水解反应三、药品与器材1、药品:阿司匹林、扑热息痛、磺胺甲恶唑(SMZ)、磺胺嘧啶(SD)、青霉素钠(钾)2、试剂:三氯化铁试液,1%氢氧化钠溶液,硫酸铜试液,稀盐酸,0.1 mol/L 的亚硝酸钠试液,碱性β-萘酚试液,碳酸钠试液,稀硫酸3、器皿:玻璃试管,滴管,酒精灯,试管夹,铂耳,水浴锅四、实验步骤1、三氯化铁成色反应(1)取2支试管,用药匙取少量(约30mg)药品(阿司匹林、扑热息痛)分别加入试管中,加约5ml蒸馏水,振摇溶解后加1-2滴三氯化铁试液,观察溶液颜色(显兰紫色的为扑热息痛)。
(2)取1支试管,取上述少量上述无颜色反应的药品于试管中,加约5ml蒸馏水后于酒精灯上微火煮沸,放冷后加1滴三氯化铁试液,溶液应显蓝色(为阿司匹林)2、铜盐反应:取2支试管,分别加入少量(约0.1g)药品(SD、SMZ),加约3ml 蒸馏水,充分摇匀,缓慢滴加1%氢氧化钠溶液至恰好溶解为止(碱切忌过量),再各加硫酸铜试液1-2滴,则产生不同颜色的铜盐沉淀。

第1篇一、实验目的本实验旨在通过对布洛芬片进行一系列的化学和物理实验,验证其成分、纯度和质量,确保药品的安全性和有效性。
二、实验材料1. 布洛芬片(市售)2. 水浴锅3. 试管4. 烧杯5. 碘化铋钾溶液6. 硫酸铜溶液7. 碘溶液8. 氢氧化钠溶液9. 纯净水10. 移液管11. 紫外可见分光光度计12. 电子天平三、实验方法1. 外观检查- 观察布洛芬片的外观,记录颜色、形状、大小等特征。
2. 溶解性实验- 将布洛芬片置于试管中,加入适量纯净水,观察其溶解情况。
3. 化学鉴别实验- 碘化铋钾反应- 将少量布洛芬片粉末加入试管中,加入碘化铋钾溶液,观察是否有沉淀生成。
- 硫酸铜反应- 将少量布洛芬片粉末加入试管中,加入硫酸铜溶液,观察是否有颜色变化。
- 碘溶液反应- 将少量布洛芬片粉末加入试管中,加入碘溶液,观察是否有颜色变化。
4. 含量测定- 紫外可见分光光度法- 称取一定量的布洛芬片粉末,按照紫外可见分光光度计的说明书进行操作,测定其吸光度,根据标准曲线计算含量。
5. 纯度测定- 使用高效液相色谱法(HPLC)对布洛芬片进行纯度分析,确保其纯度符合国家标准。
四、实验结果1. 外观检查- 布洛芬片为白色或类白色片状,表面光滑,无霉变、潮解等现象。
2. 溶解性实验- 布洛芬片在纯水中溶解度较好,溶解速度快。
3. 化学鉴别实验- 碘化铋钾反应:产生淡黄色沉淀,符合布洛芬的化学特征。
- 硫酸铜反应:溶液颜色无明显变化。
- 碘溶液反应:溶液颜色无明显变化。
4. 含量测定- 紫外可见分光光度法测定结果显示,布洛芬片中的布洛芬含量符合国家标准。
5. 纯度测定- HPLC分析结果显示,布洛芬片的纯度符合国家标准。
五、实验结论通过本次实验,我们验证了布洛芬片的外观、溶解性、化学成分、含量和纯度均符合国家标准,可以认为该批布洛芬片质量合格,安全有效。
六、实验注意事项1. 实验过程中应严格按照操作规程进行,确保实验结果的准确性。


化学分析一般鉴别试验————————————————————————————————作者: ————————————————————————————————日期:化学分析一般鉴别试验(二)---芳香第一胺类\苯甲酸盐\乳酸盐\枸橼酸盐\钙盐\钡盐芳香第一胺类取供试品约50mg,加稀盐酸1ml,必要时缓缓煮沸使溶解,放冷,加0.1mol/L亚硝酸钠溶液数滴,滴加碱性β-萘酚试液数滴,视供试品不同,生成由橙黄到猩红色沉淀。
苯甲酸盐(1) 取供试品的中性溶液,加三氯化铁试液,即生成赭色沉淀;加稀盐酸,变为白色沉淀。
(2) 取供试品,置干燥试管中,加硫酸后,加热,不炭化,但析出苯甲酸,在试管内壁凝结成白色升华物。
乳酸盐取供试品溶液5ml(约相当于乳酸5mg),置试管中,加溴试液1ml与稀硫酸0.5ml,置水浴上加热,并用玻棒小心搅拌至退色,加硫酸铵4g,混匀,沿管壁逐滴加入10%亚硝基铁氰化钠的稀硫酸溶液0.2ml 和浓氨试液1ml,使成两液层;在放置30分钟内,两液层的接界面处出现一暗绿色的环。
ﻫ枸橼酸盐(1)取供试品溶液2ml(约相当于枸橼酸10mg),加稀硫酸数滴,加热至沸,加高锰酸钾试液数滴,振摇,紫色即消失;溶液分成两份,一份中加硫酸汞试液1滴,另一份中逐滴加入溴试液,均生成白色沉淀。
(2)取供试品约5mg,加吡啶-醋酐(3∶1)约5ml,振摇,即生成黄色到红色或紫红色的溶液。
ﻫ钙盐(1) 取铂丝,用盐酸湿润后,蘸取供试品,在无色火焰中燃烧,火焰即显砖红色。
(2) 取供试品溶液(1→20),加甲基红指示液2滴,用氨试液中和,再滴加盐酸至恰呈酸性,加草酸铵试液,即生成白色沉淀;分离,沉淀不溶于醋酸,但可溶于盐酸。
ﻫﻫ钠盐(1) 取铂丝,用盐酸湿润后,蘸取供试品,在无色火焰中燃烧,火焰即显鲜黄色。
(2)取供试品的中性溶液,加醋酸氧铀锌试液,即生成黄色沉淀。
ﻫ钡盐(1) 取铂丝,用盐酸湿润后,蘸取供试品,在无色火焰中燃烧,火焰即显黄绿色;通过绿色玻璃透视,火焰显蓝色。

氯化亚铜鉴别试验
氯化亚铜是一种常见的化学物质,通常用于实验室中的化学分析和合成反应。
要进行氯化亚铜的鉴别试验,可以采取以下方法:
1. 溶解性测试,将氯化亚铜样品加入水中,观察其溶解性。
氯化亚铜在水中能够溶解,生成蓝绿色的溶液。
2. 氢氧化钠试剂,将氯化亚铜溶液加入氢氧化钠溶液中,观察有无沉淀生成。
氯化亚铜与氢氧化钠反应生成蓝色的沉淀,这是氯化亚铜的特征之一。
3. 硫化氢气体试验,通过通入硫化氢气体到氯化亚铜溶液中,观察是否生成沉淀。
氯化亚铜会和硫化氢反应生成黑色的硫化铜沉淀。
4. 碳酸氢铵试剂,将氯化亚铜溶液加入碳酸氢铵溶液中,观察有无沉淀生成。
氯化亚铜会与碳酸氢铵反应生成淡蓝色的沉淀。
5. 火焰试验,将氯化亚铜样品加入火焰中,观察火焰颜色。
氯化亚铜在火焰中会呈现出绿色的颜色。
通过以上鉴别试验,可以全面了解氯化亚铜的性质和特征,从而进行准确的鉴别。
希望以上信息能够对你有所帮助。
实验一药物的鉴别实验——大山楂丸的鉴别一、目的要求1. 掌握药物的化学鉴别和薄层色谱鉴别试验。
2. 掌握药物分析的前处理方法。
3. 熟悉其它药品检测方法及要求。
二、主要仪器与药品超声仪、水浴锅、烤板器;移液管、蒸发皿、分液漏斗、漏斗、锥形瓶、展缸、薄层色谱板;乙醇、甲醇、正丁醇、氯仿、丙酮、水、盐酸、镁粉。
三、实验方法大山楂丸组方为山楂、六神曲(麸炒)、炒麦芽,为棕红色或褐色的大蜜丸。
1. 化学鉴别取本品9 g,剪碎,加乙醇40 mL,超声10分钟,滤过,取续滤液10 mL蒸干,残渣加水2 mL,加热使溶解(分三次加入,溶液合并),用正丁醇3 mL振摇,萃取正丁醇层,蒸干,残渣加甲醇1mL溶解。
溶液(a)加少量镁粉与盐酸2~3滴,加热4~5分钟后,即显橙红色。
2. 薄层鉴别取上述溶液(a),作为供试品溶液。
另取熊果酸对照品,加甲醇制成对照品溶液。
吸取上述两种溶液适量,分别点于同一硅胶G薄层板上,以三氯甲烷-丙酮(9:1)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰。
供试品色谱中,在与对照品色谱相应的位置上,显相同的紫红色斑点。
四、注意事项1. 移液管的使用移取溶液前,先用吸水纸将尖端外的水吸除掉,然后用待吸溶液转洗3次。
吸取溶液时,将移液管直接插入液面下1~2 cm深处。
用右手拿移液管,左手拿洗耳球,排出球内空气,紧接管口上,使溶液缓慢上升,管内溶液上升至标线以上时,移去洗耳球,右手食指迅速按紧管口,把移液管提出液面,左手拿容器,倾斜45°,将管的尖端垂直紧贴容器的内部,食指稍松,使液面缓慢下降,待管中溶液的凹液面与刻度线相切时,用食指紧按管口,使溶液不再外漏。
此时溶液恰好为管上所示容量。
用左手拿另一洁净的容器,右手将移液管放入容器,方法同上,待溶液自然流完,停15 s后取出移液管。
凡移液管上未写“吹”字的,其残留液不用吹出,若管上标有“吹”字,其残留液必须吹出。
如何进行常见物质的鉴别实验在日常生活和科学研究中,我们常常需要对不同的物质进行鉴别实验。
这些实验可以帮助我们确定物质的性质和组成,以及判断其与其他物质的不同之处。
本文将介绍几种常见物质的鉴别实验方法,以供参考。
一、化学试剂法化学试剂法是鉴别物质的常用方法之一。
通过与特定的试剂反应,可以观察到不同的颜色变化、沉淀形成或气体的产生来判断物质的性质。
1.鉴别酸和碱:可使用酸碱指示剂,如酚酞或溴酚蓝。
将待鉴别物质滴入试管中,加入少量指示剂,观察颜色的变化。
若颜色变为红色,表明物质是酸性的;若颜色变为蓝色,表明物质是碱性的。
2.鉴别金属离子:添加NaOH溶液,若出现白色沉淀,则可能含有银离子;若出现蓝色沉淀,则可能含有铜离子;若出现绿色沉淀,则可能含有镍离子。
3.鉴别气体:可使用气体试管或气体收集装置收集待鉴别物质产生的气体。
然后使用特定试剂,如氯水或红磷,在气体中进行着色试验。
不同的气体与试剂反应后,会产生不同的颜色。
二、物理性质测试法物理性质测试法是通过测量物质的物理特性来进行鉴别实验的一种方法。
1.密度测定:通过测量物质的质量和体积计算得出物质的密度值。
物质的密度是其独特的物理性质,可以用来与其他物质进行区分。
2.熔点和沸点测定:将待鉴别物质加热,并使用温度计测量其熔点或沸点。
不同物质的熔点和沸点存在差异,可以根据测量结果判断物质的性质。
3.溶解性检测:将待鉴别物质溶解于不同的溶剂中,观察其溶解度和溶液的特点。
不同物质在不同溶剂中的溶解性也存在差异,可供鉴别使用。
三、仪器分析法仪器分析法是使用科学仪器对物质进行鉴别的方法。
常用的仪器包括质谱仪、红外光谱仪、核磁共振仪等。
1.质谱分析:通过物质分子在迅速撞击下的分解和离子化,测定其分子示性峰值和相对丰度,从而确定物质的成分和结构。
2.红外光谱分析:通过测量物质在红外光区的吸收谱图,判断物质的官能团、键合和分子结构等。
3.核磁共振分析:通过测量物质中氢原子核或碳原子核在外加磁场下的共振现象,可以得到物质的结构和组成信息。
实验一有机化合物熔点和沸点的测定一、有机化合物熔点的测定:(一)实验目的1.了解有机化合物熔点、沸点的概念、测定的原理及意义。
2.掌握微量法测定熔点、沸点的操作技术。
物质熔点的测定是有机化学工作者经常用的一种技术,所得的数据可用来鉴定晶状的有机化合物,并作为该化合物纯度的一种指标。
测定的意义:可以鉴别未知的固态化合物和判断化合物的纯度。
(二)熔点测定原理什么叫熔点——用物质的蒸气压与温度的关系理解。
熔点的定义:固、液两态在标准大气压下达到平衡状态,即固相蒸气压与液相蒸气压相等时的温度。
固态物质受热后,从开始熔化(初熔)至完全熔化(全熔)的温度范围就是该化合物的熔点(实际上是熔点范围。
称为熔程或熔距。
)测熔点时几个概念:始熔(初熔)、全熔、熔点距、物质纯度与熔点距关系。
始熔(初熔)——密切注意熔点管中样品变化情况。
当样品开始塌落,并有液相产生时(部分透明),表示开始熔化(初熔),即记录为初溶温度t1。
全熔——当固体刚好完全消失时(全部透明),则表示完全熔化(全熔)。
记录温度t2 。
熔距或熔程——从初熔到全熔的温度范围。
t1~t2为熔程。
纯净物一般不超过0.5~10C化合物的熔点是指在常压下该物质的固—液两相达到平衡时的温度。
但通常把晶体物质受热后由固态转化为液态时的温度作为该化合物的熔点。
纯净的固体有机化合物一般都有固定的熔点。
在一定的外压下,固液两态之间的变化是非常敏锐的,自初熔至全熔(称为熔程) 纯净的固体有机化合物转化为液态时的温度不超过0.5-1℃。
若混有杂质则熔点有明确变化,不但熔点距扩大,而且熔点也往往下降。
因此,熔点是晶体化合物纯度的重要标志。
有机化合物熔点一般不超过350℃,较易测定,故可借测定熔点来鉴别未知有机物和判断有机物的纯度。
(三)熔点测定方法:1)显微熔点测定仪《实验化学》第二版书上P1042)数字熔点测定仪《实验化学》第二版书上P1053)双浴式熔点测定器《实验化学》第二版书上P1024)毛细管法测熔点,用b形管测熔点装置(本实验使用)及其它测定方法。
实验一 盐酸普鲁卡因鉴别试验一、 盐酸普鲁卡因1、鉴别依据1)水解产物反应药物中具有酯的结构,在碱性溶液中可水解,利用其水解产物与试剂的反应进行鉴别试验。
盐酸普鲁卡因水溶液与氢氧化钠试液作用,生成普鲁卡因的白色沉淀,加热时变为油状物,能使湿润的红色石蕊试纸变蓝。
溶液放冷后,加盐酸酸化,则析出对氨基苯甲酸的白色沉淀,此沉淀能在过量的盐酸中溶解。
H 2N COOCH 2CH 2N C 2H 5C 2H 5.HCl NaOHH 2N COOCH 2CH 2N 2H 52H 5NaOHH 2N COONa +HOCH 2CH 2N(C 2H 5)2H 2N COONa +HCl H 2N COOH +NaCl H 2N COOH +HCl H 2N COOH .HCl2)重氮化—偶合反应凡具芳伯氨基的药物,均可在酸性溶液中与亚硝酸钠试液作用,生成重氮盐,再与碱性β-萘酚偶合产生红色偶氮化合物。
NH 22CH 2N(C 2H 5)2.HCl +NaNO 2+HCl N +COOCH 2CH 2N(C 2H 5)2+NaCl +2H 2O2、鉴别1)、取本品约0.1g ,加水2ml,溶解后,加10%氢氧化钠溶液1ml ,生成白色沉淀;加热,变为油状物中,继续加热,发生的蒸气使湿润的红色石蕊试纸变为蓝色,热至油状物消失后,放冷,加盐酸酸化,即析出白色沉淀。
2)、芳香第一胺类的鉴别取本品约50mg,加稀盐酸1ml ,必要时缓缓煮沸使溶解,放冷,加0.1mol/L ,亚硝酸钠溶液数滴,滴加碱性β-萘酚试液数滴,生成橙黄到猩红色沉淀。
实验二 盐酸普鲁卡因稳定性实验一、目的要求1. 了解pH 值对盐酸普鲁卡因溶液稳定性的影响。
2. 了解薄层层析法检查药物中杂质的方法。
二、实验原理盐酸普鲁卡因为局部麻醉药,作用强,毒性低。
临床上主要用于浸润、脊椎及传导麻醉。
盐酸普鲁卡因化学名为对氨基苯甲酸2-二乙胺基乙酯盐酸盐,化学结构式为: N H 2COOCH 2CH 2N(C 2H 5)2 . HCl盐酸普鲁卡因为白色细微针状结晶或结晶性粉末,无臭,味微苦而麻。
化学鉴别试验(一)
化学鉴别试验是通过对待测样品进行一系列化学反应和分析操作,从
而确定其成分、结构和性质的方法。
这种试验的目的是提供关于待测
样品的化学信息,以进行精准的分析和鉴定。
本文将介绍化学鉴别试
验的原理、方法和应用。
一、化学鉴别试验的原理
化学鉴别试验的基本原理是利用待测物质的化学特性与已知物质进行
反应,从而证明它们的相同或者不同。
通常情况下,鉴别试验会使用
化学试剂、溶液、试纸等化学品,将待测物质与这些物质反应。
通过
检测化学试剂在反应中的颜色、气味、产生沉淀等化学变化,来判断
待测物质的性质。
二、化学鉴别试验的方法
化学鉴别试验可以分为宏观和微观两种方法。
宏观方法是通过肉眼观
察样品的物理性质进行测试,包括样品的形态、颜色、质地、溶解度、比重等。
微观方法则是利用实验室器材和化学试剂,通过化学反应的
原理进行分析。
其中最常用的方法有以下几种:
1. 化学沉淀法:待测物质与化学试剂反应后,会生成一种沉淀物,通
过观察和检测沉淀物的质、量来判断物质的性质。
2. 酸碱滴定法:通过不同试剂间的酸碱反应,来测定待测物质的酸碱度,帮助确定物质的性质。
3. 色谱法:将不同物质置于不同的载体中,通过不同载体对物质的分
离和检测来确定样品的性质。
4. 热分析法:将物质加热至高温,并观察其物质组成的变化,可以确
定样品的组成和性质。
三、化学鉴别试验的应用
化学鉴别试验广泛应用于各种分析试验和质量控制中。
它可以用于检
测食品、药品、化妆品等制品的产品质量和成分,还可用于毒物控制、炸弹鉴定、指纹分析、环境污染监测等领域。
尤其是在化学教育中,
化学鉴别试验是非常重要的环节,可以帮助学生更好地理解化学原理
和实验技能。
总之,化学鉴别试验是一种非常重要的化学分析方法,在各种领域中
都有广泛的应用。
随着新技术和新成果的不断涌现,化学鉴别试验将
更加精准、高效,为各个领域的分析和鉴定提供更大的帮助和支持。