电导电导率和摩尔电导(课堂PPT)
- 格式:ppt
- 大小:362.00 KB
- 文档页数:13


溶液的电导、电导率、摩尔电导率溶液的电导、电导率、摩尔电导率是描述溶液导电性质的重要物理化学参数。
溶液的电导指溶液在外加电压的作用下通过的电流强度,是反映溶液导电能力的物理量。
电导率是指单位长度、单位截面积的溶液导电能力,是电导和电流的比值。
摩尔电导率是指单位摩尔浓度的溶液在单位长度、单位截面积内的导电能力。
溶液的电导和电导率是溶液中电解质的浓度和性质的函数。
一般来说,溶液中溶解的电解质浓度越高,溶液的电导和电导率就越大。
此外,电解质的种类和离子的迁移率也会影响溶液的电导和电导率。
一般来说,离子的迁移率越大,溶液的电导和电导率就越高。
因此,电导和电导率可以用来研究溶液中电解质的浓度和性质,以及离子的迁移率等参数。
摩尔电导率是用来比较不同溶液中电解质导电能力的物理量。
摩尔电导率不仅与溶液中电解质的浓度和性质有关,还与电解质的迁移率有关。
因此,摩尔电导率也可以用来研究电解质的浓度和性质,以及离子的迁移率等参数。
测定溶液的电导、电导率、摩尔电导率可以通过导电仪、电导率计等实验仪器进行。
一般来说,实验中可以控制温度、电解质浓度和性质等参数,以研究它们对溶液的电导和电导率的影响。
通过实验可以得到不同溶液的电导、电导率、摩尔电导率等数据,从而研究电解质的浓度和性质,以及离子的迁移率等参数。
在实际应用中,测定溶液的电导、电导率、摩尔电导率是非常重要的。
例如,通过测定水中的电导和电导率可以判断水中是否含有电解质,从而判断水的纯净度。
此外,电导和电导率还可以用来研究溶液中电解质的浓度和性质等参数,以及离子的迁移率等物理化学性质。
因此,测定溶液的电导、电导率、摩尔电导率对于化学、生物、环境等领域都具有重要的应用价值。
总之,溶液的电导、电导率、摩尔电导率是描述溶液导电性质的重要物理化学参数。
它们可以用来研究电解质的浓度和性质,以及离子的迁移率等参数。
通过测定溶液的电导、电导率、摩尔电导率可以了解电解质的浓度和性质,从而对溶液的物理化学性质有深入的了解。

§7.2 电解质溶液的电导率和摩尔电导率1. 电导和电导率通过溶液的电流强度I 与溶液电阻R 和外加电压V 服从欧姆定律R =V/I ;而溶液的电阻率ρ可根据(/)R A l ρ=计算。
通过测量电阻(resistance, R )和电阻率(resistivity, ρ)即可评价电解质溶液的导电能力,不同的是l 为两电极间的距离,而A 则取浸入溶液的电极面积。
习惯上多用电导(conductance ,G )和电导率(conductivity, κ)来表示溶液的导电能力,定义:G =1/R κ=1/ρ电导G 的单位是Ω-1,也记为S(西门子),κ的单位是S·m -1。
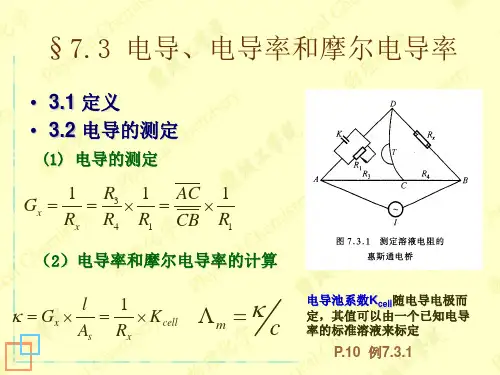
电导和电导率间的关系:l G A κ⎛⎫=⎪⎝⎭(7.3)2. 电导的测量通常采用电导率仪(conductometer )来测量电解质溶液的电导,其原理如图7.2。
测量时将电导电极(conductance electrode )插入待测溶液或将待测溶液充入具有两个固定Pt 电极的电导池(conductance cell )M 中,而后将M 连入惠斯登(Wheatstone)电桥的一臂。
测量方法与测定金属的电阻相同但技术上需做一些改进,如测量时不用直流电源而改用1000 Hz 的高频交流电源S ;以耳机或示波器T 来指示桥中零电流;在电桥另一臂的可变电阻R 1上需串联一个可变电容器K 以补偿电导池的电容。
电桥平衡时有314R R RR =3141R G RR R ==(7.4)溶液的电导率可按(7.3)式求算。
式中(l /A)称为电导池常数(conductance cell constant )。
不同的电导池具有不同的电导池常数,即使是同一电导池,其电导池常数也会随时间而改变。
实际测量时多用标准溶液(standard solution )法,即先将一精确已知电导率(κs )的标准溶液充入电导池,在指定温度下测定其电导(G s ),而后再将待测溶液充入该电导池测量其电导(G ),分别带入(7.3)式比较可得:ssG G κκ= (7.5)式中不再出现电导池常数。


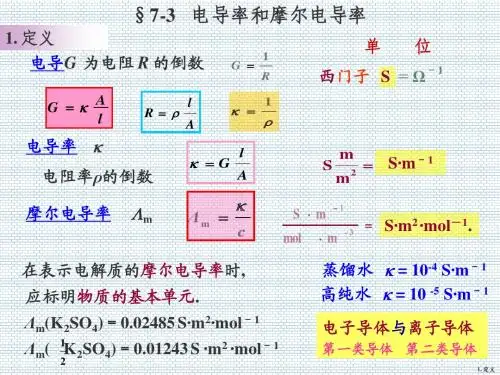
物理化学电导、电导率及摩尔电导率Array1.什么是电导,电导率,摩尔电导率,三者定义式如何书写?2.描述导体导电能力的物理量有哪些?3.如何测量电导?4.如何计算电导率、摩尔电导率?5.如何求电导池系数?1、电导 电导、电导率、摩尔电导率定义一sA l R ρ= 电导 单位为 (西门子siemens ), 。
G S 111-Ω=S RG 1=R G 电导 为电阻的倒数。
电导、电导率、摩尔电导率都是描述导体导电能力大小的物理量。
2、电导率物理意义:相距单位长度、单位面积的两平行板电极 间充满电解质溶液时的电导,单位 S ·m -1。
ρκ1=电导率κ即为电阻率ρ的倒数。
m cκΛ=3、摩尔电导率 相距1m的两个平行电极之间含有1mol 电解质溶液,溶液所具有的电导。
S·m 2·mol -1Λm—mol·m -3S·m -1mΛWheatstone Bridge测定时,接通电源,选择一定电阻的R2,移动接触点C,直到检流计G显示为零,此时电桥平衡。
4321R R R R =电导的测定二11R G =根据ss A l R A l G ⨯=⨯=1κ 欲求得某一电导池的电导池系数,方法是用一已知电导率的溶液注入该电导池,测得其电阻,即可求出K cell 。
电导率计算三Rcell K =κ定义:电导池系数,单位 m -1 。
Rκ=cell K Rcell K =κcm κ=Λmol·m -3已知待测例题PPT 模板下载:/moban/ 行业PPT 模板:/hangye/ 节日PPT 模板:/jieri/ PPT 素材下载:/sucai/PPT 背景图片:/beijing/ PPT 图表下载:/tubiao/ 优秀PPT 下载:/xiazai/ PPT 教程: /powerpoint/ Word 教程: /word/ Excel 教程:/excel/ 资料下载:/ziliao/ PPT 课件下载:/kejian/ 范文下载:/fanwen/ 试卷下载:/shiti/ 教案下载:/jiaoan/ 字体下载:/ziti/谢谢观看。
第二节 电导、电导率与摩尔电导率 电解质溶液和金属导体一样,服从下列关系V R I = l R Aρ= R 、ρ越小,导体的导电能力越好。
但是,对于电解质溶液,其导电能力通常用电导G 和电导率κ来描述。
一、电导及电导率1.电导1 def G R(6-4) G 的单位为1()S -Ω=西门子。
当溶液中有多种电解质时,则溶液的总电导是所有电解质的电导之和,即123G G G G =+++2.电导率(以前也称比电导)11def l G A l R A ρκ== (6-5)式中l 为两电极间的距离,A 为电极面积。
κ的单位为11/m S m --Ω⋅=。
令l A l K A= 称为电导池常数,与电导池几何特征有关。
⑴物理意义由上式可知,当A =1m 2,l =1m 时,G =κ。
因此,κ就是长1m 、截面积为1m 2的导体所具有的电导。
对电解质溶液来说,其κ就是相距1m ,电极面积为1m 2的两个平行板电极间放置1m 3电解质溶液时的电导。
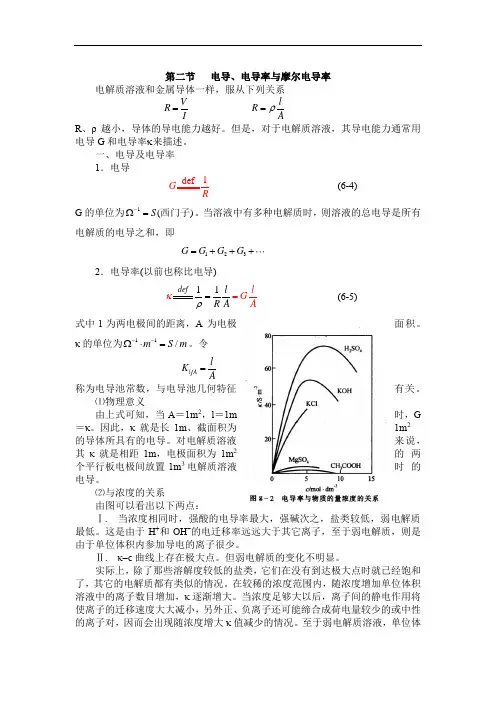
⑵与浓度的关系由图可以看出以下两点:Ⅰ. 当浓度相同时,强酸的电导率最大,强碱次之,盐类较低,弱电解质最低。
这是由于H +和OH -的电迁移率远远大于其它离子,至于弱电解质,则是由于单位体积内参加导电的离子很少。
Ⅱ. κ-c 曲线上存在极大点。
但弱电解质的变化不明显。
实际上,除了那些溶解度较低的盐类,它们在没有到达极大点时就已经饱和了,其它的电解质都有类似的情况。
在较稀的浓度范围内,随浓度增加单位体积溶液中的离子数目增加,κ逐渐增大。
当浓度足够大以后,离子间的静电作用将使离子的迁移速度大大减小,另外正、负离子还可能缔合成荷电量较少的或中性的离子对,因而会出现随浓度增大κ值减少的情况。
至于弱电解质溶液,单位体。

什么叫溶液的电导,电导率,摩尔电导率溶液的电导是指溶液中离子的导电能力。
在溶液中,离子会带着电荷移动,从而导电。
电导率是指单位长度、单位横截面积的导体所具有的电导能力,通常用西门子/米(S/m)或毫西门子/厘米(mS/cm)来表示。
电导率越高,说明导体的导电能力越强。
摩尔电导率是指在溶液中,单位摩尔浓度下的解离物离子对电流的贡献,通常用西门子/摩尔/厘米(S·m/mol)来表示。
摩尔电导率可以通过测量溶液电导率和溶液浓度,间接计算出来。
总的来说,电导、电导率和摩尔电导率都是衡量溶液导电能力的重要指标,具有广泛的应用价值,例如在化学实验中测量溶液浓度、质量分析和电化学反应研究等方面。
- 1 -。

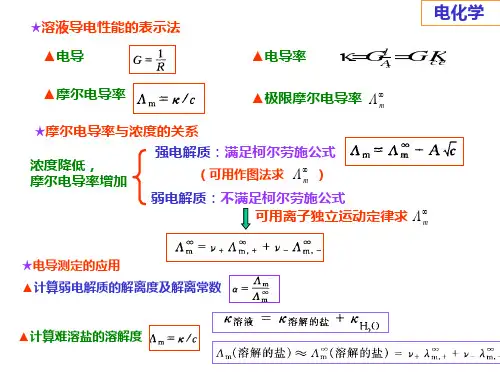
§7.3 电导、电导率和摩尔电导率1、定义(1)电导G :电阻R 的倒数(2)电导率κ:电阻率的倒数(3)摩尔电导率Λm :溶液的电导率与其浓度之比单位:S·m 2·mol -1单位: S (西门子)(Ω-1)Ω★导体的电导率:单位截面积、单位长度时的电导.★电解质溶液的电导率:相距为1m , 面积为1m 2的两个平行板电极之间充满电介质溶液时的电导.1m 21m c κΛ=m s l R ρA =ρκ1=单位: S·m -1∵导体的电阻1G R =1G R ∴=s A l κ=s 1A ρl =×体积为1m 3注意:c 的单位:mol ·m -3(1)电导的测定—惠斯通电桥采用适当频率的交流电源接通电源,移动接触点C ,使CD 间的电流为零。
此时,电桥平衡:431=R R R R x 溶液的电导溶液的电导率电导池系数(2)电导率、摩尔电导率的计算◆测定已知电导率为κ的溶液电阻(电导),求电导池系数K cell 。
◆同法测待测溶液电阻(电导),可计算电导率◆当待测溶液浓度c 已知时,可计算摩尔电导率待测电阻可变电容(抵消电导池电容)交流电源检零器电阻箱电阻R 3、R 4为AC 与CB 的电阻cκΛ=m 2、电导的测定4例:25℃时在一电导池中盛以c 为0.02 mol ⋅dm −3的KCl 溶液,测得其电阻为82.4 Ω。
若在同一电导池中盛以c 为0.025 mol ⋅dm −3的K 2SO 4溶液,测得其电阻为326.0 Ω。
已知25℃时0.02 mol ⋅dm −3的KCl 溶液的电导率为0.2768 S ⋅m -1。
试求:(1)电导池系数K cell ;(2) 0.0025 mol ⋅dm −3K 2SO 4溶液的电导率和摩尔电导率。
解:(1)电导池系数K cell =l /A s =κ(KCl).R (KCl)=(0.2768×82.4)m -1=22.81m -1(2)0.0025 mol/dm 3的K 2SO 4 溶液的电导率κ(K 2SO 4)= K cell /R (K 2SO 4)=(22.81/326.0) S ·m -1=0.06997S ·m -10.0025 mol/dm 3的K 2SO 4的溶液的摩尔电导率Λm (K 2SO 4) = κ(K 2SO 4)/c = (0.06997/2.5) S·m 2 ·mol -1= 0 .02799 S·m 2 ·mol -13.摩尔电导率与浓度的关系#强电解质①溶液浓度↓,摩尔电导率↑②溶液浓度→零,曲线→直线,摩尔电导率趋于极限值,称无限稀释时的摩尔电导率,也称极限摩尔电导率由图可知:无论是强或弱电解质,摩尔电导率均随溶液的稀释而增大。