支原体PCR检测步骤
- 格式:doc
- 大小:23.00 KB
- 文档页数:1

P2-1 TCGTAACAAGGTATCCCTAC P2-2 GCATCCACCAAAAACTCTINTER-P1 GTTCTTTGAAAACTGAAT INTER-P2 GCATCCACCAAAAACTCTP6-1 CACCATCTGTCACTCTGTTAAC P6-2 GGAGCAAACAGGATTAGATAC1. 采集 200ul 样品于 PCR 管中2. 12000g 离心 5mins3. 去上清, 30ulPBS 或者纯水重悬4. 95°C 加热 10mins,冷却到12°C5. 8000g 离心 2mins6. 上清作为样品备用5250,3 1.50.3 1.51 53.4 17P6 引物:95°C 预变性 5mins;95°C 变性 30s;55°C 退火 30s;72 °C 延伸 30s;72°C 充分延伸 10mins;共 30 个循环。
体系相关:1. 提前分装水,每管 400ul;2. 提前分装前向+后向引物,每管30ul;操作相关:1. 操作人员务2. 若多次大批量检测,应更换台子操作3. 加样时,,减少人员流动4. 加样时,手不要在体系上方来回经过5. 加样时,每加完一排八连排,6. Mix+水+引物混合物,勿暴露于空气中过久7. PCR 产物取出时,开盖轻柔,防止气溶胶产生。
最好可以于上样前,将管盖上的液体稍微离心下去。
8. 点样时,,防止气溶胶产生9. 配制 PCR 混合液和处理样品、加样区分开。
若有条件,则在照过紫外的超净工作台上进行加样,避免上一次的支原体的污染。

PCR法支原体检测PCR法支原体测定PROTOCOL生效日期(年-月-日)有效期至(年-月-日)分发部门:质量部1.目的规范PCR法支原体检测的操作方法。
2.范围适用于项目研发过程样品、原液、成品及中间体的分析。
3.责任质量分析人员熟悉并遵守该标准操作规程。
4.定义N/A5.设备、材料和试剂5.1设备、材料设备名生产商型号/货号备注PCR仪Thermo ARKTIK5020 N/A VORTEX IKA GENIUS 3 N/A小型台式冷冻离心机ThermoHERAEUSFresco 21N/A单道移液器(10ul,20ul,100ul)Eppendorf Research plus N/A 多功能水平电泳槽Tanon HE-120 N/A凝胶成像系统BIORAD ChemiDoc™XRS+ SystemN/A5.2试剂试剂名称生产商货号TaKaRa PCRMycoplasma DetectionSetTaKaRa 6601 TaKaRa Ex Taq® TaKaRa RR001ARegular Agarose G-10 Biowest N/A Goldview 国产N/A 10×Loading Buffer TaKaRa 9157DL5000 DNA Marker TaKaRa 3428A 内毒素检查用水厦门鲎试剂实验厂有限公司6.溶液配制6.1 50× TAE Buffer称取242.0g Tris,37.2g Na2EDTA·2H2O于1L烧杯中,向烧杯中加入约800ml超纯水,充分混匀,加入57.1ml冰乙酸,充分溶解,加入超纯水定容至1L,室温保存。
有效期6个月。
6.2 1× TAE Buffer量取10ml 50× TAE Buffer,加入490ml超纯水,充分混匀。
有效期6个月。
7.操作步骤用于检测支原体的样品是接种后进行3-6天细胞培养的培养上清液。

支原体肺炎的病原体检测技术和方法支原体肺炎是一种由支原体引起的呼吸道感染,常见于婴幼儿和学龄前儿童。
该疾病的早期症状与普通感冒相似,包括咳嗽、喘息、发热等。
因此,准确快速地确定支原体是引起肺炎的病原体对于疾病的诊断和治疗具有重要意义。
在本文中,将阐述支原体肺炎的病原体检测技术和方法。
一、基于PCR的病原体检测技术聚合酶链式反应(PCR)是一种常用的病原体检测技术,它通过扩增病原体DNA或RNA片段来检测病原体的存在。
对于支原体肺炎,PCR技术可以检测其基因组中的特异性序列。
PCR技术具有高度灵敏度和特异性,能够快速准确地检测病原体,但需要实验室设备和经验丰富的专业人员进行操作,并且需要一定的时间。
二、快速免疫学试验快速免疫学试验是一种基于抗原-抗体反应原理的技术,用于检测特定抗原或抗体的存在。
针对支原体肺炎,快速免疫学试验可以检测支原体的抗原或宿主血液中的抗原。
该方法操作简单、快速,可以在短时间内得出结果。
然而,快速免疫学试验有可能出现假阳性或假阴性的情况,因此,对于结果的准确性还需要进一步验证。
三、基于质谱的病原体检测技术质谱技术是一种通过测量样品中分子的质量和相对丰度来确定样品组成的技术。
对于支原体肺炎的检测,质谱技术可以通过分析支原体所特有的蛋白质质谱图谱来确定其存在。
该技术具有高度灵敏度和分辨率,能够快速准确地检测支原体。
然而,质谱技术的设备较昂贵,需要经过专业培训的人员进行操作,因此在实际应用中受到一定的限制。
四、基于核酸杂交的病原体检测技术核酸杂交是一种通过比较样品中目标序列与探针序列的互补性来检测目标序列的存在的技术。
在支原体肺炎的检测中,核酸杂交技术可以使用具有支原体特异性的探针来检测支原体的存在,从而确定其病原性。
核酸杂交技术具有高度的特异性和灵敏度,且对样品处理较为简单,因此在实际应用中被广泛采用。
总结起来,支原体肺炎的病原体检测技术和方法主要包括基于PCR的检测技术、快速免疫学试验、基于质谱和基于核酸杂交的检测技术。
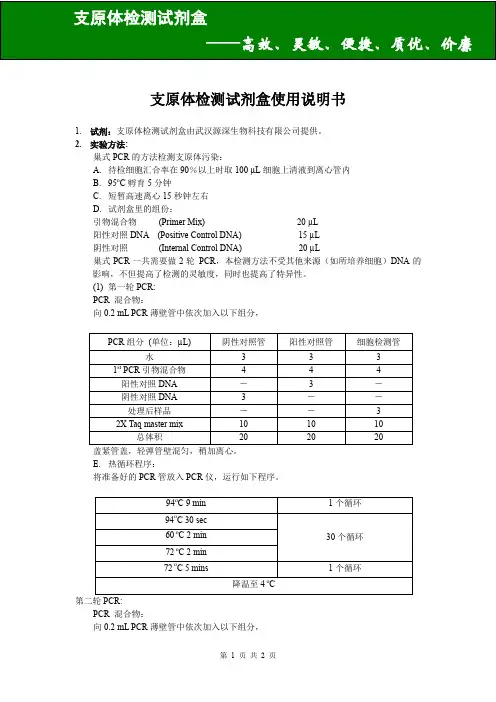
支原体检测试剂盒使用说明书1.试剂:支原体检测试剂盒由武汉源深生物科技有限公司提供。
2.实验方法:巢式PCR的方法检测支原体污染:A.待检细胞汇合率在90%以上时取100 µL细胞上清液到离心管内B.95o C孵育5分钟C.短暂高速离心15秒钟左右D.试剂盒里的组份:引物混合物(Primer Mix) 20 µL阳性对照DNA (Positive Control DNA) 15 µL阴性对照(Internal Control DNA) 20 µL巢式PCR一共需要做2轮PCR,本检测方法不受其他来源(如所培养细胞)DNA的影响,不但提高了检测的灵敏度,同时也提高了特异性。
(1)第一轮PCR:PCR 混合物:向0.2 mL PCR薄壁管中依次加入以下组分,盖紧管盖,轻弹管壁混匀,稍加离心。
E.热循环程序:将准备好的PCR管放入PCR仪,运行如下程序。
PCR 混合物:向0.2 mL PCR薄壁管中依次加入以下组分,盖紧管盖,轻弹管壁混匀,稍加离心。
F. 热循环程序:将准备好的PCR 管放入PCR 仪,运行如下程序。
试验结果:2% 琼脂糖凝胶电泳,TBE 缓冲液,PCR 产物及Marker 均点样10µL ,于50V 下电泳1hr ,EB 染色15min ,紫外灯下观察。
电泳结果见下图:图中泳道M 为DNA Marker ,1和2为待检测细胞系的第一轮PCR 产物 (1st ),3和4为待检测细胞系的第二轮PCR 产物 (2nd ), 其中1、3为阳性对照管PCR 产物,2、4为阴性对照PCR 产物。
阳性对照管在200bp 左右,和300-400 bp 处各有一条带,证明本次实验准确可靠 (不同的支原体Mycoplasma, such as M. fermentans, M. hyorhinis, M. arginini, M. orale, M. hominis, M. arthritidis, M. hyopneumoniae and Acholeplasma laidlawii 的保守区的片段长度不一,大概在200-400 bp 之间)。

PCR检测支原体方法如下:
1、吸取待检细胞的培养液100ul,转移入无菌的1.5ml 离心管中。
请注意:待检
细胞必须换液24小时以上,否则会有假阴性结果。
2、将盛有100ul待检培养液的 1.5ml 离心管用金属浴或空气浴在95℃加热
5min。
请注意:加热过程中,要保持离心管的盖子是盖紧的。
(因为在加热时,盖子会自己崩开,可以在离心管上放置书本之类的物品压住盖子)
3、高速离心,13200rpm,1min。
4、配制PCR反应体系:
1)待检样品数量+1个阳性对照+1个阴性对照=总的样品数量。
2)阳性对照是以往确定被支原体污染的样品,阴性对照是灭菌超纯水。
3)PCR反应体系:
H2O(灭菌超纯水)13 ul
Buffer 10×(必须含Mg2+) 2 ul
dNTP0.8 ul
Primer(+) (10uM)0.5 ul
Primer(-)(10uM)0.5 ul
Polymerase0.2 ul
Sample 3 ul
4)PCR反应程序:
94℃2min
94℃30sec
55℃30sec
72℃20sec
GOTO step 2 , 36 times
72℃7min
5、配制2%的琼脂糖胶,上样量5-10ul。
6、20-30min后观察结果,阳性条带在200-300bp。
引物序列:
Primer(+):’GGGAGCAAACAGGATTAGATACCCT3’
Primer(-):5’TGCACCATCTGTCACTCTGTTAACCTC3’。

支原体pcr检测原理
支原体PCR检测是一种用于检测支原体(Chlamydia trachomatis)存在的分子生物学技术。
PCR(聚合酶链式反应)是一种用于扩增特定DNA序列的方法,支原体PCR检测利用这一原理来检测支原体的存在。
首先,样本(通常是尿液或分泌物)中的DNA被提取出来。
这可以通过化学方法或商用的DNA提取试剂盒来实现。
提取出的DNA 中可能含有支原体的DNA。
接下来,提取出的DNA将被加入PCR反应管中,同时加入PCR 反应液,其中包括引物(primers)、DNA聚合酶和核苷酸。
引物是专门设计用来与支原体DNA序列特定部分匹配的短链DNA片段。
在PCR反应中,引物将会结合到目标DNA序列的两端。
PCR反应包括多个循环,每个循环包括DNA的变性(解链)、引物的结合和DNA聚合的步骤。
在每个循环中,DNA聚合酶会复制目标DNA序列,使其数量呈指数增长。
最后,通过观察PCR反应后产生的产物,可以确定是否存在支
原体DNA。
通常,PCR产物会经过电泳分析或其他技术进行检测,以确认是否存在特定大小的DNA片段,这些片段与支原体DNA序列匹配。
总的来说,支原体PCR检测利用PCR技术扩增样本中的支原体DNA,并通过检测扩增产物来确定是否存在支原体。
这种方法具有高度的敏感性和特异性,因此被广泛用于支原体感染的诊断。

支原体检验标准操作规程记录
支原体是一种细菌,可以引起一些疾病,例如支原体肺炎。
支原体检验通常是通过采集患者的呼吸道分泌物样本进行检测。
下面是支原体检验的标准操作规程记录:
1. 样本采集,首先,医务人员需向患者解释采集支原体样本的过程,并确保患者理解并同意。
然后,使用标本采集棒从患者的咽部或鼻腔采集分泌物样本。
确保采集的样本足够用于后续的检测。
2. 样本保存和运输,采集完样本后,将其置于适当的容器中,并尽快送往实验室进行检测。
在运输过程中,需要确保样本的稳定性和完整性,避免样本污染或损坏。
3. 样本检测,实验室技术人员根据标准操作规程,使用适当的检测方法对支原体样本进行检测。
常见的检测方法包括PCR(聚合酶链反应)和培养法。
在检测过程中,需要严格遵守操作规程,确保结果的准确性和可靠性。
4. 结果记录和报告,一旦检测完成,实验室应当及时记录检测结果,并按照相关规定向医务人员报告。
检测结果应当包括阳性或
阴性的判定,以及可能的数量或浓度信息。
5. 结果解读和处理,医务人员在收到检测结果后,应当结合患
者的临床症状和其他检查结果进行综合分析和判断。
根据检测结果,及时采取相应的治疗措施,并告知患者相关信息。
以上是支原体检验的标准操作规程记录,这些步骤和规程的严
格执行对于确保支原体检验的准确性和可靠性非常重要。
希望这些
信息能够对你有所帮助。

支原体检测方法支原体感染是一种常见的性传播疾病,由于其很容易与尿路感染或妇科炎症相混淆,所以早期正确的诊断,有助于及时使用对症的药物来治疗,如抗生素、李小平利尿消炎丸或妇炎丸等。
那么支原体的检测方法有哪些呢?下面我们就来详细的了解一下。
支原体检查方法1、支原体培养法支原体培养法也叫分离培养法,是检测支原体的一种传统方法。
支原体培养法的优点是精确度高,因此被誉为支原体检测金标准,但缺点也很明显,就是所需时间比较长,通常需要4周左右。
该检测方法的主要过程是将患者的样本放置在培养基中,以促使支原体的生长。
以下是支原体培养法的两种常见应用:1.1尿液检测采集患者的中段尿液,将其置于培养皿中,培养皿中含有适合支原体生长的培养基。
然后通过观察培养皿中是否会显示出典型的支原体生长特征,如小结构的细胞典型来判断患者是否患有支原体感染。
1.2生殖道分泌物检测除了尿液检测,支原体培养法还可用于检测生殖道分泌物样本。
通过采集患者的生殖道分泌物,然后与尿液检测一样,将生殖道分泌物置于培养皿中,通过观察是否有典型的支原体生长特征,来判断患者是否感染了支原体。
2、聚合酶链反应(PCR)聚合酶链反应(PCR)是一种现代分子生物学技术,其是检测支原体时间最快但却并不灵敏的方法。
该方法是采用针对支原体DNA的引物用PCR检测可疑样本,其中PCR引物通常针对支原体的16srRNA 基因。
在凝胶电泳过程中,支原体DNA会显示为特异性条带,以此来提示有支原体存在。
虽然PCR法能够检测大多数支原体,但为了保险起见,最好还是同时使用另一种方法来进行验证。
3、DNA检测DNA检测是另一种现代支原体感染检测的方法,它不仅具有高度的敏感性和特异性,还可以用于识别支原体的亚型。
DNA检测需要将标本与指示细胞共同培养,因此一般需要几天时间。
DNA检测所用的指示细胞通常为细胞质区域较大的Vero细胞,如果标本中含有支原体则当细胞DNA被荧光染料(如Hoechst染料)染色时,就可在指示细胞的核周围观察到荧光斑点或荧光颗粒。

支原体检测流程
支原体检测流程详解
一、准备工作
1. 收集患者的前置分泌物,用于后续的检测分析。
2. 准备必要的实验器材,如试管、移液器、离心机等。
3. 确保实验室环境符合卫生标准,以避免干扰检测结果。
二、样本处理
1. 将收集到的前置分泌物放入无菌试管中,并做好标记。
2. 尽快将样本送至实验室进行检测。
三、实验室检测步骤
1. 样本接种:将样本接种到支原体培养基上,进行培养和观察。
2. 支原体鉴定:通过形态学、分子生物学等方法,对培养出来的支原体进行鉴定。
3. 结果判断:根据支原体生长情况、形态学特征等,结合经验进行结果判断。
四、注意事项
1. 确保实验室环境的卫生标准,以避免干扰检测结果。
2. 注意样本的采集和保存方法,确保样本的质量。
3. 在进行支原体检测时,应注意与其他类似疾病的鉴别,以免误诊。
五、报告出具
根据检测结果,出具支原体检测报告,告知患者是否感染了支原体及相应的治疗建议。
以上就是支原体检测的详细流程,希望对大家有所帮助。

临床对解脲支原体的检测方法解脲支原体是一种能够引起尿路感染和性传播感染的细菌。
临床上针对解脲支原体的检测方法主要包括传统的实验室培养方法和分子生物学方法,其中最常用的是PCR检测法。
下面将对其进行详细介绍。
一、实验室培养方法实验室培养方法是传统的解脲支原体检测方法之一,其步骤主要包括:1.收集标本:一般采集尿液、尿道分泌物或其他感染灶的分泌物作为标本。
2. 培养基的选择:解脲支原体主要是一种革兰氏阴性杆菌,一般采用Martin-Lewis培养基或MTM培养基来进行检测。
3.培养和存储:将标本接种在培养基上进行培养,一般需要在35-37摄氏度、5%二氧化碳的条件下培养2-7天。
培养后的菌株可以进行进一步的鉴定和存储。
实验室培养方法的优点是操作简便、成本较低,可以检测出解脲支原体的生长和培养,可用于鉴定耐药性和进行药物敏感性试验。
然而,该方法存在一些缺点,如培养时间长、阳性率低、容易发生假阴性结果等。
二、PCR检测法PCR(聚合酶链反应)是一种高效、敏感、特异性的检测技术,已经成为解脲支原体检测的金标准方法之一,其步骤主要包括:1.DNA提取:从尿液、尿道分泌物或其他感染灶的分泌物中提取解脲支原体的DNA。
2. PCR扩增:使用特异性引物(primers)对解脲支原体的DNA进行扩增,得到特异性的DNA片段。
3.凝胶电泳:将扩增产物经过凝胶电泳,根据扩增片段的大小进行分离和鉴定。
PCR检测法的优点是快速、敏感、特异性高,并且不需要进行培养,可以直接检测病原菌的DNA。
此外,PCR技术还可以用于检测解脲支原体的耐药性和亚型鉴定。
然而,PCR检测技术设备成本高,需要专业人员进行操作,对实验室环境和质控要求较高。
除了实验室培养方法和PCR检测法外,还有其他一些检测方法可以用于解脲支原体的检测,例如免疫荧光染色法、酶联免疫吸附法(ELISA)和原位杂交法等。
这些方法都有其优缺点,其选择应根据实际情况和需求进行权衡和决定。

支原体检测荧光法和PCR法灵敏度实验一、目的通过实验获得支原体检测荧光法和PCR法灵敏度数据,了解两种方法的灵敏度,以确定支原体检测采用的实验方法。
二、试验方法和材料1、方法:用已知支原体污染的样本作为阳性样本,通过系列稀释,检测稀释后的样本的的支原体检测结果,用荧光法和PCR法两种方法检测,比较两种方法的差异。
并且荧光法在第二次读数时,每2分钟读一次数,观察读数的变化。
2、实验材料和试剂:取支原体阴性细胞215和支原体阳性细胞216分别作为阴性和阳性实验样本。
荧光法支原体检测试剂盒使用LONZA MycoAlert Mycoplasma Detection Kit ,PCR支原体检测试剂盒使用HD MycoScan。
三、实验步骤1、把阴性样本215按30,120,480,1920倍稀释,把阳性样本216按30,60,120,240,480,960,1920,3840倍稀释。
2、按荧光法试剂盒操作步骤操作,把1系列稀释的样本进行检测,读取A值,并且在第一次A值读数后两分钟再读取A值一次。
3、按荧光法试剂盒操作步骤操作,读取B值,并且在第一次B值读数后每两分钟读取B值一次,一共读取10次。
4、计算B/A值的结果。
5、取1系列稀释的样本用PCR法检测。
四、实验结果根据荧光法和PCR法检测结果比较,荧光法通过延长反应时间,可以检出稀释240倍的阳性216样本的支原体,PCR法检测支原体的灵敏度在本次实验中也是样本240倍稀释这个范围。
所以通过改良后的荧光法和PCR法检测支原体的灵敏度是基本差不多的。
而荧光法检测所需时间大概是1小时,而PCR法检测时间需要8小时左右,因此荧光法是一个更适合实验室支原体检测的方法。
使用荧光法检测样本支原体在第一次读取B值后,在过20分钟读取一次B值,可以增加试剂的灵敏度,可最大化检测出支原体。
支原体检测验证方案一、背景介绍支原体是一种常见的细菌感染病原体,可以引起人类多种疾病,包括肺炎、支气管炎、尿路感染等。
为了准确、快速地检测支原体感染和评估治疗效果,制定并验证支原体检测方案至关重要。
二、方案制定1. 基于PCR的支原体核酸检测PCR(聚合酶链式反应)是一种常用的核酸检测技术,具有高度的灵敏度和特异性。
本方案采用PCR技术作为支原体检测的基础,以便准确地检测和鉴定支原体感染。
2. 样本采集和处理a. 上呼吸道样本:采用鼻咽拭子或鼻咽冲洗液进行采集。
b. 下呼吸道样本:采用痰液或支气管肺泡灌洗液进行采集。
c. 尿液样本:采用无菌容器采集首末尿,避免污染。
d. 其他部位样本:依病情需要采集相应部位的分泌物或组织。
3. DNA/RNA提取根据样本类型选择合适的DNA/RNA提取方法,例如酚-氯仿法、磁珠法等。
确保提取得到高质量的核酸,以保证后续的PCR检测准确可靠。
4. PCR反应体系设置a. PCR反应物包括DNA/RNA模板、引物、酶、缓冲液等。
b. 根据具体的PCR试剂盒说明书设置反应体系的成分和浓度。
5. PCR条件优化a. 反应体系中引物的浓度和温度的设置。
b. PCR循环程序的温度和时间的优化,包括初始变性、扩增和延伸等阶段。
6. 结果解读和验证a. PCR扩增产物通过凝胶电泳检测,观察是否出现特异性条带。
b. 如果出现特异性条带,可进行序列测定和比对分析,以确保检测结果的准确性和可信度。
三、验证方案为了验证该支原体检测方案的准确性和可靠性,可进行以下验证实验:1. 样本模拟实验a. 收集已知含有支原体的样本,制备浓度不同的标准品,用于模拟不同感染水平的样本。
b. 分别对各种浓度的标准品进行PCR检测,比较结果与实际浓度的符合程度。
2. 临床样本检测a. 收集一批临床患者的支原体感染样本,包括上呼吸道、下呼吸道、尿液等。
b. 对这些样本按照方案中所描述的方法进行PCR检测,与临床诊断结果进行比对分析。
支原体PCR检测及治疗试剂盒PCR Mycoplasma Test Kit可用于各种生物材料(如细胞培养物、实验动物分泌物、动物血清等)支原体感染的检测。
应用聚合酶链式反应技术(PCR)对支原体16s-rRNA基因保守区域的特异性片段进行扩增检测。
该方法可以在数小时内得到结果,与传统的选择性培养基培养检测方法相比较,本方法更快速,灵敏度和特异性更高,不会出现由于培养法检测时大量培养支原体而可能带来的次级污染的问题。
国内外研究表明,细胞培养的支原体污染中,有98%以上是由以下五种支原体引起的:M.orale、M.arginini、M.hyorhinis 和idlawii,M.Fermentans。
本试剂盒能检测包括以上五种常见支原体在内的40种支原体。
注:本试剂盒仅用于研究,不能用于临床诊断。
【试剂盒组成】1PCR反应液400ul(20ul/次,20次反应)2Taq酶20ul(1ul/次,20次反应)3DNA阳性对照1管4使用说明书1份5支原体治疗试剂1份(详细说明见说明书第三页)【原理】PCR检测试剂盒中含有PCR反应所需要各种试剂组分,如:引物、dNTPs、缓冲液、Taq酶、稳定剂等。
PCR 反应液中加入检测样品和Taq酶,即可进行PCR扩增反应。
PCR扩增产物经琼脂糖电泳染色判断,阳性样本将在290bp处出现特异性条带。
【使用方法】1实验所需器材与试剂1.1器材1)PCR仪2)PCR反应管3)电泳仪及水平电泳槽4)高速离心机5)微量移液器及移液器吸头1.2试剂1)琼脂糖2)EB(溴化乙锭)3)去离子水或双蒸水2实验操作步骤注:当细胞生长至80-90%时可以取样进行检测,培养液中的青霉素和链霉素不会影响检测效果。
1.收取待检样品(贴壁细胞:细胞生长至80%左右即可,送检细胞不能用消化液消化细胞,可以使用细胞刮刀刮取细胞;悬浮细胞:细胞生长至80%左右即可),取150ul(约1~3×105细胞数)至离心管,沸水浴10min。
PCR法检测支原体实验原理:通过对支原体特定的序列设计引物,当存在支原体污染时通过PCR特异性扩增,会将目标DNA特异性的复制,然后通过琼脂糖电泳观检测,会跑出条带出现阳性结果。
反之当没有支原体污染时,由于没有模板,PCR无法扩增,则琼脂糖电泳跑不出条带,出现阴性结果,为确保PCR法的精确性,故需要找到最优的PCR条件在进行检测。
实验目的:检测培养的细胞是否有支原体污染。
实验材料:0.5 ml EP管;PCR管;镊子;手套;口罩;EP管架;移液枪(100 u| 10 u)及配套枪头(黄、白);dd H2Q 上下游引物(两组);dNTPs 10 x Buffe;Easy Taq冰盒;琼脂糖;锥形瓶(200m);量筒(50m);全套琼脂糖电泳设备(电泳槽,制胶槽,梳子,电源输出);凝胶成像系统;PCR引物:LZY-5 Myco universal F GGGGAATGGGTGAGTAACACGLZY-5 Myco universal R CGGATAACGCTTGCGACCTATG 产物大小:500bpLZY-6 mycotest F: GGGAGCAAACAGGATTAGTATCCCTLZY-6 mycotest R TGCACCATCTGTCACTCTGTTAACCTC 产物大小:250bp 实验步骤:1、取样:直接取培养细胞的培养基一上清。
2、P CR (为25ul体系)1、配制反应体系,根据检测样本数+1个阴性对照(水)+1个阳性对照,算出PCR 样本的个数,在此基础上增加几管的量,把除检测培养基外的其他组分按计算好的量加到一起,混匀后分装,最后加入检测培养基。
3.琼脂糖凝胶的制备1%的琼脂糖凝胶电泳检测PCR结果。
支原体pcr检测方法支原体PCR检测方法。
支原体是一种细菌,它可以引起多种疾病,包括肺炎、结膜炎、尿道炎等。
支原体感染对人体健康造成了严重威胁,因此及时准确地检测支原体感染对于疾病的预防和治疗非常重要。
PCR(聚合酶链式反应)是一种常用的分子生物学技术,可以对支原体进行快速、敏感的检测。
下面将介绍支原体PCR检测的方法。
首先,准备样本。
支原体PCR检测可以使用多种样本,包括咽拭子、尿液、分泌物等。
在采集样本时,需要注意避免污染,并且尽量采集足够的样本以保证检测的准确性。
其次,提取DNA。
支原体是一种细菌,其遗传物质是DNA。
因此,在进行PCR检测之前,需要先将样本中的DNA提取出来。
提取DNA的方法有很多种,可以根据实际情况选择合适的方法进行操作。
然后,进行PCR反应。
PCR反应是将样本中的DNA进行复制,以便进行后续的检测。
在PCR反应中,需要将样本中的DNA与引物和酶混合,然后通过一系列的温度循环来完成DNA的复制。
PCR反应的条件和参数需要根据具体的实验目的和样本情况进行优化。
接下来,进行PCR产物检测。
PCR产物可以通过凝胶电泳、实时荧光定量PCR等方法进行检测。
通过检测PCR产物,可以判断样本中是否存在支原体,并且可以对支原体进行定量分析。
最后,结果分析和报告。
根据PCR检测的结果,可以对支原体感染的情况进行分析,并且向临床医生提供相关的报告。
在进行结果分析和报告时,需要注意结果的准确性和可靠性,以便为临床诊断和治疗提供参考依据。
总之,支原体PCR检测是一种快速、敏感、准确的检测方法,可以在临床诊断和疾病预防中发挥重要作用。
通过正确操作和严格控制实验条件,可以获得可靠的检测结果,为疾病的预防和治疗提供有力支持。
希望本文介绍的支原体PCR检测方法对您有所帮助。
支原体检测荧光法和PCR法灵敏度实验一、目的通过实验获得支原体检测荧光法和PCR法灵敏度数据,了解两种方法的灵敏度,以确定支原体检测采用的实验方法。
二、试验方法和材料1、方法:用已知支原体污染的样本作为阳性样本,通过系列稀释,检测稀释后的样本的的支原体检测结果,用荧光法和PCR法两种方法检测,比较两种方法的差异。
并且荧光法在第二次读数时,每2分钟读一次数,观察读数的变化。
2、实验材料和试剂:取支原体阴性细胞215和支原体阳性细胞216分别作为阴性和阳性实验样本。
荧光法支原体检测试剂盒使用LONZA MycoAlert Mycoplasma Detection Kit ,PCR支原体检测试剂盒使用HD MycoScan。
三、实验步骤1、把阴性样本215按30,120,480,1920倍稀释,把阳性样本216按30,60,120,240,480,960,1920,3840倍稀释。
2、按荧光法试剂盒操作步骤操作,把1系列稀释的样本进行检测,读取A值,并且在第一次A值读数后两分钟再读取A值一次。
3、按荧光法试剂盒操作步骤操作,读取B值,并且在第一次B值读数后每两分钟读取B值一次,一共读取10次。
4、计算B/A值的结果。
5、取1系列稀释的样本用PCR法检测。
四、实验结果根据荧光法和PCR法检测结果比较,荧光法通过延长反应时间,可以检出稀释240倍的阳性216样本的支原体,PCR法检测支原体的灵敏度在本次实验中也是样本240倍稀释这个范围。
所以通过改良后的荧光法和PCR法检测支原体的灵敏度是基本差不多的。
而荧光法检测所需时间大概是1小时,而PCR法检测时间需要8小时左右,因此荧光法是一个更适合实验室支原体检测的方法。
使用荧光法检测样本支原体在第一次读取B值后,在过20分钟读取一次B值,可以增加试剂的灵敏度,可最大化检测出支原体。
支原体操作流程及注意事项
支原体的操作流程主要包括培养、鉴定、检测和灭活等步骤,以下为简要说明:
1. 培养:
- 使用适宜的支原体培养基(如PPLO培养基),并在无菌条件下接种疑似样本。
- 在适宜的温度(如37℃)和含5% CO2的厌氧环境或微需氧环境下进行培养,通常需要7-21天观察生长情况。
2. 鉴定:
- 根据形态学特征、生化特性(如糖发酵试验)、免疫学方法(如ELISA)或分子生物学技术(如PCR)进行种属鉴定。
3. 检测:
- 可采用DNA荧光染色法、培养法、PCR法、酶联免疫吸附法等多种方式进行支原体的筛查与定量检测。
4. 灭活:
- 若需要处理已知携带支原体的细胞或样本,需进行严格的热灭活或化学试剂(如抗生素)处理,确保支原体完全失活。
注意事项:
- 所有操作应在生物安全柜内进行,严格遵守生物安全规定。
- 接触可能含有支原体的样本时应穿戴适当的防护装备,如实验服、手套、口罩、护目镜等。
- 实验废弃物应按照生物危害废弃物处理规定进行处置。
- 支原体感染易导致细胞培养污染,实验室应定期进行支原体检测,并采取预防措施。
- 灭活步骤完成后,需再次通过支原体检测确认其是否已被彻底清除。