必修二1-2碱金属和卤族元素
- 格式:ppt
- 大小:3.84 MB
- 文档页数:59
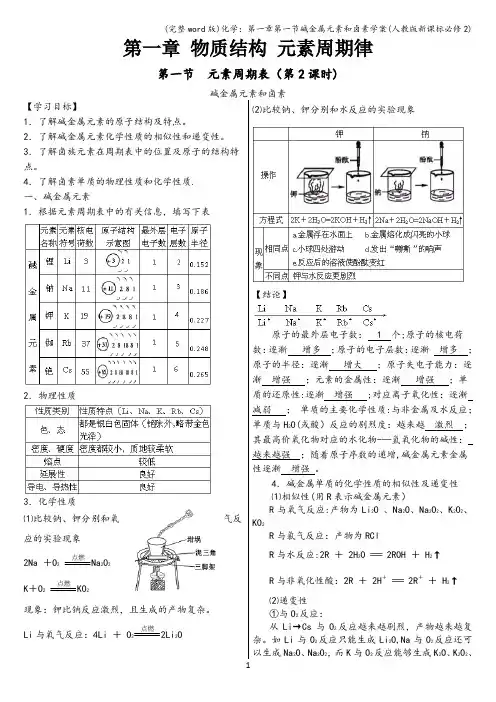
第一章物质结构元素周期律第一节元素周期表(第2课时)碱金属元素和卤素【学习目标】1.了解碱金属元素的原子结构及特点。
2.了解碱金属元素化学性质的相似性和递变性。
3.了解卤族元素在周期表中的位置及原子的结构特点。
4.了解卤素单质的物理性质和化学性质.一、碱金属元素1.根据元素周期表中的有关信息,填写下表2.物理性质3.化学性质⑴比较钠、钾分别和氧气反应的实验现象2Na +O2点燃Na2O2K+O2点燃KO2现象:钾比钠反应激烈,且生成的产物复杂。
Li与氧气反应:4Li + O2点燃2Li2O ⑵比较钠、钾分别和水反应的实验现象【结论】原子的最外层电子数: 1 个;原子的核电荷数:逐渐增多;原子的电子层数:逐渐增多;原子的半径:逐渐增大;原子失电子能力:逐渐增强;元素的金属性:逐渐增强;单质的还原性:逐渐增强 ;对应离子氧化性:逐渐减弱;单质的主要化学性质:与非金属及水反应;单质与H2O(或酸)反应的剧烈度:越来越激烈;其最高价氧化物对应的水化物-—氢氧化物的碱性:越来越强;随着原子序数的递增,碱金属元素金属性逐渐增强。
4.碱金属单质的化学性质的相似性及递变性⑴相似性(用R表示碱金属元素)R与氧气反应:产物为Li2O 、Na2O、Na2O2、K2O2、KO2R与氯气反应:产物为RClR与水反应:2R + 2H2O === 2ROH + H2↑R与非氧化性酸:2R + 2H+=== 2R++ H2↑⑵递变性①与O2反应:从Li→Cs与O2反应越来越剧烈,产物越来越复杂。
如Li与O2反应只能生成Li2O,Na与O2反应还可以生成Na2O、Na2O2,而K与O2反应能够生成K2O、K2O2、KO2等。
②与H2O(或酸)的反应:从Li→Cs,与H2O(或酸)反应越来越剧烈,如K 与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。
③最高价氧化物对应水化物的碱性:碱性:LiOH〈NaOH〈KOH<RbOH<CsOH。
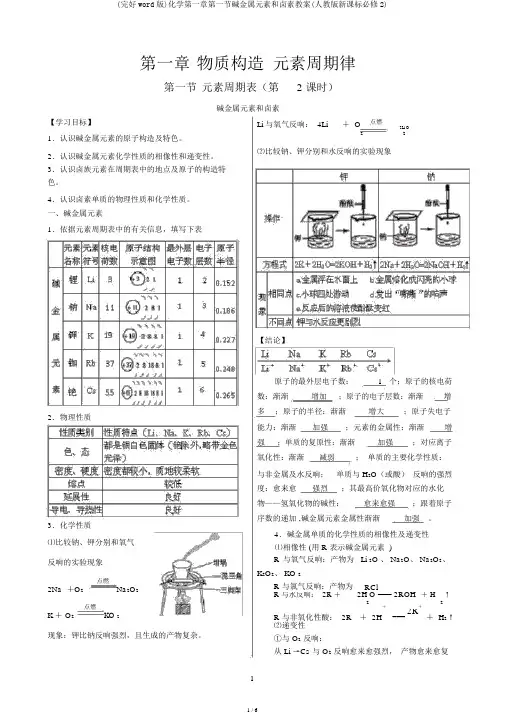
第一章物质构造元素周期律第一节元素周期表(第 2 课时)碱金属元素和卤素【学习目标】1.认识碱金属元素的原子构造及特色。
2.认识碱金属元素化学性质的相像性和递变性。
3.认识卤族元素在周期表中的地点及原子的构造特色。
4.认识卤素单质的物理性质和化学性质。
一、碱金属元素1.依据元素周期表中的有关信息,填写下表2.物理性质3.化学性质⑴比较钠、钾分别和氧气反响的实验现象点燃2Na +O2Na2O2点燃K + O2KO 2现象:钾比钠反响强烈,且生成的产物复杂。
Li 与氧气反响: 4Li+ O点燃2Li O22⑵比较钠、钾分别和水反响的实验现象【结论】原子的最外层电子数: 1 个;原子的核电荷数:渐渐增加;原子的电子层数:渐渐增多;原子的半径:渐渐增大;原子失电子能力:渐渐加强;元素的金属性:渐渐增强;单质的复原性:渐渐加强;对应离子氧化性:渐渐减弱;单质的主要化学性质:与非金属及水反响;单质与 H2O(或酸)反响的强烈度:愈来愈强烈;其最高价氧化物对应的水化物——氢氧化物的碱性:愈来愈强;跟着原子序数的递加 ,碱金属元素金属性渐渐加强。
4.碱金属单质的化学性质的相像性及递变性⑴相像性 (用 R 表示碱金属元素 )R与氧气反响:产物为 Li 2O 、 Na2O、 Na2O2、K2O2、 KO 2R 与氯气反响:产物为RClR 与水反响: 2R +2H O === 2ROH+ H↑22 R 与非氧化性酸: 2R+++ 2H===2R+ H2↑⑵递变性①与 O2反响:从 Li →Cs 与 O2反响愈来愈强烈,产物愈来愈复杂。
如 Li 与 O 2 反响只好生成 Li 2O ,Na 与 O 2 反响还 从 Li →Cs,与 H 2O(或酸 ) 反响愈来愈强烈,如 K能够生成 Na 2O 、 Na 2O 2,而 K 与 O 2 反响能够生成与 H 2O 反响可能会发生稍微爆炸, Rb 与 Cs 遇水发K 2O 、 K 2O 2、 KO 2 等。




[键入文字]
高一必修2 化学元素周期律知识点梳理
世界由物质组成,化学则是人类用以认识和改造物质世界的主要方法和手段之一。
精品小编准备了高一必修2 化学元素周期律知识点,希望你喜欢。
一.元素周期表的结构
周期序数=核外电子层数主族序数=最外层电子数
原子序数=核电荷数=质子数=核外电子数
二.元素的性质和原子结构
(一)碱金属元素:
2.碱金属化学性质的递变性:
递变性:从上到下(从Li 到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。
所以从Li 到Cs 的金属性逐渐增强。
结论:
1)原子结构的递变性导致化学性质的递变性。
1。




二.元素金属性、非金属性周期性变化规律元素的金属性是指元素的原子 电子的能力;元素的非金属性是指元素的原子 电子的能力。
1.碱金属元素 (1)原子结构特点相同点:碱金属元素原子的 相同,都为 。
递变性:从Li 到Cs ,碱金属元素的原子结构中, 依次增多,原子半径依次 。
根据教材实验,完成下表相似性:都能与O 2和H 2O 发生 反应,都有强 。
递变性: 比 的还原性更强,更易与O 2和H 2O 反应。
有关反应方程式:①与O 2反应:锂与氧气反应: 钠在不同条件下与O 2反应:常温下: 加热(或点燃):小结:从Li 到Cs 在空气中燃烧其产物越来越复杂。
②与水反应:钠与水反应: 钾与水反应: (3)碱金属的物理性质根据教材表1-1碱金属的主要物理性质,归纳碱金属的物理性质的相似性和递变性:相似性:除 略带金色光泽外,其余的都呈 色;它们的质地都比较 ,有 性;密度都比较 ,熔点都比较 ,导电性和导热性 。
递变性:随着核电荷数的增多,碱金属的密度逐渐 (钠除外),熔、沸点逐 。
2.卤族元素卤族元素包括 、 、 、 、5种元素,它们位于元素周期表的第 纵行,属于第 族。
(1)原子结构特点相同点:卤族元素原子的 相同,都为 。
递变性:从F 到I ,卤族元素原子的 增多,原子半径 。
阅读教材的资料卡片,归纳卤素单质物理性质的变化规律:单质的颜色逐渐 ,密度逐渐 ,熔、沸点逐渐 。
(3).卤族元素的化学性质 ①卤族单质与氢气的反应②卤素单质间的置换反应思考:1.以上卤素单质的置换反应中用三组实验来说明(1)元素性质的影响因素元素的性质主要与原子核外电子的排布,特别是与 有关。
(2)同主族元素性质的递变规律同主族元素从上到下原子核外电子层数 ,原子半径 ,失电子能力 ,得电子能力 ,金属性 ,非金属性 。
4.元素金属性和非金属性的周期性变化 (1)钠、镁、铝金属性强弱的比较[实验探究]钠、镁、铝与水(或酸)反应的剧烈程度逐渐 ,置换出氢越来越 ;最高价氧化物对应水化物的碱性逐渐 ,因此元素的金属性逐渐 。