碱金属和卤族元素
- 格式:ppt
- 大小:118.00 KB
- 文档页数:15

卤族元素与碱金属反应
卤族元素(如氟、氯、溴、碘等)与碱金属(如钠、钾、锂等)在一定条件下可以发生化学反应。
这些反应通常涉及元素的氧化还原过程。
以下是卤族元素与碱金属可能发生的一些化学反应:
1.置换反应:卤族元素可以与碱金属发生置换反应,生成相应的碱金属卤化物。
例如,钠可以与氯反应生成氯化钠(NaCl),钾可以与溴反应生成溴化钾(KBr)等。
2.氧化还原反应:卤族元素具有较高的氧化性,而碱金属具有较低的氧化性,因此当它们相互作用时,可能发生氧化还原反应。
例如,氟可以氧化锂生成氟化锂(LiF)和氧气,氯可以氧化钠生成氯化钠(NaCl)和氧气等。
3.配合反应:卤族元素还可以与碱金属发生配合反应,生成配合物。
例如,溴可以与钠生成溴化钠(NaBr),其中溴原子与钠原子之间通过配位键结合。
需要注意的是,卤族元素与碱金属的反应性取决于多种因素,包括反应物的浓度、温度、压力等。
此外,不同的卤族元素与不同的碱金属之间也可能存在不同的反应性和产物。
因此,具体的反应条件和产物需要结合实验来确定。



元素周期表中的主族元素元素周期表是化学中的重要工具,它将元素按照一定规律排列。
其中,主族元素是指周期表中第1A到第8A族元素,也就是代表性元素。
这些元素具有共性,其化学性质也有规律可循。
本文将介绍元素周期表中的主族元素,以及它们在日常生活中的应用。
一、第1A族元素 - 碱金属碱金属是元素周期表中的第1A族元素。
它们包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素具有低密度、低熔点和非常活泼的化学性质。
碱金属在自然界中以化合物的形式存在,比如氯化钠(NaCl),它是我们常见的食盐。
此外,钾和铷还用于冶金工业中的合金制备。
二、第2A族元素 - 碱土金属碱土金属是元素周期表中的第2A族元素。
它们包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
与碱金属相比,碱土金属的化学性质更为稳定。
它们在自然界中以氧化物和硫化物的形式广泛存在。
钙是人体骨骼、牙齿的重要组成元素,被广泛应用于医药和建筑材料制造。
镁用于制备轻便合金,广泛应用于航空航天领域。
三、第3A族元素 - 硼族元素硼族元素是元素周期表中的第3A族元素。
它们包括硼(B)、铝(Al)、镓(Ga)、铟(In)、铊(Tl)和镓(Uut)。
这些元素的数量较少,化学性质各异。
铝是最常见的硼族元素,具有良好的导电性和导热性,广泛应用于建筑、汽车和航空领域。
四、第4A族元素 - 碳族元素碳族元素是元素周期表中的第4A族元素。
它们包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)和镤(Fl)。
碳是生命的基础,几乎所有有机物都含有碳元素。
硅在电子工业中应用广泛,是半导体材料的重要组成部分。
锡和铅常用于合金制备,具有良好的焊接性能。
五、第5A族元素 - 氮族元素氮族元素是元素周期表中的第5A族元素。
它们包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和镤(Mc)。
氮是地球大气中的主要成分,也是生物体内常见的元素。

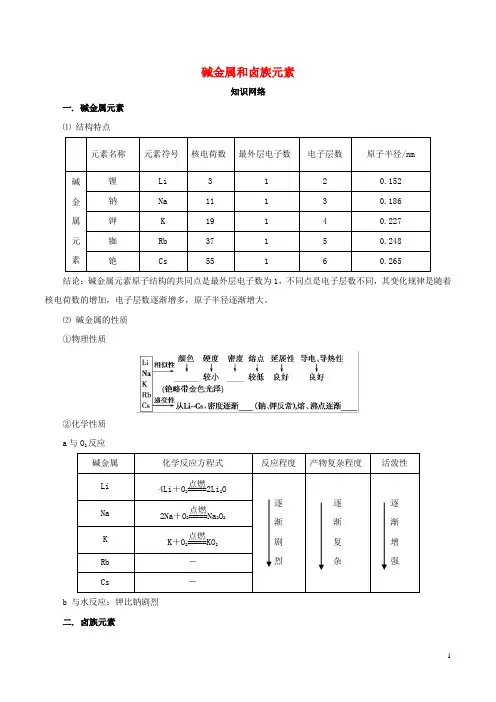
碱金属和卤族元素知识网络一. 碱金属元素 ⑴ 结构特点元素名称元素符号 核电荷数 最外层电子数电子层数原子半径/nm 碱金属 元素锂 Li 3 1 2 0.152 钠 Na 11 1 3 0.186 钾 K 19 1 4 0.227 铷 Rb 37 1 5 0.248 铯Cs55160.265结论:碱金属元素原子结构的共同点是最外层电子数为1,不同点是电子层数不同,其变化规律是随着核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
⑵ 碱金属的性质 ①物理性质②化学性质 a 与O 2反应碱金属 化学反应方程式 反应程度产物复杂程度活泼性Li 4Li +O 2=====点燃2Li 2O 逐 渐 剧 烈逐 渐 复 杂逐 渐 增 强Na 2Na +O 2=====点燃Na 2O 2 K K +O 2=====点燃KO 2Rb - Cs-b 与水反应:钾比钠剧烈 二. 卤族元素⑴原子结构元素名称 氟(F) 氯(Cl) 溴(Br) 碘(I) 原子序数 9 17 35 53 最外层电子数 7 7 7 7 电子层数2345结论:卤族元素原子结构的共同点是最外层电子数为7,不同点是电子层数不同,其变化规律是随着原子序数增大,电子层数逐渐增多,原子半径逐渐增大。
⑵ 卤族元素单质的性质 ①物理性质F 2 Cl 2 Br 2 I 2颜色: ———————————————————→浅黄绿色 黄绿色 深红棕色 紫黑色颜色变深 熔、沸点:———————————————————→ 气体 气体 液体 固体 逐渐升高 密度:———————————————————→ 逐渐 增大 水溶性:———————————————————→反应 溶解 溶解 微溶 逐渐减小 ②化学性质 a 与H 2反应反应条件 化学方程式 产物稳定性 F 2 无 H 2+F 2=2HF 最稳定 Cl 2 光或点燃 H 2+Cl 2=2HCl 稳定 Br 2 加热 H 2+Br 2=2HBr 较稳定I 2加热H 2+I 22HI 较不稳定,可逆结论:从F 2到I 2,与H 2反应所需要的条件逐渐升高,反应剧烈程度依次减弱,生成气态氢化物的稳定性依次减弱。

碱金属与卤族元素的特点及对比
碱金属和卤族元素是化学元素周期表中的两个重要类别,它们各自具有独特的特点和性质。
让我们深入探讨这两类元素的特征,并进行比较对比,以便更好地理解它们在化学世界中的重要性。
碱金属的特点
碱金属位于周期表的第一组,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素具有以下特点:
金属性:碱金属是典型的金属,具有良好的导电性和热导性。
活泼性:碱金属非常活泼,容易与非金属元素发生化学反应。
单价阳离子:在化合物中,碱金属通常以+1的单价阳离子存在。
密度低:碱金属的密度相对较低,且在常温下较软。
卤族元素的特点
卤族元素位于周期表的第七组,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
这些元素具有以下特点:
非金属性:卤族元素是非金属元素,常见于自然界中的盐类化合物。
高电负性:卤族元素具有较高的电负性,易与金属形成离子化合物。
形成阴离子:在化合物中,卤族元素通常以-1的单价阴离子存在。
存在形式:卤族元素在自然界中以单质形式或盐类化合物形式存在。
碱金属与卤族元素的对比
物理性质对比
化学性质对比
通过对碱金属和卤族元素的特点及比较对比,我们能更好地理解它们在化学反应和物质性质中的不同表现。
这些元素在化学领域中扮演着重要的角色,影响着各种化学过程和实际应用。
碱金属和卤族元素作为化学元素周期表中两个重要类别,各自具有独特的特点和性质。
通过对它们的对比分析,我们能更好地理解它们在化学世界中的重要性和应用价值。


卤族元素和碱金属元素反应生成的是什么键?在化学元素中,卤族元素和碱金属元素都是常见的元素之一。
它们在化学反应中会发生相互作用,产生各种化合物。
那么,当卤族元素和碱金属元素发生化学反应时,会生成什么样的键呢?这是一个需要深入探讨的问题。
1. 卤族元素和碱金属元素简介让我们简单了解一下卤族元素和碱金属元素。
卤族元素位于周期表的第七族,包括氟(F)、氯(Cl)、溴(Br)和碘(I)等元素。
这些元素在化合物中通常表现为负离子,具有较强的化学活性。
而碱金属元素位于周期表的第一族,包括锂(Li)、钠(Na)、钾(K)等元素。
这些金属元素通常以阳离子的形式存在,同样具有较强的化学活性。
2. 化学反应过程当卤族元素和碱金属元素发生化学反应时,会发生离子键的形成。
以氯气与钠金属反应为例,化学方程式如下所示:2Na + Cl2 -> 2NaCl在这个反应中,钠金属失去一个电子形成Na+离子,而氯气接受一个电子形成Cl-离子。
由于钠离子的正电荷和氯离子的负电荷之间存在电荷吸引力,它们之间会形成离子键。
这种离子键是由阳离子和阴离子之间的强烈电荷吸引力形成的,具有很强的结合能力。
3. 总结当卤族元素和碱金属元素发生化学反应时,生成的是离子键。
这种键形成于阳离子和阴离子之间,具有很强的结合能力。
通过对这一反应过程的深入理解,我们能够更好地把握化学元素之间的相互作用,为化学实验和工业生产提供指导。
4. 个人观点个人认为,了解化学元素的反应特性对于我们理解化学原理和应用具有重要意义。
在今后的学习和工作中,我会继续深入探讨化学元素之间的反应特性,不断丰富自己的化学知识,为科学研究和实践工作做出贡献。
通过以上文章的撰写,我对卤族元素和碱金属元素反应生成的键有了更深入的理解。
希望这篇文章能够对您有所帮助,如有任何疑问或补充,请随时与我联系。
祝好!此为示例文章,非真实事例。
化学反应是化学领域中的重要概念,而卤族元素和碱金属元素的反应更是化学领域中的经典反应之一。

