知识点主族元素碱金属和卤素
- 格式:doc
- 大小:371.50 KB
- 文档页数:4

元素周期表中的主族元素元素周期表是化学界对元素进行分类和组织的基础工具。
其中,主族元素是周期表中占据IA至VIIIA族的元素。
主族元素具有一些共同的性质和特点,对于化学研究和应用有着重要的意义。
本文将介绍主族元素的分类、性质以及相关的应用。
一、主族元素的分类主族元素按各族别以及一些特殊的性质可以分为以下几类:1. 碱金属元素:IA族元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和铊(Fr)。
这些元素具有低电离能和极强的还原性,在常温下都是固态,具有非常活泼的化学性质。
2. 碱土金属元素:IIA族元素,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
碱土金属元素具有较低的电离能和较高的还原性,也比较活泼,但相对于碱金属元素而言活泼性较弱。
3. 半金属元素:包括硼(B)、硅(Si)、锗(Ge)、砷(As)、锑(Sb)和碲(Te)。
这些元素的性质介于金属和非金属之间,通常具有较高的电阻率和较低的导电能力。
4. 卤素元素:VIIA族元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和石碱(At)。
卤素元素具有非常高的电负性和较强的氧化性,容易与金属形成离子化合物。
5. 惰性气体元素:VIIIA族元素,包括氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)和氡(Rn)。
惰性气体元素在常温常压下都是气态,具有非常低的反应性。
二、主族元素的性质1. 金属性与非金属性:主族元素中大部分元素是金属性元素,具有良好的导电性和导热性。
但也有一些元素呈现非金属性,如碳(C)和磷(P)等。
2. 电子结构和化合价:主族元素的电子结构决定了它们的化学性质。
主族元素的外层电子数通常决定了化合价数,即元素与其他元素形成化合物时所能与其他元素结合的电子数目。
3. 离子半径和电离能:主族元素的离子半径越往下和越往左增加,电离能越低。
这意味着主族元素在周期表上的位置可以预测其电离能和反应性。

知识点主族元素碱金属和卤素-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN第一章第二节主族元素碱金属和卤素(一)碱金属元素:1.原子结构相似性:最外层电子数均为,均易电子,具有强性递变性:随着核电荷数的递增,电子层数逐渐,原子半径逐渐,失电子能力逐渐,还原性(元素金属性)逐渐。
从Li到Cs 的金属性逐渐增强。
2.碱金属化学性质的相似性:点燃点燃4Li + O2 Li2O 2Na + O2 Na2O22 Na + 2H2O =2NaOH + H2↑ 2K + 2H2O =2KOH + H2↑2R + 2 H2O = 2 ROH + H2 ↑★★结论:碱金属元素原子的最外层上都只有___个电子,都显___ 价.它们的化学性质相似。
都能与水和氧气反应★★结论:1)原子结构的递变性导致化学性质的递变性。
★★★2)金属性强弱的判断依据:与水或酸反应越容易,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强,碱性:LiOH <NaOH <KOH < RbOH < CsOH3.碱金属物理性质的相似性和递变性:1)相似性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。
2)递变性(从锂到铯):①密度逐渐增大(K反常)②熔点、沸点逐渐降低★★小结:碱金属原子结构的相似性和递变性,导致了碱金属化学性质、物理性质的相似性和递变性。
(二)卤族元素:1.原子结构相似性:最外层电子数均为,均易电子,具有强性递变性:随着核电荷数的递增,电子层数逐渐,原子半径逐渐,得电子能力逐渐,氧化性(元素非金属性)逐渐。
还原性(元素金属性)逐渐从F到I的非金属性逐渐减弱。
2.卤素单质物理性质的递变性:(从F2到I2)(1)卤素单质的颜色逐渐加深;(2)密度逐渐增大;(3)单质的熔、沸点升高3.卤素单质与氢气的反应:X2 + H2= 2 HX卤素单质与H2的剧烈程度:依次减弱;生成的氢化物的稳定性:依次减弱生成的氢化物的稳定性:HF HCl HBr HI4.卤素单质间的置换2NaBr +Cl2=2NaCl + Br2氧化性:Cl2________Br2;还原性:Cl-_____Br -2NaI +Cl2=2NaCl + I2氧化性:Cl2_______I2;还原性:Cl-_____I-2NaI +Br2=2NaBr + I2氧化性:Br2_______I2;还原性:Br-______I-★★结论:单质的氧化性:依次减弱,对于阴离子的还原性:依次增强★★★5. 非金属性的强(弱)的判断依据:①单质与氢气易(难)反应;②生成的氢化物稳定(不稳定);③最高价氧化物的水化物(含氧酸)酸性强(弱);④相互置换反应(强制弱)2NaBr+Cl2=2NaCl+Br2。


碱金属(一)钠1. 物理性质:银白色金属、硬度小、比水轻、熔点低、易传热、导电2. 化学性质:(1)与氧气反应常温:4Na + O 22Na 2O点燃:2Na + O 2Na 2O 2(2)与卤素、硫等非金属反应 2Na + Cl 22NaCl2Na + SNa 2S(3)与水反应(加酚酞):① 现象:浮、熔、游、响、红。
② 表明:比水轻、反应放热、钠易熔化、反应激烈,生成H 2和碱。
③ 实质:钠置换水中的氢(4)与酸反应:直接与H +发生氧化还原反应(置换)(5)与盐反应:① 水溶液:先与水反应,生成的碱再与盐发生复分解反应。
2Na+2H 2O+CuSO 4=2)(OH Cu ↓+Na 2SO 4+H 2↑ ② 熔融:直接发生置换反应 4Na+TiCl 4(熔融)Ti+4NaCl3. 存在:只以化合态存在,以NaCl 为主,还有Na 2SO 4、Na 2CO 3、NaNO 3等4. 保存:密封保存,通常保存在煤油中5. 用途:制取Na 2O 2等化合物,钠钾合金(常温下为液体)作原子反应堆导热剂,还原金属,用于电光源6. 制法:2NaCl2Na+Cl 2↑7. 钠在空气中放置发生的变化钠放置在空气中,首先被氧气氧化成Na 2O ;Na 2O 进一步与空气中的水蒸气反应生成NaOH ;NaOH 吸收空气中的水蒸气和CO 2生成碳酸钠晶体;碳酸钠晶体会逐渐风化而成Na 2CO 3。
即其变化过程是这里发生的反应有: ① 4Na+O 2=2Na 2O ② Na 2O+H 2O=2NaOH③ 2Na+2H 2O=2NaOH+H 2↑④ 2NaOH+CO 2+9H 2O=Na 2CO 3·10H 2O ⑤ Na 2CO 3·10H 2O=Na 2CO 3+10H 2O(二)钠的氧化物1. Na 2O :白色,具有碱性氧化物的通性,不稳定,可继续氧化成Na 2O 22. Na 2O 2:淡黄色固体① 淡黄色,跟水反应放出O 2→供氧剂、漂白剂。

元素周期表中的主族元素总结知识点总结元素周期表中的主族元素知识点总结主族元素是指元素周期表中第一A、第二A和第三A至第八A族元素,它们位于周期表的左侧和右侧。
在化学中,主族元素具有许多重要的特性和应用。
下面将对主族元素的知识点进行总结。
1. 第一A族元素(碱金属)第一A族元素包括氢(H)、锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素具有低密度、低熔点和低沸点的特点,而且具有非常强的金属性质。
它们都是非常活泼的金属,在水中能迅速发生剧烈反应。
此外,它们的电离能较低,容易失去电子形成阳离子。
2. 第二A族元素(碱土金属)第二A族元素包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
这些元素的特点是密度相对较高,较熔点和沸点也相对较高。
它们的电离能较第一A族元素要高,但仍然较低。
碱土金属在化学反应中通常表现出较强的还原性。
3. 第三A族至第八A族元素(典型非金属)第三A族到第八A族元素包括硼(B)、碳(C)、氮(N)、氧(O)、氟(F)、磷(P)、硫(S)和氯(Cl)。
这些元素具有各种不同的化学特性,但它们都是非金属元素。
典型非金属元素通常是气体、液体或固体,具有较低的密度和较低的熔点。
它们的电离能较高,通常是接受电子形成阴离子。
4. 特殊的主族元素除了前面提到的主族元素外,还有一些特殊的主族元素,如氢(H)和氦(He)。
氢是元素周期表中最轻的元素,原子核只有一个质子。
氢是唯一一个不在主族元素中的元素,它不完全符合其他元素的化学特性。
氦是最轻的稀有气体,具有非常低的密度,是气球和潜水衣中常用的填充气体。
综上所述,元素周期表中的主族元素具有多样化的特性和应用。
这些元素对于我们理解和应用化学有着重要的意义,对于构建物质世界起着关键的作用。
通过深入研究主族元素,我们可以进一步拓展我们对化学的认识和应用。
(注:此为示例文章,不包含1500字)。

主族元素速记方法主族元素是指周期表中1A到8A族的元素,也称为典型元素。
它们的化学性质相对固定,所以学习主族元素的速记方法对于化学学习非常重要。
下面将介绍一些常用的主族元素速记方法。
1. 1A族元素(碱金属)1A族元素包括锂、钠、钾等,它们的电子层中只有一个电子。
我们可以用“鲁钠钦”来记忆它们的顺序,即锂(Li)、钠(Na)、钾(K)。
这个速记方法的关键词“鲁钠钦”与元素符号“LiNaK”谐音,很容易记忆。
2. 2A族元素(碱土金属)2A族元素包括镁、钙、锶等,它们的电子层中有两个电子。
我们可以用“蚂蚁蜀黍”来记忆它们的顺序,即镁(Mg)、钙(Ca)、锶(Sr)。
这个速记方法的关键词“蚂蚁蜀黍”与元素符号“MgCaSr”谐音,容易记忆。
3. 3A族元素(硼族元素)3A族元素包括硼、铝、镓等,它们的电子层中有三个电子。
我们可以用“北鹿公”来记忆它们的顺序,即硼(B)、铝(Al)、镓(Ga)。
这个速记方法的关键词“北鹿公”与元素符号“BAlGa”谐音,方4. 4A族元素(碳族元素)4A族元素包括碳、硅、锗等,它们的电子层中有四个电子。
我们可以用“瓜瓜豆”来记忆它们的顺序,即碳(C)、硅(Si)、锗(Ge)。
这个速记方法的关键词“瓜瓜豆”与元素符号“CSiGe”谐音,容易记忆。
5. 5A族元素(氮族元素)5A族元素包括氮、磷、砷等,它们的电子层中有五个电子。
我们可以用“你普舒”来记忆它们的顺序,即氮(N)、磷(P)、砷(As)。
这个速记方法的关键词“你普舒”与元素符号“NPAs”谐音,简单易记。
6. 6A族元素(氧族元素)6A族元素包括氧、硫、硒等,它们的电子层中有六个电子。
我们可以用“氧狗三”来记忆它们的顺序,即氧(O)、硫(S)、硒(Se)。
这个速记方法的关键词“氧狗三”与元素符号“OSSe”谐音,容易记忆。
7. 7A族元素(卤素)7A族元素包括氟、氯、溴等,它们的电子层中有七个电子。
我们可以用“风气洞”来记忆它们的顺序,即氟(F)、氯(Cl)、溴(Br)。

同族元素知识点总结同族元素包括了一些著名的元素家族,如碱金属族、碱土金属族、卤素族和稀有气体族等。
以下将对这些主要的同族元素进行详细的介绍和总结。
1. 碱金属族碱金属族是指位于元素周期表第一组的一组元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素在化学性质上具有相似性,主要表现为活泼的金属性和容易失去外层电子形成阳离子的特点。
在自然界中,它们常以化合物的形式存在,如碳酸盐、氢氧化物等。
碱金属族的成员在水中能够形成碱性氢氧化物,并且能和酸反应生成氢气。
它们在空气中具有较强的还原性,因而容易与氧气和水蒸气发生反应。
在元素周期表中,碱金属族的成员依次增大,原子半径逐渐增大,而离子半径则逐渐减小。
2. 碱土金属族碱土金属族是指位于元素周期表第二组的一组元素,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
这些元素在化学性质上也具有相似性,主要表现为容易失去外层两个电子形成二价阳离子的特点。
碱土金属族元素在自然界中存在于矿物和矿石中,常以化合物的形式存在。
碱土金属族的成员在水中不能形成氢氧化物,但能和其他酸性氧化物发生反应生成氢氧化物。
它们在空气中不如碱金属族成员那么活泼,但仍具有一定的还原性。
在元素周期表中,碱土金属族的成员依次增大,原子半径逐渐增大,而离子半径则逐渐减小。
3. 卤素族卤素族是指位于元素周期表第七组的一组元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
这些元素在化学性质上也具有相似性,主要表现为容易获得一个外层电子形成一价阴离子的特点。
卤素族元素在自然界中以单质或化合物的形式广泛存在,如盐类、海水等。
卤素族的成员都是具有剧毒和腐蚀性的元素,它们在与金属反应时能够形成离子化合物。
在元素周期表中,卤素族的成员依次增大,原子半径逐渐增大,而离子半径也逐渐增大。
4. 稀有气体族稀有气体族是指位于元素周期表第八组的一组元素,包括氩(Ar)、氖(Ne)、氪(Kr)、氙(Xe)和氡(Rn)。
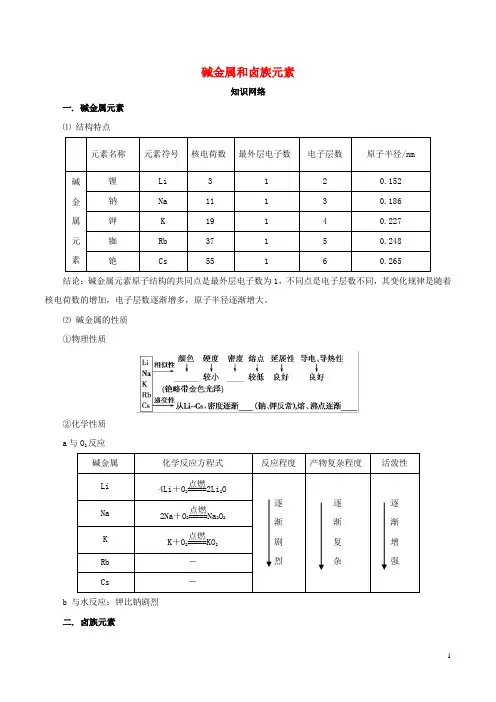
碱金属和卤族元素知识网络一. 碱金属元素 ⑴ 结构特点元素名称元素符号 核电荷数 最外层电子数电子层数原子半径/nm 碱金属 元素锂 Li 3 1 2 0.152 钠 Na 11 1 3 0.186 钾 K 19 1 4 0.227 铷 Rb 37 1 5 0.248 铯Cs55160.265结论:碱金属元素原子结构的共同点是最外层电子数为1,不同点是电子层数不同,其变化规律是随着核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
⑵ 碱金属的性质 ①物理性质②化学性质 a 与O 2反应碱金属 化学反应方程式 反应程度产物复杂程度活泼性Li 4Li +O 2=====点燃2Li 2O 逐 渐 剧 烈逐 渐 复 杂逐 渐 增 强Na 2Na +O 2=====点燃Na 2O 2 K K +O 2=====点燃KO 2Rb - Cs-b 与水反应:钾比钠剧烈 二. 卤族元素⑴原子结构元素名称 氟(F) 氯(Cl) 溴(Br) 碘(I) 原子序数 9 17 35 53 最外层电子数 7 7 7 7 电子层数2345结论:卤族元素原子结构的共同点是最外层电子数为7,不同点是电子层数不同,其变化规律是随着原子序数增大,电子层数逐渐增多,原子半径逐渐增大。
⑵ 卤族元素单质的性质 ①物理性质F 2 Cl 2 Br 2 I 2颜色: ———————————————————→浅黄绿色 黄绿色 深红棕色 紫黑色颜色变深 熔、沸点:———————————————————→ 气体 气体 液体 固体 逐渐升高 密度:———————————————————→ 逐渐 增大 水溶性:———————————————————→反应 溶解 溶解 微溶 逐渐减小 ②化学性质 a 与H 2反应反应条件 化学方程式 产物稳定性 F 2 无 H 2+F 2=2HF 最稳定 Cl 2 光或点燃 H 2+Cl 2=2HCl 稳定 Br 2 加热 H 2+Br 2=2HBr 较稳定I 2加热H 2+I 22HI 较不稳定,可逆结论:从F 2到I 2,与H 2反应所需要的条件逐渐升高,反应剧烈程度依次减弱,生成气态氢化物的稳定性依次减弱。



元素周期表的主族元素化学这门学科中,元素周期表宛如一座蕴藏着无尽奥秘的宝库,而主族元素则是其中最为璀璨夺目的珍宝。
元素周期表的主族元素包括了碱金属、碱土金属、硼族元素、碳族元素、氮族元素、氧族元素和卤族元素。
咱们先来说说碱金属,这一族包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
碱金属的特点十分鲜明,它们都是银白色的金属,质地柔软,具有良好的导电性和导热性。
钠就是我们日常生活中常见的碱金属元素。
您想想,厨房里的食盐,化学名称叫氯化钠(NaCl),这里面就有钠。
钠非常活泼,一碰到水就会剧烈反应,产生氢气并且放出大量的热。
钾也是人体必需的元素之一,它在维持细胞的正常生理功能方面发挥着重要作用。
但如果摄入过多或过少,都会对健康造成影响。
再来说说碱土金属,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
与碱金属相比,碱土金属的化学性质相对稳定一些,但也比较活泼。
钙在人体中的重要性可不能小觑,骨头和牙齿的主要成分就是羟基磷灰石,其中就包含了大量的钙。
小朋友长身体的时候,如果缺钙,就容易发育不良,导致佝偻病等问题。
镁也是人体必需的元素之一,它参与了许多重要的生理过程,比如蛋白质的合成和能量的代谢。
硼族元素包括硼(B)、铝(Al)、镓(Ga)、铟(In)和铊(Tl)。
硼是一种用途广泛的元素,在材料科学和半导体领域有着重要的应用。
铝大家就更熟悉了,生活中到处都能看到铝制品,比如铝合金门窗、易拉罐等等。
铝的表面容易形成一层致密的氧化膜,这使得它具有良好的耐腐蚀性。
碳族元素有碳(C)、硅(Si)、锗(Ge)、锡(Sn)和铅(Pb)。
碳可是生命的基础元素,有机物中都离不开碳。
咱们常见的金刚石和石墨,虽然都是由碳组成的,但性质却大不相同。
硅在现代科技中扮演着极其重要的角色,半导体材料中硅的应用十分广泛,我们使用的电脑芯片就是用硅制造的。
氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)和铋(Bi)。
初中化学元素周期表:碱金属和卤素的性质一、碱金属的性质1. 碱金属的基本特点碱金属是元素周期表中位于第ⅠA族的六种金属元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
碱金属具有以下基本特点:- 电子排布:碱金属原子具有一个外层电子,这个外层电子容易失去形成离子。
- 亲电性:碱金属的亲电性很强,即它们喜欢与非金属形成离子键。
- 密度和熔点:由于原子半径大、原子间距小,因此碱金属具有较低的密度和较低的熔点。
- 反应活泼:由于它们易失去外层电子形成阳离子,在水和氧气等常见物质中也能进行激烈反应。
2. 碱金属与水的反应碱金属与水发生剧烈反应,并放出大量氢气。
以钠与水反应为例:2Na(s) + 2H₂O(l) → 2NaOH(aq) + H₂(g)该反应产生了氢氧化钠溶液和氢气。
反应过程中会出现发烟、冒火、溅射的现象。
3. 碱金属与酸的反应碱金属与酸产生中和反应,生成相应的盐和水。
以钠与盐酸反应为例:2Na(s) + 2HCl(aq) → 2NaCl(aq) + H₂(g)该反应生成了氯化钠盐和氢气。
4. 碱金属离子的颜色特点碱金属离子在化合物中具有不同的颜色特点。
例如,铷离子(Rb⁺)在溶液中呈紫色,锂离子(Li⁺)呈红色。
二、卤素的性质1. 卤素的基本特点卤素是元素周期表第ⅦA族五种非金属元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和铯(Cl)。
卤素具有以下特点:- 在自然界中多以单质形式存在。
- 高电负性:由于原子结构中外层电子云稳定且容易吸引电子,因此卤素都具有很高的电负性。
- 卤素分子是由两个相同原子组成的双原值分子。
2. 卤素的物理性质卤素在常温下呈现不同的颜色,氟元素无色、氯元素淡黄绿色、溴元素深红褐色和碘元素紫黑色。
此外,卤素具有以下物理性质:- 摩尔质量:由于原子量的增加,摩尔质量也相应增大。
- 密度:随着原子半径增加,密度也会增加。
- 熔点和沸点:从氟到碘,熔点和沸点依次升高。
化学主族的名词解释化学主族是指元素周期表中IA、IIA、IIIA、IVA、VA、VIA、VIIA七个元素家族,它们分别是碱金属、碱土金属、硼族、碳族、氮族、氧族和卤族。
这七个家族具有一些共同的性质和特征,下面将对这些主要的化学主族进行逐一讨论。
1. 碱金属:碱金属主族包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素在周期表中位于第一群,它们都是最活泼的金属元素,通常以单质的形式存在。
它们具有低离化能、高电化学活性以及在水中放出氢气的特性。
由于活泼性很高,碱金属只存在于自然界中的化合物形式,如氯化钠和碳酸钠等。
2. 碱土金属:碱土金属主族包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
这些元素在周期表中位于第二群,它们的性质与碱金属相似,但比碱金属更稳定。
碱土金属具有高熔点和难溶于水的特性,因此常以氧化物或硫酸盐的形式存在。
3. 硼族:硼族主族包括硼(B)、铝(Al)、镓(Ga)、铟(In)、铊(Tl)和镓(Nh)。
这些元素在周期表中位于第三族,它们的最外层电子配置为ns2np1。
硼族元素在化合物中通常表现为酸性物质,在水中具有一定的溶解性。
铝和铟是工业上广泛应用的金属,而硼则以它在玻璃和陶瓷制造中的应用而闻名。
4. 碳族:碳族主族包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)和矾(Fl)。
这些元素位于周期表中的第四族,它们的最外层电子配置为ns2np2。
碳族元素在自然界中以广泛的形式存在,如碳是生命的基础,硅是地壳中第二丰富的元素。
碳素的特殊性质使得它形成了无数的有机化合物,使有机化学成为化学的重要分支。
5. 氮族:氮族主族包括氮(N)、磷(P)、砷(As)、锑(Sb)、锗(Bi)和鉅(Mc)。
这些元素位于周期表中的第五族,它们的最外层电子配置为ns2np3。
氮族元素的特点是在氧化还原反应中容易获取或丢失三个电子,因此它们在生物体系中起着重要的作用,如氮在蛋白质和核酸的构建中起着重要的作用。
主族元素性质知识讲解主族元素性质主族元素性质教学重点:碱⾦属、氧族元素、卤族元素、碳族元素、氮族元素的化学性质教学难点:碱⾦属、氧族元素、卤族元素、碳族元素、氮族元素的化学性质教学过程:⼀、复习上节课内容,讲解不懂习题。
⼆、学习碱⾦属、氧族元素、卤族元素、碳族元素、氮族元素的化学性质1.碱⾦属元素包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)六种元素,由于钫是⼈⼯放射性元素,不在中学化学中学习。
碱⾦属元素原⼦最外层只有⼀个电⼦,在反应中易失去电⼦⽽显+1价,表现出还原性,均为强还原剂。
在⾃然界中都以化合态存在,单质都有⼈⼯制得。
(1)递变性:Li、Na、K、Rb、Cs等碱⾦属元素的原⼦核外电⼦层数逐渐增多,原⼦半径逐渐增⼤,最外层电⼦逐渐易失去,元素的⾦属活泼性逐渐增强。
硬度:⼩,且随Li、Na、K、Rb、Cs,⾦属的硬度逐渐减⼩。
这是由于原⼦的电⼦层数逐渐增多,原⼦半径逐渐增⼤,原⼦之间的作⽤⼒逐渐减弱所致。
碱⾦属的硬度⼩,⽤⼩⼑可切开。
碱⾦属的熔点低,熔点最⾼的锂为180.5℃,铯的熔点是28.4℃。
随着原⼦序数的增加,单质的熔点逐渐降低物理性质:碱⾦属除铯略带⾦⾊光泽,其余都带银⽩⾊⾦属光泽,质地软,有延展性,密度⽐较⼩,熔沸点都⽐较低,是电和热的良导体。
(2)化学性质:A. 与⾮⾦属反应:碱⾦属的单质可与⼤多数⾮⾦属单质反应,⽣成物都是含R+阳离⼦的离⼦化合物。
碱⾦属与氧⽓反应时,除锂和常温下缓慢氧化的钠能⽣成正常的氧化物(R2O)外,其余的碱⾦属氧化物是复杂氧化物。
4Li + O2 燃烧 2Li2O Na + O2常温 Na2O2Na + O2燃烧 Na2O2(过氧化钠,氧元素化合价-1,发出淡黄⾊⽕焰,⽣成淡黄⾊固体)2 K + O2常温K2O2 K + O2 燃烧 KO2(超氧化钾)B. 与H2O反应:碱⾦属单质都能与⽔反应,⽣成碱和氢⽓。
2R+2H2O=2ROH+H2↑(R代表碱⾦属原⼦)递变性:随着原⼦序数的增⼤,⾦属与⽔反应的剧烈程度增⼤,⽣成物的碱性增强。
元素周期表中的化学族化学族指的是元素周期表中具有相似化学性质的一组元素。
根据元素周期表的分布规律,我们可以将周期表中的元素分为不同的化学族,如碱金属族、碱土金属族、卤素族、氧族等。
这些化学族在化学性质上具有相似的特点,对于我们理解元素的性质和化学反应有着重要的意义。
一、碱金属族碱金属族是元素周期表中的第一族,包括氢(H)、锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这一族元素具有低密度、低熔点和较强的金属性质。
它们在常温下都是固体,具有较低的密度和较低的熔点,容易形成离子化合物。
碱金属与水反应时会产生氢气,同时也会产生碱性溶液,因此被称为碱金属。
二、碱土金属族碱土金属族是元素周期表中的第二族,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
碱土金属具有较高的熔点和较硬的性质,比碱金属更具金属特性。
碱土金属的离子易失去2个价电子,形成+2的离子。
它们的化合物在溶液中能够释放出钙离子,对生物体内的骨骼生长和维持神经传导起着重要作用。
三、卤素族卤素族是元素周期表中的第七族,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
卤素族元素具有非常强烈的氧化性,它们可以与金属反应,形成离子化合物。
此外,卤素族元素在自然界中主要以单质形式存在,可以与金属形成盐类。
卤素在有机化学中也有着广泛的应用。
四、氧族氧族是元素周期表中的第六族,包括氧(O)、硫(S)、硒(Se)、碲(Te)和钋(Po)。
氧族元素有着较高的电负性,是化学反应中常见的活泼元素。
氧族元素在化合物中常以-2的价态存在,可以与许多其他元素形成不同类型的化合物。
氧族元素在地球上的存在和生物体内的各种生命过程紧密相关。
五、稀有气体稀有气体是元素周期表中的第十八族,包括氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)和氡(Rn)。
稀有气体具有高稳定性,不易与其他元素反应,因此被称为“稀有”。
化学高三元素周期表知识点元素周期表是化学中的重要工具,用于组织和分类化学元素。
它按照元素的原子序数、原子量和化学性质等特征进行排列,能够清晰地展示元素之间的关系和规律。
对于高三学生而言,了解元素周期表的知识点对于化学学科的学习非常关键。
本文将介绍一些高三化学中涉及的元素周期表知识点。
1. 元素周期表的结构元素周期表通常由水平周期和垂直族组成。
水平周期从左至右按照原子序数递增排列,垂直族按照共享相似化学性质的元素进行分组。
沿着周期表的对角线,有一条称为“主族元素”的线,主要由金属元素组成。
2. 元素周期表的分类元素周期表中元素的分类主要有金属、非金属和类金属三种。
金属元素位于周期表的左侧和中间区域,具有较好的导电性和导热性。
非金属元素则分布在周期表的右侧,通常呈现出不良的导电和导热性能。
类金属元素位于周期表的金属与非金属之间,具有介于二者之间的性质。
元素周期表展示了多种周期性规律,其中包括周期性的原子半径、离子半径、电离能、电负性等。
这些规律反映了元素内部电子结构的特征。
例如,原子半径在一个周期中从左至右递减,而在一个族中从上至下递增。
电离能则呈现相反的趋势,即从左至右递增,从上至下递减。
4. 元素周期表中的族别特点元素周期表中的族别是具有相同电子构型和化学性质的元素组。
- 碱金属:位于周期表的第一族,包括锂、钠、钾等元素。
它们具有低密度、低熔点和良好的导电性能。
- 碱土金属:位于周期表的第二族,包括镁、钙、锶等元素。
这些元素在化合物中通常以+2价的形式存在。
- 卤素:位于周期表的第七族,包括氟、氯、溴等元素。
它们具有较高的电负性,并且能与金属形成离子化合物。
- 惰性气体:位于周期表的第八族,包括氦、氖、氩等元素。
这些元素具有完全填充的外层电子壳,因此具有极低的化学反应性。
元素周期表中的过渡元素位于周期表的中央区域,它们具有不同的化学性质。
过渡元素的特点包括多种化合价、良好的催化性能、以及形成有色化合物等。
第一章第二节主族元素碱金属和卤素
(一)碱金属元素:
1.原子结构相似性:最外层电子数均为,均易电子,具有强性递变性:随着核电荷数的递增,电子层数逐渐,原子半径逐渐,失电子能力逐渐,还原性(元素金属性)逐渐。
从Li到Cs的金属性逐渐增强。
2.碱金属化学性质的相似性:
4Li + O2 Li2O 2Na + O2 Na2O2
点燃点燃
2 Na + 2H2O =2NaOH + H2↑ 2K + 2H2O =2KOH + H2↑
2R + 2 H2O = 2 ROH + H2 ↑
★★结论:碱金属元素原子的最外层上都只有___个电子,都显___ 价.
它们的化学性质相似。
都能与水和氧气反应
★★结论:1)原子结构的递变性导致化学性质的递变性。
★★★2)金属性强弱的判断依据:与水或酸反应越容易,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强,
碱性:LiOH <NaOH <KOH < RbOH < CsOH
3.碱金属物理性质的相似性和递变性:
1)相似性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。
2)递变性(从锂到铯):①密度逐渐增大(K反常)②熔点、沸点逐渐降低
★★小结:碱金属原子结构的相似性和递变性,导致了碱金属化学性质、物理性质的相似性和递变性。
(二)卤族元素:
1.原子结构相似性:最外层电子数均为,均易电子,具有强性递变性:随着核电荷数的递增,电子层数逐渐,原子半径逐渐,得电子能力逐渐,氧化性(元素非金属性)逐渐。
还原性(元素金属性)逐渐从F到I的非金属性逐渐减弱。
2.卤素单质物理性质的递变性:(从F2到I2)
(1)卤素单质的颜色逐渐加深;(2)密度逐渐增大;(3)单质的熔、沸点升高
3.卤素单质与氢气的反应:X2 + H2= 2 HX
卤素单质与H2的剧烈程度:依次减弱;生成的氢化物的稳定性:依次减弱生成的氢化物的稳定性:HF HCl HBr HI
4.卤素单质间的置换
2NaBr +Cl2=2NaCl + Br2氧化性:Cl2________Br2;还原性:Cl-_____Br- 2NaI +Cl2=2NaCl + I2氧化性:Cl2_______I2;还原性:Cl-_____I-2NaI +Br2=2NaBr + I2氧化性:Br2_______I2;还原性:Br-______I-
★★结论:单质的氧化性:依次减弱,对于阴离子的还原性:依次增强★★★5. 非金属性的强(弱)的判断依据:①单质与氢气易(难)反应;②生成的氢化物稳定(不稳定);③最高价氧化物的水化物(含氧酸)酸性强(弱);
④相互置换反应(强制弱)2NaBr+Cl2=2NaCl+Br2。
碱金属和卤素历年试题
1.关于同主族元素从上到下的下列说法不正确的是
A.原子半径依次增大B金属性逐渐增强C.非金属性逐渐减弱D.原子得电子能力逐渐增强2.下面对卤素单质砹的性质预测可能正确的是
A.是白色固体 B.密度比碘的大,熔点比碘的高
C.在加热条件下能与氢气剧烈反应 D.能从KI溶液中置换出碘
3.下列各组比较中,正确的是
A.酸性:H4SiO4>H3PO4>H2SO4>HClO4B.碱性:Be(OH)2﹤Mg(OH)2﹤KOH
C.还原性:H2Se﹤H2S﹤H2O D.稳定性:HF>HCl>HBr
4.根据元素周期表和元素周期律分析下列说法,其中不正确的是
A.硒化氢比硫化氢稳定B.铍原子失电子能力比镁强
C.砹的氢化物不如氯化氢稳定D.氢氧化钾比氢氧化钠的碱性强
5.对于VIIA族元素,下列说法不正确的是
A.可形成-l价离子B.从上到下原子半径逐渐减小C.从上到下原子半径逐渐增大D.从上到下非金属性逐渐减弱
6.下列物质中,与氢气反应程度最剧烈
...的是
A.F2 B.Cl2C.Br2D.I2
7.下列说法正确的是
A.碱金属的单质中,锂的还原性最强
B.第ⅠA族所有元素的金属性都比第ⅡA族元素的金属性强
C.随着核电荷数的递增,卤族元素的气态氢化物的稳定性逐渐减弱
D.随着核电荷数的递增,第三周期元素的氧化物对应的水化物的碱性逐渐增强
8.天然存在的金属钫(Fr)极微量。
它是碱金属元素中最重的元素。
根据它在周期表中的位
置预言其性质,其中正确的是
A.在已知元素中具有最大的原子半径B.在空气中燃烧时生成氧化物Fr2O
C.氧化物对应的水化物是极强的碱D.其单质的熔点比金属钠的熔点高
9.居里夫人发现的镭(Ra),是元素周期表中第七周期第ⅡA族元素(Be、Mg、Ca、Sr、Ba、
Ra)中最后一种。
下列关于镭的性质描述不正确
...的是
A.氢氧化物呈两性 B.单质能使水分解,放出氢气
C.在化合物中呈+2价 D.碳酸盐难溶于水
10.下列比较中,正确的是
A.受热稳定性:HI>HBr>HCl>HF B.单质氧化性:F2>Cl2>Br2>I2
C.微粒半径:F—<Na+<Mg2+D.单质的密度:Li>Na>K>Cs
11.下列递变规律不正确的是
A.N、O、F气态氢化物稳定性依次增强 B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大 D.P、S、Cl最高正价依次升高
12. 碱金属是典型的活泼金属,其根本原因是()
A. 碱金属密度小,熔沸点低
B. 碱金属在常温下易被氧化
C. 碱金属原子的核电荷数比较小
D. 碱金属原子最外电子层都只有一个电子,且容易失去
13. 按F,Cl,Br,I的顺序,下列递变规律正确的是()
A.非金属性逐渐增强 B.原子半径逐渐减小
C.气态氢化物的稳定性逐渐增强 D.单质的氧化性逐渐减弱
14.(7分)元素在周期表中的位置,反映了元素的
原子结构和元素性质。
右图是元素周期表的一
部分。
(1)阴影部分元素N在元素周期表中的位置为
第周期族,其单质分子
中含有的共价键数目为个。
(2)根据元素周期律,请你预测H3AsO4、H3PO4、
的酸性强弱:H3AsO4 H3PO4(用“>”、
“<”或“=”表示)。
15.(13分)A、B、C、D、E五种短周期元素的原子序数依次增大。
A和C,B和E同主族,C、D、E同周期。
由A、B组成的两种化合物甲和乙都为液态,甲中A、B原子数之比为2:1,乙中为1:1。
由B、C组成的两种化合物丙和丁都为固态,丙中C、B原子数之比为2:1,丁中为1:1。
C、D、E的最高价氧化物对应的水化物两两之间均能发生反应,且均有甲生成。
则:(1)写出各元素的名称:A为 B为 C为 D为 E为
(2)E元素的原子结构示意图为:(3)丁的电子式为:
用电子式表示甲的形成过程为:
(4)C、D的最高价氧化物对应水化物发生反应的离子方程式为:
28.⑴氢;氧;钠;铝;硫(2) (3);
31.(8分)(1)②④①③(2分)
(2)金属活动性顺序为 Na > Mg > Al(2分)
(3)减小、增强、减弱、金属活动性(4分)
24.(1)二 VA 3(每空1分)(2)<(2分)(3)更小(2分)。