d区ds区和f区元素
- 格式:ppt
- 大小:516.50 KB
- 文档页数:54







s区、d区、ds区重要元素及其化合物(s Block, ds Block, d BlockElementsandCompounds)9.1 s区元素s区元素中锂(Lithium)、钠(Sodium)、钾(Potassium)、铷(Rubidium)、铯(Cesium)、钫(Francium)六种元素被称为碱金属(alkaliMetals)元素。
铍(Beryllium)、镁(Magnesium)、钙(Calcium)、锶(Strontium)、钡(Barium)、镭(Radium)六种元素被称为碱土金属(alkalineearthmetals)元素。
锂、铷、铯、铍是稀有金属元素,钫和镭是放射性元素。
碱金属和碱土金属原子的价层电子构型分别为ns1和ns2,它们的原子最外层有1~2个电子,是最活泼的金属元素。
9.1.1通性碱金属和碱土金属的基本性质分别列于表9-1和表9-2中。
表9-1碱金属的性质碱金属原子最外层只有1个ns电子,而次外层是8电子结构(Li的次外层是2个电子),它们的原子半径在同周期元素中(稀有气体除外)是最大的,而核电荷在同周期元素中是最小的,由于内层电子的屏蔽作用较显著,故这些元素很容易失去最外层的1个s电子,从而使碱金属的第一电离能在同周期元素中最低。
因此,碱金属是同周期元素中金属性最强的元素。
碱土金属的核电荷比碱金属大,原子半径比碱金属小,金属性比碱金属略差一些。
s区同族元素自上而下随着核电荷的增加,无论是原子半径、离子半径,还是电离能、电负性以及还原性等性质的变化总体来说是有规律的,但第二周期的元素表现出一定的特殊性。
例如锂的EΘ(Li+/Li)反常地小。
表9-2碱土金属的性质s区元素的一个重要特点是各族元素通常只有一种稳定的氧化态。
碱金属的第一电离能较小,很容易失去一个电子,故氧化数为+1。
碱土金属的第一、第二电离能较小,容易失去2个电子,因此氧化数为+2。
在物理性质方面,s区元素单质的主要特点是:轻、软、低熔点。

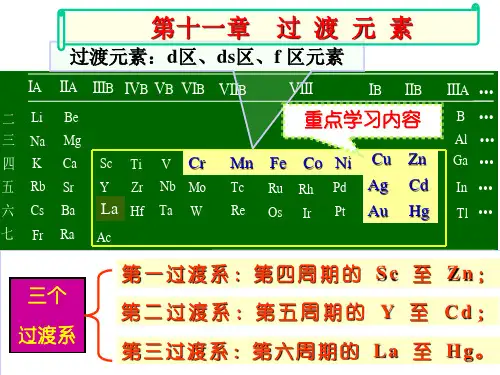


第七章元素与元素性质的周期性1.周期表与元素周期表的分区:按原子最后一个电子占据的轨道,周期表中元素可分为5个区。
s区的价电子构型为ns1~2,p区的价电子构型为ns2np1~6,d区的价电子构型为(n-1)d1~9ns1~2,ds区的价电子构型为(n—1)d10ns1~2,f区的价电子构型为(n —2)f0~14(n—1)d0~2ns2。
构造原理:基态多电子原子的电子填充原子轨道的一般次序为1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p 构造原理的前提条件是连续轨道间具有较大的能级差,而电子间的排斥作用相对较小。
对于d区元素与f区元素,由于价轨道间能级差较小,当电子间排斥作用超过轨道间能级差时,原子的价电子构型就会出现提前到达全满、半满的不符合构造原理的特殊构型。
通常,亚层轨道为全满或半满时比较稳定。
2.原子性质的周期性(1)原子半径一般规律:同一族元素,从上到下原子半径依次增大;同一周期主族元素,从左到右原子半径依次减小.镧系收缩:从镧到镥,原子半径和三价离子半径逐渐减小。
镧系收缩造成镧系后第三系列过渡元素的原子半径比一般的增大幅度小,与第二系列过渡同一族元素的原子半径接近.d电子也具有较差的屏蔽效应,造成d区元素半径收缩.原子半径存在不同的类型,主要有金属半径、离子半径、共价半径、van der Waals半径,使用时需要注意。
(2)电离能元素第一电离能的一般规律:同一族元素,从上到下逐渐减小;同一周期元素,从左到右大体上依次增大。
元素第一电离能最小的元素为周期表左下角的Cs,元素第一电离能最大的元素为周期表右上角的He.该规律一般可用的变化规律来解释。
原子有效核电荷Zeff(3)电子亲和能电子亲和能的周期性变化比较复杂,变化趋势不很清晰。
粗略的规律为:同一周期元素,从左到右原子电子亲和能依次增大,这可用原子有效核电荷Z的变化规律来解释。
s区元素蓝色代表s区元素,氦也属于s区元素。
s区元素主要包括元素周期表中IA族元素和IIA族元素,IA族元素包括氢、锂、钠、钾、铷、铯、鍅七种元素,由于钠和钾的氢氧化物是典型的碱,因此除氢外的这六种元素又称碱金属,IIA族元素包括铍、镁、钙、锶、钡、镭六种元素,由于钙,锶,钡的氧化物之性质介于碱金属与稀土元素之间,因此又称碱土金属。
由于氦的电子排布为1s2,故被分为S区元素。
钫和镭都是放射性元素。
锂最重要的矿石是锂辉石(LiAlSi2O6)。
钠主要以氯化钠溶液的形式存在于海洋,盐湖及岩石中。
钾的主要矿物是钾石盐(2KCl·MgCl2·6H2O)。
铍的主要矿物是绿柱石(3BeO·Al2O3·6SiO2)。
镁的主要矿石是菱镁矿(MgCO3)及白云石。
另外,钙,锶,钡则主要以碳酸盐及硫酸盐的形式存在,如方解石(碳酸钙),石膏(二水合硫酸钙),天青石(硫酸锶),重晶石(硫酸钡)。
在本区元素中同一主族从上到下、同一周期从左至右性质的变化都呈现明显的规律性。
p区元素p区元素包括元素周期表中IIIA族元素~VIIIA族元素。
IIIA族元素又称为硼族元素,包括硼、铝、镓、铟、铊等元素;IVA族元素又称作碳族元素,包括碳、硅、锗、锡、铅等元素;VA族元素又称作氮族元素,包括氮、磷、砷、锑、铋等元素;VIA族元素又称为氧族元素,包括氧、硫、硒、碲、钋等元素;VIIA族元素又称卤素,包括氟、氯、溴、碘、砹等元素;VIIIA族元素或0族元素,又称为稀有气体或惰性气体,包括氦、氖、氩、氪、氙、氡等元素。
d区元素d区元素是元素周期表中的副族元素,即第3至第12族元素。
这些元素中具有最高能量的电子是填在d轨道上的。
这些元素有时也被称作过渡金属。
D区的D来自英语的“diffuse”。
ds区元素ds区元素是指元素周期表中的ⅠB、ⅡB两族元素,包括铜、银、金、锌、镉、汞6种自然形成的金属元素和錀、鎶2种人工合成元素。