ds区元素
- 格式:docx
- 大小:260.23 KB
- 文档页数:20



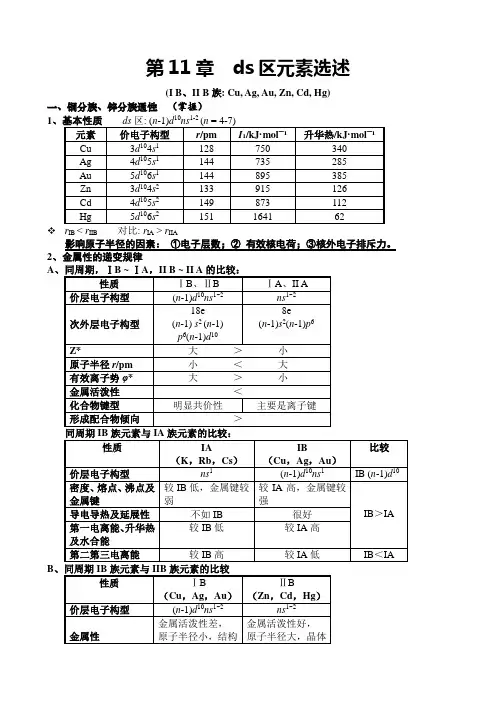
第11章ds区元素选述(I B、II B族: Cu, Ag, Au, Zn, Cd, Hg)一、铜分族、锌分族通性(掌握)101-21、影响原子半径的因素:①电子层数;②有效核电荷;③核外电子排斥力。
2、ABIVB …… VIII IB IIB IIIAAlZ* 显著↗,主导Ti Cu Zn Ga r↗,次要Zr Ag Cd In ∴金属性渐弱Hf Au Hg Tl(周期性)副族(IVB ~ VIII)和IIIA主族(铝分族)金属性由上到下依次减弱(Z*因素占主导地位),与其它主族和IIIB族(Sc,Y,镧系,锕系)( r因素占主导地位)规律相反!主族(除IIIA外)和IIIB族金属性、:上→下金→。
3、熔沸点与升华热、颜色的比较:A、熔沸点与升华热熔沸点:IB >IIB IB>IA IIB<IIA升华热:IB >IIB IB>IA IIB<IIAB、颜色(d-d跃迁引起)IB(+1) :3d104d10 5d10 Cu +,Ag +,Au + 均无色IB(+2) :Cu2+ 3d9,Ag3+ 4d8,Au3+ 5d8 有色蓝色棕色棕色IIB:Zn2+ 3d10 、Cd2+ 4d10 、Hg2+ 5d10 均无色d1 - d9化合物或配离子有颜色(d-d跃迁引起);d0和d10化合物或配离子多数无色。
特例:HgI2黄色:O2—→ Hg2+ 电荷迁移跃迁引起。
[Hg(II) d10]金属性:同周期:IB<IIB同族:上→下:渐弱(有效核电荷Z*因素占优)1、与酸反应A、非氧化性酸(如HCl,H3PO4,稀H2SO4……)Zn ZnCl 2+H 2↑+ HCl =Cd CdCl 2+H 2↑而Cu 、Ag 、Au 、Hg 不反应。
B 、氧化性酸(如HNO 3, 浓H 2SO 4……)M + HNO 3→M(NO 3)2+NO 2、NO 、NH 4+ (M=Zn)M + H 2SO 4∆−−→MSO 4 + SO 2↑+ H 2O (M =Cu 、Ag 、Zn 、Cd 、Hg ,但Au 不反应。

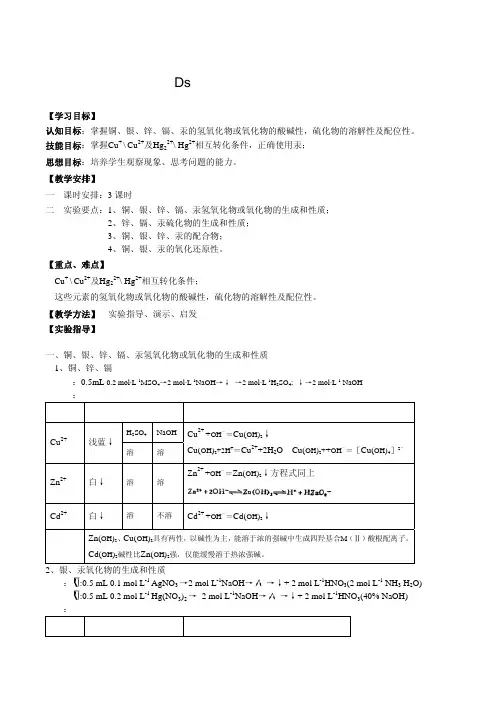

第十一章副族元素化学第十章ds区元素第节素概述第一节ds区元素概述ds 区元素是指元素周期表中的ⅠB 、ⅡB 两族元素包括族元素,包括铜、银、金、锌、镉、汞等6种自然形成的金属元素及两种人工合成元素。
ds 区的名称是因为它们的外层电子构型:ⅠB : (n-1)d 10s 1或ⅡB :(n-1)d 10s 2从广义的角度看,ds区实际上是d区的一部分。
因本区元素次外层(n-1)d轨道已填满电子,而最外电子层构型和区相同,所以满电子,而最外电子层构型和s区相同,所以将此区域元素称为ds区元素。
ds区元素都是过渡金属。
但由于其d层电子是全充满的,所以体现的性质与其他过渡金属有所不同。
如:最高氧化态只能达到+3如:最高氧化态只能达到+3。
3第二节铜族元素(一)铜族元素的单质1.物理性质(1) 特征颜色:Cu(紫红),Ag(白),Au(黄)(2) 溶、沸点较其它过渡金属低(3) 导电性、导热性好,且Ag>Cu>Au(3)导电性导热性好且(4)延展性好铜族元素2.化学性质(1)与O 2作用)2CuO(O 2Cu 2黑⎯→⎯+∆)(CO (OH)Cu CO O H O 2Cu 322222绿⎯→⎯+++∆碱式碳酸铜Au 、Ag O 发生反应,当有沉淀剂或g 不与2发生反应,有沉淀剂或配合剂存在时,可发生反应。
5=铜族元素−−−+⎯→⎯+++4OH]4[M(CN)8CN O 2H O 4M AuAg Cu M 222,,−++⎯→⎯+++OH)(])4[Cu(NH 8NH O 2H O 4Cu 23322无色)(])[Cu(NH 243蓝+不可用铜器盛氨水O 2→O2H S 2Ag O S 2H 2Ag 2222+⎯→⎯++6银器年久变黑(2) 与酸作用铜族元素c Cu、Ag、Au不能置换稀酸中的H +d 若生成难溶物或配合物,单质还原能力则增强()2A I 2A (g)H S(s)Ag S H 2Ag 222+⎯→⎯+(g)H 2AgI 4I 2H 2Ag 2-2+⎯→⎯++−+③Cu 、Ag 、Au 可溶于氧化性酸7(二)铜的重要化合物Cu 2O CuO颜色暗红色黑色溶解性难溶于水,易溶于酸热稳定性稳定,1235熔化也不分解高C 加入氨水[Cu(NH 3)2]+(无色)微溶Cu 2O + 2H +→Cu 2++ Cu + H 2OC O +2HCl 2C Cl +H Cu 2O + 2HCl →2CuCl + H 2O 10004CuO Cu O +O C (白色)CuO + 2H +→Cu 2++ H 2O4CuO Cu 2O + O 28(二)铜的重要化合物Cu 2O CuO颜色暗红色黑色溶解性难溶于水,易溶于酸热稳定性稳定,1235 熔化也不分解高C 加入氨水[Cu(NH 3)2]+(无色)微溶Cu 2O+4NH 3+H 2O →2[Cu(NH 3)2]++2OH -在空气中被氧化4[Cu(NH 3)2]++O 2+8NH 3+2H 2O →蓝94[Cu(NH 3)4]2+(深蓝)+4OH -CuOH 不稳定,至今尚未制得为浅蓝色难溶于水2-Cu(OH)2为浅蓝色,难溶于水1.受热易脱水2[Cu(OH)4]+C 6H 12O 6(葡萄糖)→Cu 2O +C 6H 12O 7+4OH -+2H 2O Cu(OH)2 CuO + H 2O 80~90C 两性以碱性为主(葡萄糖酸)2.两性:以碱性为主+2H + →2+ O (用此反应可检查尿糖Cu(OH)2+ 2H Cu +H 2O (浅兰色)Cu(OH)2+ 2OH -→[Cu(OH)4]2-(亮兰色)3. 溶于氨水2++2OH-10Cu(OH)2+4NH 3→[Cu(NH 3)4]2 + 2OH制取:1.,Cu 2+ + Cu + 4Cl -→2[CuCl 2]-1. 在热、浓HCl 溶液中, 用Cu 粉还原CuCl 2(无色)2. 用水稀释-→2CuCl ()+2Cl -总反应:Cu 2+ + Cu + 2Cl -→ 2CuCl2[CuCl 2]2CuCl (白色) + 2Cl 应用:CuCl + CO + HCl →[CuCl(CO)] ·H 2O 11(测CO )2无水CuCl 2为棕黄色固体,是共价化合物易溶于水和有机溶剂(如乙醇、丙酮)CuCl 2溶液随c (Cl -)不同而呈不同颜色[C Cl 24H O [C (H 2+4Cl [CuCl 4]2-+ 4H 2O [Cu(H 2O)4]2+ + 4Cl -)(12(黄色) (浅蓝色)无水CuSO4为白色粉末,易溶于水,吸水性强,吸水后呈蓝色,可检验有机液体中的微量水分。




ds区元素(铜、银、锌、镉、汞)的性质【摘要】ds区元素是指元素周期表中的ⅠB、ⅡB两族元素,包括铜、银、金、锌、镉、汞6种自然形成的金属元素和Rg、Uub2种人工合成元素。
ds区的名称是因为它们的电子构型都是d10s1(ⅠB)或d10s2(ⅡB)。
ds区是d区元素的一部分,ds区元素都是过度金属。
但由于它们的d层是满的,所以体现的性质与其他过渡金属有所不同(比如说最高的氧化态只能达到+3)。
【关键字】元素过渡酸碱性;一、实验目的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的生成和性质;6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理IB IIBCu Zn Cu(+2,+1)Zn(+2)Ag Cd Ag(+1)Cd(+2)Au Hg Au(+1,+3)Hg(+2,+1)蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO。
AgOH在常温下极易脱水而转化为棕色的Ag2O。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg 2O(I)。
易形成配合物是这两副族的特性,Cu 2+、Ag +、Zn 2+、Cd 2+与过量的氨水反应时分别生成[Cu(NH 3)4]2+、[Ag(NH 3)2]+、[Zn(NH 3)4]2+、[Cd(NH 3)4]2+。
但是Hg 2+和Hg 22+与过量氨水反应时,如果没有大量的NH 4+存在,并不生成氨配离子。
如:HgCl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ 2 NH 4Cl Hg 2Cl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ Hg↓黑+NH 4Cl(观察为灰色)Cu 2+具有氧化性,与I -反应,产物不是CuI 2,而是白色的CuI :Cu2++ I -= 2CuI↓白 + I 2将CuCl 2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl 2]-的溶液。
1ds区元素1.1 本章学习要求(1)掌握铜和银的重要化合物的性质,Cu(Ⅰ)和Cu(Ⅱ)的相互转化。
(2)掌握锌和汞的重要化合物的性质,Hg(Ⅰ)和Hg(Ⅱ)的相互转化。
(3)了解镉的重要化合物性质。
(4)了解含汞、镉废水的处理。
ds区元素包括铜族元素(铜、银、金)和锌族元素(锌、镉、汞)。
这两族元素原子的价电子构型与其它过渡元素有所不同,为(n-1)d10n s1~2。
由于它们的次外层d能级有10个电子(全满结构),而最外层的电子构型又和s区相同,所以称为ds区。
1.2 铜族元素通性和单质1.2.1概述ⅠB族元素包括铜(Cu)、银(Ag)、金(Au)三种元素,通常称为铜族元素。
铜族元素原子的价电子构型为(n-1)d10n s1。
最外层与碱金属相似,只有1个电子,而次外层却有18个电子(碱金属有8个电子)。
因此与同周期的ⅠA族元素相比,铜族元素原子作用在最外层电子上的有效核电荷较多,最外层的s电子受原子核的吸引比碱金属元素原子要强得多,所以铜族元素的电离能比同周期碱金属元素显著增大,原子半径也显著减小,铜族元素单质都是不活泼的重金属,而相应的碱金属元素的单质都是活泼的轻金属。
表 1.2-1 碱金属与铜族元素比较自然界的铜、银主要以硫化矿存在,如辉铜矿(Cu2S),黄铜矿(CuFe S2),孔雀石[Cu2(OH)2C O3]等;银有闪银矿(Ag2S);金主要以单质形式分散在岩石或沙砾中,我国江南、甘肃、云南、新疆、山东和黑龙江等省都蕴藏着丰富的铜矿和金矿。
铜族元素密度较大,熔点和沸点较高,硬度较小,导电性好,延展性好,尤其是金。
1克金可抽3公里长的金丝,可压成0.1微米的金箔,500张的总厚度比头发的直径还薄些。
金易生成合金,尤其是生成汞齐。
铜是宝贵的工业材料,它的导电能力虽然次于银,但比银便宜得多。
目前世界上一半以上的铜用在电器、电机和电讯工业上。
铜的合金如黄铜(Cu-Zn)、青铜(Cu-Sn)等在精密仪器、航天工业方面都有广泛的应用。
1ds区元素1.1 本章学习要求(1)掌握铜和银的重要化合物的性质,Cu(Ⅰ)和Cu(Ⅱ)的相互转化。
(2)掌握锌和汞的重要化合物的性质,Hg(Ⅰ)和Hg(Ⅱ)的相互转化。
(3)了解镉的重要化合物性质。
(4)了解含汞、镉废水的处理。
ds区元素包括铜族元素(铜、银、金)和锌族元素(锌、镉、汞)。
这两族元素原子的价电子构型与其它过渡元素有所不同,为(n-1)d10n s1~2。
由于它们的次外层d能级有10个电子(全满结构),而最外层的电子构型又和s区相同,所以称为ds区。
1.2 铜族元素通性和单质1.2.1概述ⅠB族元素包括铜(Cu)、银(Ag)、金(Au)三种元素,通常称为铜族元素。
铜族元素原子的价电子构型为(n-1)d10n s1。
最外层与碱金属相似,只有1个电子,而次外层却有18个电子(碱金属有8个电子)。
因此与同周期的ⅠA族元素相比,铜族元素原子作用在最外层电子上的有效核电荷较多,最外层的s电子受原子核的吸引比碱金属元素原子要强得多,所以铜族元素的电离能比同周期碱金属元素显著增大,原子半径也显著减小,铜族元素单质都是不活泼的重金属,而相应的碱金属元素的单质都是活泼的轻金属。
表 1.2-1 碱金属与铜族元素比较自然界的铜、银主要以硫化矿存在,如辉铜矿(Cu2S),黄铜矿(CuFe S2),孔雀石[Cu2(OH)2C O3]等;银有闪银矿(Ag2S);金主要以单质形式分散在岩石或沙砾中,我国江南、甘肃、云南、新疆、山东和黑龙江等省都蕴藏着丰富的铜矿和金矿。
铜族元素密度较大,熔点和沸点较高,硬度较小,导电性好,延展性好,尤其是金。
1克金可抽3公里长的金丝,可压成0.1微米的金箔,500张的总厚度比头发的直径还薄些。
金易生成合金,尤其是生成汞齐。
铜是宝贵的工业材料,它的导电能力虽然次于银,但比银便宜得多。
目前世界上一半以上的铜用在电器、电机和电讯工业上。
铜的合金如黄铜(Cu-Zn)、青铜(Cu-Sn)等在精密仪器、航天工业方面都有广泛的应用。
银的导电、传热性居于各种金属之首,用于高级计算器及精密电子仪表中。
自20世纪70年代以来,金在工业上的用途已经超过制造首饰和货币。
铜是许多动植物体内所必须的微量元素之一。
铜和银的单质及可溶性化合物都有杀菌能力,银作为杀菌药剂更具奇特功效。
1.2.2与空气的反应Cu在常温下不与干燥的空气中的O2反应,加热时生成CuO:2Cu+O2(空气)→2CuO(黑色)Cu在常温下与潮湿的空气反应:2Cu+O2+H2O+C O2→Cu(OH)2·CuC O3(铜绿)Au、Ag加热时也不与空气中的O2反应。
银与硫具有较强的亲和作用,和含有H2S的空气接触逐渐变暗:4Ag+2H2S+O2→2Ag2S(黑色)+2H2O1.2.3与酸的反应铜族元素不能从非氧化性稀酸中置换出氢气,铜在加热的条件下能与浓硫酸反应,可以溶于硝酸,银能溶于硝酸,金只能溶于王水。
1.2.4络合反应铜、银、金都易形成配合物。
湿法冶金(用氰化物从Ag、Au的硫化物矿或砂金中提取银和金)就是利用这一性质。
例如:2Ag2S+10NaCN+O2+2H2O→4Na[Ag(CN)2]+4NaOH+2NaCNSO2+4H2O→Na[Au(CN)2]+2NaOH2Au+4NaCN+12然后加入锌粉,银、金即被置换出来:2Na[Ag(CN)2]+Zn→Na2[Zn(CN)4]+2Ag2Na[Au(CN)2]+Zn→Na2[Zn(CN)4]+2Au1.2.5其他铜族元素在高温下也不能与氢、氮和碳反应;与卤素反应情况不同:铜在常温下就有反应,而银较慢,金只有在加热时才能反应。
1.3 铜的化合物1.3.1概述通常铜有+1、+2两种氧化值的化合物。
以Cu(II)化合物最为常见,如氧化铜CuO、硫酸铜CuS O4等。
Cu(I)化合物通常称为亚铜化合物,多存在于矿物中,如氧化亚铜Cu2O、硫化亚铜Cu2S。
下面对Cu(I)和Cu(II)两类化合物的性质做一对比:(1)Cu(I)化合物,如氧化亚铜、硫化亚铜、卤化亚铜、氰化亚铜等大多难溶解于水(配合物除外);较多的Cu(II)化合物易溶解于水。
(2)在固相状态Cu(I)很稳定,因为Cu(I)的价层电子构型为3d10(d轨道为全满的稳定结构),而Cu(II)的价层电子构型为3d9,固相中Cu(I)比Cu(II)更稳定。
自然界存在的辉铜矿(Cu2S)、赤铜矿(Cu2O)都是亚铜化合物。
又如Cu2O的热稳定性比CuO还高:CuO在1100℃时分解成Cu2O和O2,而Cu2O在高达1800℃时才开始分解。
在溶液中,Cu(II)化合物比较稳定,因为Cu2+有较大的水合热(2119kJ/mol),在水溶液中形成了稳定的[Cu(H2O)4]2+配离子。
(3)Cu(I)在水溶液中发生岐化反应。
铜元素的电势图为:→CuCu2+0.159→Cu+0.52E r°>E l°,说明Cu(I)在水溶液中不能稳定存在,易发生岐化反应生成Cu和Cu(II):2Cu +→Cu 2++Cu该反应的平衡常数为lg K °=0.52−0.1590.0592=0.3610.0592=6.098 K °=1.6×106(25℃),可见Cu +的岐化反应比较彻底。
在生产实践中,制得的亚铜化合物必须迅速从溶液中滤出并立即干燥,然后密封包装,才能保持其稳定性。
然而要完全隔绝潮气并不容易,所以亚铜化合物往往不能长期保存。
1.3.2 Cu(I)化合物Cu(I)是Cu 元素的中间价态,它既有氧化性,又有还原性。
1.3.2.1 氧化亚铜(Cu 2O)Cu 2O 为暗红色的固体,有毒。
它是制造玻璃和搪瓷的红色颜料,还用作船舶底漆(可杀死低级海生动物)及农业上的杀虫剂。
Cu 2O 不溶于水,对热稳定,在潮湿空气中缓慢被氧化成CuO 。
它具有半导体性质,曾用作整流器的材料。
Cu 2O 的制备有干法和湿法:Cu 2O 的干法制备在密闭容器中煅烧铜粉和CuO 的混合物,即得暗红色的Cu 2O :Cu+CuO 800℃~900℃→ Cu 2OCu 2O 的湿法制备在水溶液中,以硫酸铜为原料,亚硫酸钠为还原剂,陆续加入适量氢氧化钠,反应过程中溶液维持微酸性(PH=5),Cu 2O 即按以下反应析出:2CuS O 4+3Na 2S O 3→Cu 2O ↓+3Na 2S O 4+2S O 2↑Cu 2O 溶于稀硫酸,之后立即歧化:Cu 2O+H 2S O 4→CuS O 4+Cu+H 2OCu 2O 溶于氨水和氢卤酸时,仍保持+1的氧化值,分别形成稳定的无色配合物,例如[Cu (NH 3)2]+、[CuX 2]−、[CuX 3]2−等。
Cu 2O+4NH 3·H 2O →2[Cu (NH 3)2]OH+3H 2O可见Cu +在水溶液中不稳定会发生岐化反应,而Cu(I)在固相或配位状态下可以稳定存在。
1.3.2.2氯化亚铜CuClCuCl为白色固体物质,属于共价化合物,其熔体导电性差。
通过测定其蒸气的相对分子质量,证实它的分子式应该是Cu2Cl2,通常将其化学式写为CuCl。
CuCl是重要的亚铜盐,在有机合成中用作催化剂和还原剂,在石油工业中作为脱硫剂和脱色剂,肥皂、脂肪和油类的凝聚剂,也常用作杀虫剂和防腐剂。
它能吸收CO而生成氯化羰基亚铜CuCl·CO,此反应在气相分析中可用于测定混合气体中CO的含量,应用颇为广泛。
CuCl和Cu2O一样,难溶于水。
在潮湿空气中迅速被氧化,体现Cu(I)有还原性,由白色而变绿:4CuCl+O2+4H2O→Cu Cl2·3CuO·3H2O+2HClCu(I)也有氧化性:CuI(白)+2Hg→Hg2I2(黄色)+Cu将涂有白色CuI的纸条挂在室内,若常温下3小时白色不变,表明空气中汞的含量不超标。
CuCl能溶于氨水、浓盐酸以及NaCl、KCl溶液,并生成相应的配合物。
在CuCl的制备过程中,综合应用了配位平衡、氧化还原平衡、沉淀平衡等的基本概念。
用S O2还原CuS O4制备CuCl,主要发生了以下三步反应:合成(配合反应),硫酸铜与过量的食盐作用:CuS O4+4NaCl→Na2[Cu Cl4](绿色)+Na2S O4还原,将S O2通入上述溶液中:2Na2[Cu Cl4]+S O2+2H2O→CuCl↓+NaH[Cu Cl3](茶褐色)+2NaCl+2HCl+NaHS O4将上述溶液加入到大量水中,冲稀分解,让配合物转为沉淀物:NaH[Cu Cl3]→NaCl+HCl+CuCl↓(白色)1.3.2.3氢氧化亚铜CuOHCuOH为黄色固体,当用NaOH处理CuCl在盐酸中的冷溶液时,生成黄色的CuOH。
它及不稳定,易脱水变为Cu2O。
1.3.3Cu(II)化合物1.3.3.1氧化铜CuO氧化铜CuO为黑色粉末,难溶于水。
它是偏碱性氧化物,溶于稀酸:CuO+2H+→Cu2++H2O由于发生配合反应,CuO也溶于N H4Cl或KCN等溶液。
加热分解硝酸铜或碱式碳酸铜都能制得黑色的氧化铜:2Cu(NO3)2∆→2CuO+4N O2↑+O2↑Cu2(OH)2C O3∆→2CuO+C O2↑+H2O↑后一反应可以避免N O2对大气的污染,更适合于工业生产。
目前,工业上生产CuO常利用废铜料,先制成CuS O4,再由金属铁还原得到比较纯净的铜粉。
铜粉再经过焙烧得CuO。
有关反应如下:Cu+2H2S O4(浓)∆→CuS O4+S O2↑+2H2OCuS O4+Fe→FeS O4+Cu2Cu+O2450℃→2CuO1.3.3.2氢氧化铜Cu(OH)2Cu(OH)2为浅蓝色粉末,难溶于水。
60~80℃时,逐渐脱水而生成CuO,颜色随之变暗。
Cu(OH)2稍有两性,易溶于酸:Cu(OH)2+H2S O4→CuS O4+2H2O只溶于较浓的强碱,生成四羟基合铜(II)配离子:Cu(OH)2+2OH−→[Cu(OH)4]2−Cu(OH)2也易溶于氨水,生成深蓝色的四氨合铜(II)配离子:Cu(OH)2+4NH3→[Cu(NH3)4](OH)21.3.3.3铜(II)盐铜(II)盐很多,可溶性的有CuS O4、Cu(NO3)2、Cu Cl2;难溶性的有CuS、Cu2(OH)2C O3等。
(1)硫酸铜(CuS O4·5H2O):CuS O4·5H2O为蓝色结晶,又名胆矾或蓝矾。
在空气中慢慢风化,表面上形成白色粉状物。
加热至250℃左右失去全部结晶水成为无水盐。
无水CuS O4为白色粉末,不溶于乙醇和乙醚,其吸水性很强,吸水后即显出特征蓝色。
可利用这一性质来检验乙醚、乙醇等有机溶剂中的微量水分,并可作干燥剂使用。