《结构化学》第六章 金属的结构和性质
- 格式:ppt
- 大小:19.85 MB
- 文档页数:49




第六章配位化合物的结构和性质教学目的:通过学习,使学生对配位化合物的三大化学键理论(价键理论、晶体场理论、分子轨道理论)有所了解,并能够运用合适的理论对常见配合物的结构和性质进行理论分析和解释。
教学重点:1.晶体场理论;2.姜-泰勒效应;3.分子轨道理论。
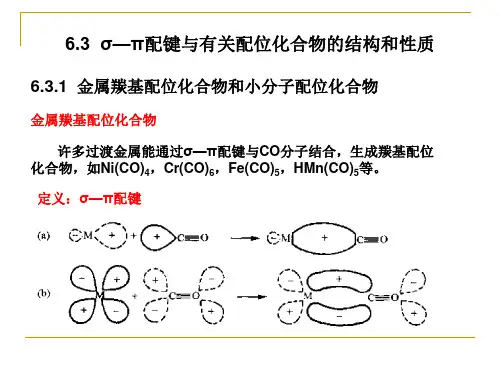
引言:配位化合物简称配合物,又叫络合物,是一类含有中心金属原子(离子)(M)和若干配体(L) 的化合物(MLn)。
中心原子通常是过渡金属元素的原子或离子,具有空的价轨道;而配体则有一对或多对孤对电子。
在广泛的化学实践和量子化学巨大发展的基础上,提出了各种解释中心原子和配体之间化学键本质的理论,主要有价键理论、晶体场理论和分子轨道理论第一节价键理论1928年Pauling把杂化轨道理论应用到配合物中,提出了配合物的价键理论。
一、理论要点:配体的配位原子提供孤对电子进入中心原子(或离子)的空的杂化轨道形成配位键;配位键可分为电价配键和共价配键两种,相应的配合物叫做电价配合物和共价配合物。
二、杂化轨道与空间构型三、电价配键和共价配键1、电价配合物中心离子的电子层结构和自由离子的一样,它与配体是以静电作用力结合在一起,常采用spd外轨道杂化,形成高自旋配合物。
电价配合物特点:配体往往电负性大,不易给出孤电子对,中心离子的结构不发生变化。
配合物中配位键共价性较弱,离子性较强;键能小,不稳定,在水中易分解简单粒子;2、共价配合物中心离子腾出内层能量较低的空d轨道,进行dsp内轨道杂化,接受配体的孤对电子,形成低自旋共价配合物。
共价配合物特点:配体往往电负性较小,较易给出孤电子对,对中心离子的影响较大,使其结构发生变化。
配合物中配位键共价性较强,离子性较弱;由于(n-1)d轨道比nd轨道能量低,所以一般共价配合物比电价配合物稳定,在水溶液中不易解离为简单离子。
3.实验测定:通过测定络合物的磁化率,可判断中央离子与配体间化学键性质kTN x A 32μμ=, )()(反顺O M x x x +=μ磁矩cn ehn n e B B πμμμ4,)2(=+=(玻尔磁子) n 未成对电子数有摩尔磁化率X m 可计算络合物的磁矩μ,由μ可估算出n(未成对电子数),从而可判断此络合物是电价配键,或共价配键。



《结构化学》教学大纲
一、课程基本信息
二、课程教学目标
1.了解用量子力学研究原子结构的基本方法,理解波函数和电子云的径向分布函数和角度分布及核
外电子排布的基本原理,掌握原子、分子和晶体中电子运动的基本规律。
2.了解用量子力学研究分子结构和配合物结构的基本方法,掌握分子轨道理论和配位场理论的基本
原理,深入了解化学键的本质。
初步了解研究分子结构的近代物理实验方法的基本原理。
3.了解晶体点阵结构的特点,理解X-射线衍射的基本原理及Laue和Bragg方程,了解粉末法物相
分析的基本原理。
4.了解金属键的自由电子模型和固体能带理论,掌握球的密堆积、金属单质的结构和离子晶体的若
干简单结构型式,了解离子配位多面体及其连接规律。
三、理论教学内容与要求
四、考核方式
根据结构化学课程的特点,考核方式以期末闭卷考试为主,平时成绩为辅。
期末考试试卷的成绩占总成绩的80%,课堂提问、上课出勤和课后作业作为平时成绩的考核依据共占据20%。
考试的内容以课堂教学的内容为主,考察学生对结构化学基本内容的掌握程度。
期末考题的类型包括选择题,填空题,简答题和综合计算题。


《结构化学》第六章习题6001 试述正八面体场中,中心离子 d 轨道的分裂方式。
6002 试用分子轨道理论阐明 X -,NH 3 和 CN -的配体场强弱的次序。
6003 按配位场理论,在 O h 场中没有高低自旋络合物之分的组态是:---------------- ( )(A) d 3 (B) d 4 (C) d 5 (D) d 6 (E) d 76004 凡是中心离子电子组态为d 6的八面体络合物,其 LFSE 都是相等的,这一说法是否正确?6005 络合物的中心离子的 d 轨道在正方形场中,将分裂成几个能级:---------------- ( )(A) 2 (B) 3 (C) 4 (D) 56006 Fe(CN)63-的 LFSE=________________。
6007 凡是在弱场配位体作用下,中心离子 d 电子一定取高自旋态;凡是在强场配位体作用下,中心离子 d 电子一定取低自旋态。
这一结论是否正确?6008 Fe(CN)64-中,CN -是强场配位体,Fe 2+的电子排布为6g 2t ,故 LFSE 为_____________。
6009 尖晶石的一般表示式为 AB 2O 4, 其中氧离子为密堆积,当金属离子A 占据正四面体T d 空隙时,称为正常尖晶石,而当A 占据O h 空隙时,称为反尖晶石, 试从晶体场稳定化能计算说明 NiAl 2O 4 晶体是什么型尖晶石结构( Ni 2+为d 8结构)。
6010 在 Fe(CN)64-中的 Fe 2+离子半径比 Fe(H 2O)62+中的 Fe 2+离子半径大还是小?为什么?6011 作图证明 CO 是个强配位体。
6012 CoF 63-的成对能为 21000 cm -1,分裂能为 13000 cm -1,试写出:(1) d 电子排布 (2) LFSE 值 (3) 电子自旋角动量 (4) 磁矩6013 已知 ML 6络合物中(M 3+为d 6),f =1,g = 20000 cm -1,P = 25000 cm -1,它的LFSE 绝对值等于多少?------------------------------------ ( )(A) 0 (B) 25000 cm -1 (C) 54000 cm -1 (D) 8000 cm -16014 四角方锥可认为是正八面体从z 方向拉长,且下端没有配体 L 的情况。

结构化学大纲一、课程性质及其设置目的与要求(一)课程性质和特点《结构化学》课程是我省高等教育自学考试化学教育专业的一门重要的基础理论课,其理论和实验方法已越来越广泛地被应用到化学各个学科中去。
通过该课程的学习,应考者应掌握微观物质运动的基本规律,获得原子、分子和晶体结构的基础理论、基本知识,理解物质结构与性能的关系,了解研究分子和晶体结构近代实验方法的基本原理,了解结构化学的现状、发展趋势及最新进展,加强对先行课程有关内容的理解,为后续课程和科学研究以及中学化学教学打下必要的基础。
(二)本课程的基本要求本课程内容分为八部分。
通过该课程的学习,应考者应对结构化学有一个全面和正确的认识。
具体要求如下:1、在量子力学基础知识的基础上,弄清原子、分子和晶体中电子运动的基本规律,了解Schrödinger方程得来的线索和用量子力学研究原子、分子结构的基本方法,理解波函数及波函数的各种图形表示,掌握原子光谱项的推求。
2、了解分子轨道理论的基本原理,理解化学键的本质,掌握双原子分子结构与性质间的关系,掌握双原子分子的振动和转动光谱的基本原理。
3、掌握分子的对称性和分子点群,了解分子对称性在研究分子结构中的作用。
4、了解杂化轨道理论,掌握一些常见的杂化轨道类型,了解休克尔分子轨道理论,理解分子图及其应用,理解离域p键的形成、类型和共轭效应。
5、了解用量子力学研究配合物结构的基本方法,掌握晶体场理论的基本原理及其应用。
6、掌握晶体周期性结构的特点及晶体的各种性质。
了解各类晶体结构的基本形式,理解X-ray衍射的基本原理及其应用。
(三)本课程与相关课程的关系《结构化学》是以量子力学理论为基础,联系无机化学、有机化学等大量实验事实讨论原子、分子化学键理论的一门学科。
学习本课程需具备高等数学、大学物理、线性代数、无机化学、有机化学等课程基础。
二、课程内容与考核目标第一章量子力学基础知识(一)课程内容本章简要介绍了量子力学产生的背景、量子力学基本原理及其简单应用。
《结构化学》课程大纲英文名称:Structural Chemistry 课程编号:407021030适用专业:化学本科学分数:4一、课程性质结构化学属于化学一级学科下的物理化学二级学科,在化学本科专业的培养计划中属于专业模块课程,是专业基础系列课程之一。
二、课程理念结构化学是化学的理论基础。
结构化学以量子力学基本原理为基础,主要任务是描述微观粒子的运动规律,揭示结构—性能之间的关系。
结构化学总结归纳出的许多重要的概念(如原子轨道和分子轨道)、规律(如对称性和对称原理)以及许多重要的实验手段(如衍射、光谱、能谱和磁共振)对化学学科及相关科学有重要的指导作用。
该课程对学生其它课程的理论知识学习和理解,以及科研素养的培养和提高有着至关重要的影响。
结构化学课程面向化学专业的学生。
结构化学课程所讲授的基本理论涵盖于各化学分支,是化学各相关专业学生应掌握的最基本、最重要的理论。
因此,这门课对化学教育专业的本科生培养都有重要意义。
针对我院化学专业三年级的学生开设。
学生已有《高等数学》、《大学物理》、《无机化学》、《分析化学》、《有机化学》、《物理化学》等化学以及数学、物理理论基础,而结构化学可以运用数学和物理方法,从理论的层面解释并讨论基础的化学知识。
因此,结构化学与《中级无机化学》、《中级有机化学》等课程关系密切。
通过本课程的教与学,使物质结构的理论与化学性质相结合,不仅使学生掌握结构的基本理论和基本知识,还能培养学生独立分析问题和解决问题的能力及严谨的科学作风,提高学生的化学专业素养,为将来从事化学方面研究及相关工作奠定良好的基础。
结构化学的学习对从事化学研究与化学教学都是必须的。
结构化学课程是大学本科化学各专业的重要主干基础课。
由于该课程涉及的面广,又比较抽象,要求学生具有较多的数理知识和较强的空间想象能力,该课程是大学阶段化学专业课程中最难学的课程之一,但该课程对培养学生逻辑思维和空间想象力有着至关重要的影响。