蛋白质不稳定性分解
- 格式:ppt
- 大小:684.50 KB
- 文档页数:53



分子生物学研究中的蛋白质质量控制在分子生物学研究领域中,蛋白质质量控制是一个至关重要的方面。
蛋白质是细胞中最基本的分子单元之一,它们在生产、运输和代谢等过程中都需要经过精细的调节和控制,以确保它们能够正常地发挥作用。
在这篇文章中,我们将探讨蛋白质质量控制的一些基本概念和方法,以及这些技术如何帮助人们更好地理解和利用蛋白质。
蛋白质合成与质量控制蛋白质合成始于生物学上的核糖体,它们通过读取mRNA序列来合成蛋白质链。
新合成的蛋白质链需要通过复杂的过程来正确折叠,并结合各种辅助蛋白和质量控制机制来确保其正确性。
如果在这个过程中出现了任何问题,那么这个蛋白质可能会被标记为不合适的,然后被分解掉,以免产生损害。
质量控制的工具包括分子伴侣和膜上蛋白。
分子伴侣作为蛋白折叠的助手。
它们可以促进正确折叠和预防错折、聚集和形成沉淀。
在蛋白质分解的过程中,膜上蛋白则起着关键的作用。
它们通过标记和识别质量不佳的蛋白质,以启动它们的分解。
这些标记通常以泛素等小分子为代表。
质谱技术在蛋白质质量控制中的作用质谱是一种分析化学技术,广泛应用于蛋白质质量控制领域。
它基于蛋白质的基本化学属性,如分子量、氨基酸组成、蛋白质的特定修饰、构象状态等方面进行测量和分析。
因此,质谱技术可以用来量化和监测蛋白质合成、折叠和分解等过程中的各种变化。
质谱技术的主要用途之一是在蛋白质质量控制中进行定量分析。
例如,我们可以使用质谱来测量不同蛋白质分子的质量,以评估它们的折叠状态和稳定性。
此外,我们还可以使用质谱技术来监测蛋白质分解和泛素化分解等过程中的不同蛋白质物质和代谢产物的生成。
这可以用来考察某些药物、病毒感染或其他生物学过程的影响。
动态质谱学近年来,动态质谱学也已经成为了研究领域中的重要分支。
该领域涉及到了蛋白质折叠和相互作用过程中的动态变化。
利用动态质谱学技术,科学家可以更好地了解蛋白质折叠、稳定性和泛素化分解等过程中蛋白质的中间状态和亚型。

科学故事:“N端规则”的发现细胞内的蛋白质从合成出来到被分解之间,往往有一定的“寿命”,而各种蛋白质之间的寿命更有很大的差异。
有的蛋白质一旦被翻译出来就不太会被分解,所以它的寿命甚至比合成它的细胞还长,有的蛋白质则非常不稳定,几乎是一合成出来就被分解掉了。
一般说来,组织细胞必要的结构蛋白寿命都比较长,而负责细胞特殊应变的调节蛋白,其寿命往往就很短。
但是细胞究竟透过哪一些机制来决定蛋白质的寿命,对科学家一直是一项重大的挑战。
直到20世纪80年代,MIT的Alexander Varshavsky终于摸索到了一些规律,称作N端规则。
也就是说,一般蛋白质在细胞内的分解速率,由其N端氨基酸的种类来决定。
它的发现过程十分曲折有趣,值得向大家介绍。
Varshavsky起初只是对泛素的功能有兴趣,有一次他获悉东京大学的Yamada得到一个有趣的温度敏感型细胞突变株,这种变种细胞在高于允许温度的条件下不会分裂。
而Yamda也发现,这个变种细胞主要的问题在于它无法将泛素连接到别的蛋白质上,原因是负责这个反应的酶发生了变异,在允许温度之上就失去了活性。
Varshavsky就想到利用这个变种细胞来探讨泛素和蛋白质分解的问题。
当时,许多科学家都认为,泛素是决定蛋白质寿命的一个重要因素。
根据这个理论,泛素会和那些要被消化的蛋白质结合,而使它们得以分解。
如果这个理论是对的,那么,Yamada发现的变种细胞在允许温度之上无法将泛素接到蛋白质上,在这样的条件下,变种细胞内的蛋白质将无法被分解。
Varshavsky做了一个简单的实验,将细胞放在允许温度之上培养,然后直接观察细胞里一些半衰期很短的蛋白质。
结果发现那些蛋白质在允许温度之上时都变得十分稳定。
这是第一个直接的证据显示,如果泛素不加到蛋白质上,那个蛋白质就不会被分解。
泛素通常是接在蛋白质的氨基酸残基侧链的氨基上。
但利用遗传工程的方法,可以把泛素接到一个蛋白质的N端,制造出单链的融合蛋白,然后直接比较这个蛋白质在接上泛素前后,被分解的情形如何,就可以帮助我们了解泛素在蛋白分解过程中扮演的角色。



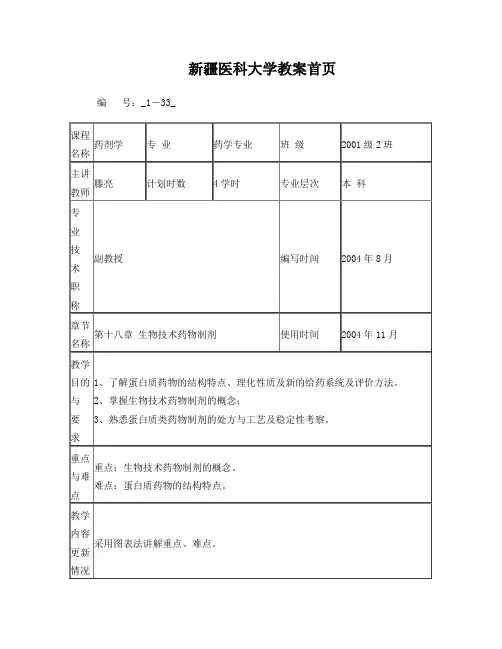
新疆医科大学教案首页编号:_1-33_第十八章生物技术药物制剂第一节概述一、生物技术的基本概念1、生物技术或称生物工程(biotechnology),是应用生物体(包括微生物、动物细胞,植物细胞)或其组成部分(细胞器和酶),在最适条件下,生产有价值的产物或进行有益过程的技术。
2、现代生物技术主要包括基因工程、细胞工程与酶工程、发酵工程(微生物工程)与生化工程。
二、生物技术药物的结构特点与理化性质(一)蛋白质的结构特点蛋白质的组成和一般结构(一、二、三、四级结构)(二)蛋白质的理化性质1.蛋白质的一般理化性质:旋光性、紫外吸收、蛋白质两性本质与电学性质(1)旋光性:蛋白质分子总体旋光性由构成氨基酸各个旋光度的总和决定,通常是右旋,它由螺旋结构引起。
蛋白质变性,螺旋结构松开,则其左旋性增大。
(2)紫外吸收:大部分蛋白质均含有带苯核的苯丙氨酸、酪氨酸与色氨酸,苯核在紫外280nm有最大吸收。
氨基酸在紫外230nm显示强吸收。
(3)蛋白质两性本质与电学性质:蛋白质除了肽链N-末端有自由的氨基和C-末端有自由的羧基外,在氨基酸的侧链上还有很多解离基团,如赖氨酸的-氨基,谷氨酸的γ羧基等。
这些基团在一定 pH条件下都能发生解离而带电。
因此蛋白质是两性电解质,在不同 pH条件下蛋白质会成为阳离子、阴离子或二性离子。
2.蛋白质的不稳定性(1)由于共价键引起的不稳定性:水解、氧化和消旋化,此外还有蛋白质的特有反应,即二硫键的断裂与交换(2)由非共价键引起的不稳定性:聚集(aggregation)、宏观沉淀、表面吸附与蛋白质变性(三)蛋白质类药物的评价方法:多种分析方法:液相色谱法、光谱法、电泳、生物活性测定与免疫测定第二节蛋白质类药物制剂的处方与工艺(注射剂型)一、蛋白质类药物的一般处方组成:一类为溶液型注射剂,另一类是冻干粉注射剂二、液体剂型中蛋白质类药物的稳定化:①改造其结构;②加入适宜辅料蛋白类药物的稳定剂:缓冲液、表面活性剂、糖和多元醇、盐类、聚乙二醇类、大分子化合物、组氨酸、甘氨酸、谷氨酸和赖氨酸的盐酸盐等、金属离子1.缓冲液因为蛋白质的物理化学稳定性与pH值有关,通常蛋白质的稳定pH值范围很窄,应采用适当的缓冲系统,以提高蛋白质在溶液中的稳定性。


体内蛋白质分解代谢的最终产物一、概述蛋白质是构成生物体的重要组成部分,它们参与到体内的许多重要生理活动中。
蛋白质分解代谢是蛋白质在体内被分解并代谢的过程,其最终产物对人体健康至关重要。
本文将介绍体内蛋白质分解代谢的最终产物及其对人体健康的影响。
二、蛋白质分解代谢的过程1. 蛋白质分解蛋白质在体内首先被水解酶分解成氨基酸,这是蛋白质分解代谢的第一步。
氨基酸是蛋白质的基本组成单元,其在体内具有多种重要生理功能。
2. 氨基酸代谢氨基酸在体内经过一系列酶促反应,被转化为其他物质,包括能量物质和合成物质。
其中重要的产物包括尿素、谷氨酸、丙酮酸等。
三、体内蛋白质分解代谢的最终产物1. 尿素尿素是氨基酸代谢的最终产物之一,它由肝脏合成,并通过肾脏排出体外。
尿素的主要作用是将体内产生的过量氨基酸转化为较为稳定的尿素,从而维持体内氮平衡。
2. 谷氨酸谷氨酸是氨基酸代谢的重要产物,它参与到体内许多代谢途径中,包括糖异生、丙酮酸循环等。
谷氨酸还是脑内的重要神经递质,对维持神经系统的正常功能至关重要。
3. 丙酮酸丙酮酸是氨基酸代谢的重要产物之一,它可用于肌肉运动时的能量供应,也可以通过丙酮酸循环转化为葡萄糖,参与到血糖的调节过程中。
四、体内蛋白质分解代谢产物对人体健康的影响1. 尿素及氮平衡尿素的产生和排泄对维持体内氮平衡起着重要作用,它能够帮助人体排出多余的氮负荷,维持血液中氨基酸的平衡。
如果氮平衡失调,可能导致氮中毒等健康问题。
2. 谷氨酸及神经系统功能谷氨酸是体内重要的神经递质之一,它参与到神经系统的正常功能中。
如果谷氨酸代谢失调,可能导致神经系统功能异常,出现头晕、记忆力下降等症状。
3. 丙酮酸及能量供应丙酮酸作为能量供应物质,如果其产生不足或过多,可能导致人体能量供应不足或代谢异常,从而影响体内代谢平衡。
五、结语体内蛋白质分解代谢的最终产物对人体健康有着重要影响,其平衡与否关系着人体的正常生理功能。
通过了解体内蛋白质分解代谢的最终产物及其影响,可以更好地维护人体健康。

蛋白纯化面试知识1. 背景介绍蛋白纯化是生物学研究中非常重要的一步,它是从复杂的混合物中分离和纯化特定蛋白质的过程。
蛋白纯化技术可用于生物制药、生物化学研究、结构生物学等领域。
在蛋白纯化面试中,考官通常会提问与蛋白纯化相关的知识,下面将介绍一些常见的面试问题和答案。
2. 常见面试问题及答案2.1 什么是蛋白纯化?蛋白纯化是指从复杂的混合物中分离和纯化特定蛋白质的过程。
它包括样品预处理、分离和纯化等步骤。
蛋白纯化的目的是获得高纯度的蛋白质,以便进行后续的实验和研究。
2.2 蛋白纯化的常用方法有哪些?蛋白纯化的常用方法包括:•亲和层析:利用蛋白质与亲和柱上的配体之间的特异性相互作用来实现纯化。
•凝胶过滤层析:根据蛋白质的分子量大小选择合适的凝胶,使较大分子的蛋白质无法进入凝胶孔隙而被分离。
•离子交换层析:利用蛋白质与离子交换柱上固定的离子之间的相互作用来实现纯化。
•凝胶电泳:利用电场对蛋白质进行分离,分离效果与蛋白质的电荷、分子量有关。
•透析:通过半透膜使目标蛋白质与其他小分子物质分离。
2.3 如何确定蛋白纯化的效果?确定蛋白纯化的效果通常需要进行以下几个方面的检测:•SDS-PAGE凝胶电泳:通过凝胶电泳分离蛋白质,观察蛋白质的相对分子质量和纯度。
•Western blotting:通过将蛋白质转移到膜上,并使用特异性抗体进行检测,进一步确认目标蛋白质的纯度。
•比浊法:利用蛋白质在紫外线下的吸光性来检测蛋白质的浓度。
•酶活性测定:通过检测目标蛋白质的酶活性来评估纯化效果。
2.4 在蛋白纯化过程中可能遇到的问题有哪些?在蛋白纯化过程中,可能会遇到以下问题:•低产量:蛋白质表达量较低,导致蛋白纯化的困难。
•杂质污染:混合物中存在其他蛋白质、核酸或小分子物质,影响目标蛋白质的纯化。
•蛋白质不稳定性:某些蛋白质容易失活或聚集,需要进行适当的条件优化。
•蛋白质结构问题:某些蛋白质存在复杂的结构,需要利用多步骤的纯化策略。
蛋白质低温失火-概述说明以及解释1.引言1.1 概述在食品加工和储存过程中,蛋白质的性质和稳定性是至关重要的。
随着科技的不断发展,人们对蛋白质在低温条件下的稳定性也越来越关注。
低温失火是指蛋白质在低温下出现的变性和降解现象,这会导致食品质量的下降,甚至影响人体健康。
本文将探讨低温对蛋白质的影响、蛋白质失火的表现及可能的原因,并提出一些预防措施和未来研究方向,以期为食品加工和储存提供更科学的指导。
文章结构部分描述了整篇文章的框架和各部分内容的主题。
在这篇关于蛋白质低温失火的长文中,文章结构如下:1. 引言1.1 概述1.2 文章结构1.3 目的2. 正文2.1 低温对蛋白质的影响2.2 蛋白质失火的表现2.3 可能的原因3. 结论3.1 总结低温失火的影响3.2 探讨预防措施3.3 展望未来研究方向文章结构部分的目的是让读者了解整篇文章的篇章分明,各部分内容的主题,并为后续阅读提供方向和线索。
文章1.3 目的部分的内容如下:在这篇文章中,我们的主要目的是探讨蛋白质在低温条件下失火的现象,并分析其可能的原因。
通过对低温对蛋白质的影响以及蛋白质失火的表现进行深入研究,我们希望能够更全面地了解这一现象,并提出相应的预防措施。
同时,我们还将探讨未来在这一领域的研究方向,为进一步探究蛋白质在低温条件下失火提供理论支持。
通过本文的分析,我们希望加深人们对蛋白质失火问题的认识,促进相关研究的发展,为保障蛋白质质量和安全性提供参考和建议。
2.正文2.1 低温对蛋白质的影响在低温环境下,蛋白质会遭受一系列的影响,其中最显著的是构象变化和活性丧失。
低温会导致蛋白质的分子结构发生改变,特别是在冰冻条件下,蛋白质分子中的水分会结晶化,造成蛋白质结构的破坏。
这种结构改变会使蛋白质的功能受到影响,包括其生物活性和功能性。
此外,低温还会影响蛋白质的溶解性和稳定性。
在低温条件下,蛋白质可能会发生聚集,形成聚集物或凝胶,造成蛋白质失去水溶性。
药品蛋白的稳定性:升级版摘要:1989年,manning,patel,和borchardt写了一篇关于蛋白稳定性的文章,这个文章大量的参考了以前的工作。
当时,重组蛋白治疗还处于初级阶段。
这篇综述总结了关于蛋白稳定性和剂型的进步。
另外讨论了当前已知的蛋白质化学和物理的不稳定性,部分章节还包括蛋白在水溶液和干粉状态下化学和物理的不稳定性。
使用化学改造和诱变提高稳定性及化学和物理的相互作用的不稳定性。
介绍:1989年,manning,patel和borchardt写了一篇综述总结了那时已知的蛋白药品的稳定性和稳定,这篇文章被引用了500次,二十世纪八十年代晚期,在美国市场仅有三种重组蛋白产品:orthoclone(okt-3),人胰岛素和tissueplasminogenactivator.。
如果一个包含血浆来源的产品,获准的生产的蛋白仅有十二个。
显然的,重组dna技术已经极大地改变了药品市场。
现在仅仅在美国市场以有近20种抗体产品和几乎150种以蛋白为基础的产品被普遍应用。
另外的,我们所知的关于蛋白稳定性和剂型已经急剧的增加。
本篇综述的目的是阐述过去20年中我们所了解的蛋白稳定性的进步。
除了更新原有的评论文章的部分,在1989年的文献中没有被讨论的主题在这篇文章中被讨论,例如发生在生物过程中的蛋白质化学和物理的不稳定性的相互关系,生物加工过程中冻干周期对蛋白质的稳定性影响,以及在维持蛋白质稳定性的过程中包装的重要性。
我们把蛋白不平衡分成两种:化学不稳定性和物理不稳定性。
化学不稳定性牵涉共价键的制备和脱落的过程,分解成代莱化学实体。
表中一中列举一个较为常用的化学降解过程。
恰好相反,蛋白质的物理不稳定性其化学成分并没发生改变,而是蛋白质物理状态的发生改变。
这包含变性,涌入,结晶,溶解(见到表中1)。
结晶被用在这里就是指不溶性而不是不溶性聚集体构成。
我们关于所有蛋白降解途径的知识有很大提高比20年前。
因此,这篇文章的重点是自从1989年以来取得的进步。
蛋白不稳定指数
蛋白不稳定指数是衡量蛋白质稳定性的一种指标。
蛋白质是生命体内的重要组成部分,其稳定性对生命活动和代谢过程至关重要。
蛋白质不稳定性可能导致蛋白质失去功能、变性或降解,进而影响生命活动的正常进行。
蛋白不稳定指数是指在一定条件下,蛋白质发生变性的浓度或温度,是衡量蛋白质稳定性的重要参数之一。
蛋白不稳定指数可以通过实验手段测定,常用的方法有圆二色谱、荧光光谱、差示扫描量热法等。
通过测定蛋白不稳定指数,可以评估蛋白质的稳定性,为药物设计、酶工程等领域提供重要参考。
蛋白不稳定指数的研究涉及蛋白质的结构、构象、动力学等方面,是生命科学、药学等领域的热点研究方向。
未来,随着技术的发展和研究的深入,蛋白不稳定指数的应用将会越来越广泛,为生命科学和医药领域带来更多的突破和进展。
- 1 -。