高等有机化学 第9章_氧化-还原反应
- 格式:ppt
- 大小:1.38 MB
- 文档页数:29

有机中的氧化反应和还原反应在有机化学的世界里,氧化反应和还原反应就像一对形影不离的好伙伴,走到哪里都离不开彼此。
想象一下,氧化反应就像是一个热情的派对小王子,时刻准备着把电子送出去,而还原反应则是那个温柔的邻居,乐于接受这些电子。
二者之间的互动,简直就是化学界的“绝配”,没有他们的相互作用,有机化合物可就没那么有趣了!1. 氧化反应1.1 定义简单来说,氧化反应就是分子失去电子的过程。
听起来很复杂对吧?其实就像生活中你把心爱的玩具借给朋友,心里多少会有点不舍。
分子失去的电子就像借走的玩具,虽说是暂时的,但一想到要等朋友还回来,心里总有点不踏实。
这个过程通常伴随着氧的加入,想想看,氧气就像一个不请自来的客人,想要参与进来。
1.2 例子让我们来看个简单的例子:酒精氧化成醛。
这就像一个小年轻从青春期过渡到成熟期,变得越来越稳重。
酒精在这个过程中失去了电子,就像放下了手里的玩具,迎接新生活。
还有,咱们熟悉的苹果氧化变色,也是氧化反应的一种表现。
没多久,原本光鲜亮丽的苹果,竟然慢慢变成了暗淡的颜色,唉,这种心痛谁能理解呢?2. 还原反应2.1 定义说到还原反应,就是分子获得电子的过程,听上去像是“得”了什么大礼包!生活中,我们常常看到有人找到真爱,心里那个乐啊,简直像中彩票一样。
而在化学中,分子通过获得电子,也感受到了一种“幸福”,这就是还原反应的魅力所在。
2.2 例子比如说,二氧化碳在植物光合作用中被还原成葡萄糖,哇,听着就让人感到充满生机!这就像植物在接受阳光的“祝福”,获得了能量,像是喝了能量饮料一样,瞬间充满活力。
再比如,铁锈的形成就是氧化反应,而如果我们用还原剂去处理生锈的铁,就能看到铁重新焕发光泽,简直像个化妆师给铁打理了一番,重回青春的感觉!3. 氧化还原反应的日常应用3.1 生活中的例子在我们的日常生活中,氧化还原反应无处不在。
比如,铁的生锈,水果的氧化,甚至是我们体内的呼吸反应,都是这对好伙伴在默默工作。

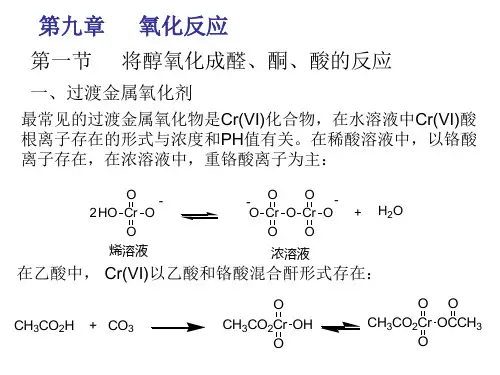
有机化学氧化还原反应总结一、氧化反应:有机物分子中加入O 原子或脱去H 原子的反应。
常见的氧化反应: ①醇的氧化 醇→醛 ②醛的氧化 醛→酸③有机物的燃烧氧化、与酸性高锰酸钾溶液的强氧化剂氧化。
④醛类及其含醛基的有机物与新制Cu (OH )2悬浊液、银氨溶液的反应常见的氧化剂有氧气、酸性高锰酸钾、二氧化锰、臭氧、银氨溶液和新制Cu (OH )2悬浊液a. 能被酸性KMnO 4氧化的:烯、炔、二烯、油脂(含C==C 的)苯的同系物、酚、醛、葡萄糖等。
b. 能被银氨溶液或新制备的Cu(OH)2悬浊液氧化的:醛类、甲酸及甲酸酯、葡萄糖、麦芽糖。
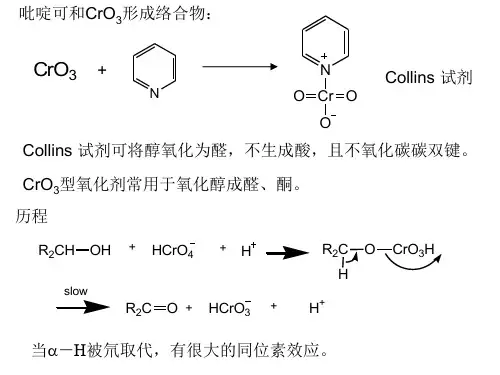
1.高锰酸钾氧化a.在稀、冷KMnO4(中性或碱性)溶液中生成邻二醇b.在酸性高锰酸钾溶液中,继续氧化,双键位置发生断裂, 得到酮和羧酸的混合物,如:炔烃与氧化剂(KMnO4或O3)反应,产物均为羧酸或CO2 2.臭氧化反应: CHR=CR 'R "+O3→RCH=O+R’C=OR”3.醛的氧化:由于醛的羰基碳上有一个氢原子,所以醛比酮容易氧化,使用弱的氧化剂都能使醛氧化。
利用两者氧化性能的区别,可以很迅速的鉴别醛或酮:a 费林试剂(Fehling):以酒石酸盐为络合剂的碱性氢氧化铜溶液(绿色),能与醛作用,铜被还原成红色的氧化亚铜沉淀。
坎尼扎罗(Cannizzaro )反应不含 氢原子的醛在浓碱存在下可以发生歧化反应,即两个分子醛相互作用,其中一分子醛还原成醇,一个氧化成酸:CH 3CH 2C=CHCH3CH3CH 3CH2CCH 3O CH3COOHRCHO Ag(NH 3)2RCOONH 4O H 2NH 3HCHOHCOONa HCH 2OH二、还原反应:有机物分子中加入H 原子或脱去O 原子的反应常见的还原反应有:烯、炔、苯及其同系物、醛、酮、酚、油脂等的催化加氢。
常见的还原剂有氢气、氢化铝锂(LiAlH 4)和硼氢化钠(NaBH 4)等。
Lindlar 催化剂—附在碳酸钙(或BaSO4)上的钯并用醋酸铅处理。


《有机化学反应类型》氧化与还原反应有机化学反应类型:氧化与还原反应在有机化学的广阔领域中,氧化与还原反应是一类极为重要的反应类型。
它们就像是有机化学世界中的“变脸大师”,通过改变有机物分子中的原子价态和化学键,实现物质的转化和新化合物的生成。
理解这些反应,对于深入研究有机化学的奥秘、开发新的有机合成方法以及解决实际应用中的问题都具有至关重要的意义。
让我们先来聊聊氧化反应。
氧化反应,简单来说,就是有机物分子中某个原子失去电子或者增加了氧原子,导致其氧化态升高的过程。
这一过程常常伴随着分子结构和性质的显著变化。
比如说,醇类物质可以被氧化为醛或酮。
以乙醇为例,在适当的氧化剂作用下,乙醇可以被氧化为乙醛。
在这个过程中,乙醇分子中的羟基(OH)失去了氢原子,氧原子的氧化态升高,从而实现了氧化反应。
这个反应在工业上有着广泛的应用,比如用于生产乙醛这种重要的有机化工原料。
再比如,醛类可以进一步被氧化为羧酸。
乙醛在更强的氧化剂作用下,就能够被氧化为乙酸。
这一系列的氧化反应在有机合成中是构建复杂分子结构的重要手段。
那么,这些氧化反应是如何发生的呢?这通常涉及到氧化剂的作用。
常见的氧化剂有高锰酸钾、重铬酸钾等。
这些氧化剂具有较强的氧化性,能够从有机物分子中夺取电子或者促使其增加氧原子。
说完了氧化反应,咱们再来瞧瞧还原反应。
还原反应与氧化反应正好相反,是有机物分子中某个原子获得电子或者减少了氧原子,导致其氧化态降低的过程。
一个典型的例子是硝基化合物的还原。
硝基苯在还原剂的作用下,可以被还原为苯胺。
在这个反应中,硝基(NO₂)中的氮原子获得了电子,氧原子被去除,从而实现了还原反应。
苯胺是一种重要的有机化工原料和中间体,广泛应用于染料、医药等领域。
另外,酮和醛也可以被还原为醇。
比如,丙酮在还原剂的作用下,可以被还原为异丙醇。
在有机化学中,实现还原反应的常用还原剂有氢气、金属钠与醇的混合物等。
这些还原剂能够提供电子,使有机物分子中的氧化态降低。

有机化学反应方程式总结氧化还原反应氧化还原反应是有机化学中最常见的一类反应,也是有机合成和有机化工中重要的反应类型之一。
本文将总结常见的有机化学反应方程式,包括氧化反应和还原反应。
一、氧化反应1. 高价态氧化反应氧可以以不同的氧化态参与反应,其中最常见的是氧气(O2)和过氧化氢(H2O2)。
以下是一些常见的高价态氧化反应方程式:1) 醇氧化反应:醇+ [O] → 醛 + H2O2) 全氧氧化反应:碳氢化合物+ O2 → CO2 + H2O3) 羧酸氧化反应:羧酸+ O2 → 一般产物 + H2O2. 过氧化物氧化反应过氧化物是一类含有氧氧单键(O-O)的化合物,可以在氧化反应中作为氧化剂。
以下是一些常见的过氧化物氧化反应方程式:1) 过氧化氢氧化反应:过氧化氢 + 2H+ + 2e- → 2H2O2) 过氧化苯酚氧化反应:过氧化苯酚+ [O] → 苯醌 + H2O3) 过氧化乙酸氧化反应:过氧化乙酸+ [O] → 乙酸 + CO2 + H2O二、还原反应还原反应是氧化反应的逆过程,即被氧化物失去氧原子或获得氢原子。
以下是一些常见的有机化学还原反应方程式:1. 还原脱氧反应还原脱氧反应是有机化合物中含氧原子的官能团被还原为碳-碳键。
以下是一些常见的还原脱氧反应方程式:1) 脂肪酸还原脱氧反应:脂肪酸+ LiAlH4 → 醇 + Al(OH)32) 酮还原脱氧反应:酮+ NaBH4 → 醇3) 羧酸还原脱氧反应:羧酸+ LiAlH4 → 醇 + Al(OH)32. 氢化还原反应氢化还原反应是有机化合物中含氧或含氮官能团被还原为相应的醇或胺。
以下是一些常见的氢化还原反应方程式:1) 酮氢化反应:酮+ NaBH4 → 醇2) 醛氢化反应:醛+ NaBH4 → 醇3) 羧酸酯氢化反应:羧酸酯+ LiAlH4 → 醇结论:本文总结了有机化学中的氧化还原反应方程式,包括氧化反应和还原反应。
通过对这些反应方程式的了解,我们可以更好地理解氧化还原反应的原理和应用,为有机化学合成和化工工艺的设计提供指导。


有机化学中的氧化与还原反应有机化学是研究碳化合物及其他含有碳元素的化合物的一门学科。
在有机化学中,氧化与还原反应是常见且重要的反应类型。
氧化反应指的是有机化合物失去电子,增加氧原子或减少氢原子的反应;而还原反应则相反,是指有机化合物获得电子,减少氧原子或增加氢原子的反应。
这篇文章将介绍有机化学中常见的氧化与还原反应,并探讨其在有机合成中的应用。
一、氧化反应氧化反应是有机化学中一类重要的反应,通常需要氧气或氧化剂的参与。
在氧化反应中,有机化合物失去电子,氧原子的数目增加,或者氢原子的数目减少。
氧化反应可以将碳原子氧化为碳氧化物,或是将碳氧化物中的碳原子进一步氧化为羧基或酮基。
1. 酒精的氧化:酒精是一类常见的有机化合物,可以发生氧化反应。
例如,乙醇(C2H5OH)可以被氧化为乙醛(CH3CHO),再进一步氧化为乙酸(CH3COOH)。
这些氧化反应可以使用酒精的氧化剂如酸性高锰酸钾(KMnO4)或酸性二氧化铬(CrO3)来实现。
2. 烯烃的氧化:烯烃是一类具有双键结构的有机化合物,也可以发生氧化反应。
双键上的碳原子可以被氧化为羧基。
例如,丙烯(CH2=CHCH3)经过氧化反应后可以生成丙酸(CH3CH2COOH)。
3. 苯环的氧化:苯环化合物也可以发生氧化反应。
例如,苯(C6H6)在氧气和催化剂的作用下可以被氧化为苯酚(C6H5OH)。
二、还原反应还原反应是有机化学中另一种重要的反应类型,通常需要还原剂的参与。
在还原反应中,有机化合物获得电子,氧原子的数目减少,或者氢原子的数目增加。
1. 醛和酮的还原:醛和酮是一类含有羰基的有机化合物,可以通过还原反应转化为相应的醇。
还原醛和酮的常用还原剂包括硼氢化钠(NaBH4)和氢气(H2)。
2. 羧酸的还原:羧酸是一类含有羧基的有机化合物,可以通过还原反应转化为醛或酮。
还原羧酸的常用还原剂为氢气和铈铵盐(Ce(NH4)2(NO3)6)。
3. 烯烃的还原:烯烃可以经过还原反应转化为烷烃。

有机化学的氧化还原反应氧化还原反应是有机化学中一类重要的反应类型,它涉及电子的转移和氧化态的变化。
研究有机化学的氧化还原反应可以帮助我们理解和应用这些反应,进一步拓宽有机化学的领域。
一、氧化还原反应的概念及基本原理氧化还原反应是指化学物质中电子的转移过程。
在有机化学中,氧化还原反应通常涉及有机物中氢原子或碳原子的氧化和合成,以及另一物种中氧原子或其他电子受体的还原和分解。
在氧化还原反应中,氧化态的改变是关键。
氧化态是描述原子或离子所带电荷数的量子数,常通过带电符号(如+2,-1)表示。
氧化反应中,原子失去电子,氧化态增加,被氧化性质称为氧化剂;还原反应中,原子获得电子,氧化态减少,具有还原性质的称为还原剂。
二、氧化还原反应的分类1. 直接氧化还原反应:直接发生在有机分子中的氧化还原反应,常被称为有机氧化还原反应。
例如,醇的氧化生成醛、酮;烷烃的氧化生成醇等。
2. 间接氧化还原反应:间接氧化还原反应中,氧化还原反应不是直接发生在有机分子中,而是通过其他物质媒介或催化剂参与。
例如,环境中有机物的氧化反应常由过氧化物、高锰酸钾等作为氧化剂使用。
3. 氧化还原的催化反应:在有机化学中,催化剂常常引发氧化还原反应的进行,同时,在反应中不消耗的被称为氧化剂、还原剂。
三、氧化还原反应的机理1. 氧化反应的机理:氧化反应中,常见的机理有氢原子转移机理、氧原子转移机理和重氧化合物分解机理等。
例如,在醇的氧化反应中,氧化剂接收醇分子中的氢原子,形成醛,同时将氢离子还给反应液中的还原剂,还原剂再通过继续供氧的方式转变为氧化剂。
2. 还原反应的机理:还原反应通常涉及电子的转移过程。
在还原反应中,电子供给反应物,将氧化剂中的氧加到反应物中,还原剂同时接收氧化剂中的氧离子。
例如,酮的还原反应中,酮分子接收还原剂中的氧离子,并同时将氢离子转移到还原剂上。
四、有机化学的氧化还原反应的应用1. 生物化学中的氧化还原反应:生物体内的许多重要代谢反应,如呼吸作用和光合作用等,都涉及氧化还原反应。

有机化学基础知识点整理氧化还原反应与氧化剂还原剂氧化还原反应与氧化剂还原剂氧化还原反应是化学反应中的一个重要概念,它涉及到物质的电子转移过程。
在氧化还原反应中,化学物质可以被氧化剂接受电子而发生氧化,也可以被还原剂给予电子而发生还原。
本文将介绍氧化还原反应的基本概念以及常见的氧化剂和还原剂。
一、氧化还原反应概念氧化还原反应是指在化学反应过程中,化学物质失去电子的过程被称为氧化,而化学物质获得电子的过程被称为还原。
氧化还原反应总是在相互关联的基础上进行的,即只要有一种物质发生了氧化反应,就一定有另一种物质同时发生了还原反应。
氧化还原反应通常涉及到电子的转移。
在反应中,原子或离子失去电子的过程被称为氧化,而得到电子的过程被称为还原。
氧化剂在反应中接受电子,因此它自身被还原;还原剂在反应中失去电子,因此它自身被氧化。
氧化还原反应可以用化学方程式来表示,一般形式为:氧化剂 + 还原剂→ 氧化物 + 还原物。
二、常见的氧化剂氧化剂是指在氧化还原反应中能够接受电子的物质。
常见的氧化剂包括:1. 氧气(O2):氧气是一种强氧化剂,它可以与许多物质发生反应。
例如,当铁与氧气反应时,产生的化合物就是铁的氧化物。
2. 高锰酸钾(KMnO4):高锰酸钾是一种常用的氧化剂,它可以将其他物质氧化为高氧化态。
例如,高锰酸钾可以将二氧化硫(SO2)氧化为三氧化硫(SO3)。
3. 高氯酸钠(NaClO):高氯酸钠是一种常用的氧化剂,它可以与其他物质发生氧化反应。
例如,高氯酸钠可以将亚硫酸钠(Na2SO3)氧化为硫酸钠(Na2SO4)。
三、常见的还原剂还原剂是氧化还原反应中能够给予电子的物质。
常见的还原剂包括:1. 硫酸亚铁(FeSO4):硫酸亚铁是一种常用的还原剂,它可以给予其他物质电子。
例如,硫酸亚铁可以将硝酸银(AgNO3)还原为银(Ag)。
2. 亚硫酸(H2SO3):亚硫酸是一种常用的还原剂,它可以给予其他物质电子。
例如,亚硫酸可以将高氯酸钠(NaClO)还原为氯化钠(NaCl)。
有机化学基础知识点整理氧化还原反应的基本概念与应用氧化还原反应的基本概念与应用氧化还原反应是化学中一类重要的反应类型,涉及到电子的转移与元素的氧化态变化。
在有机化学中,氧化还原反应具有广泛的应用,可以用于合成有机化合物、分析化学等领域。
本文将对氧化还原反应的基本概念和一些应用进行整理和探讨。
一、氧化还原反应的基本概念1. 氧化与还原在氧化还原反应中,氧化指的是物质失去电子或增加氧原子,还原指的是物质获得电子或减少氧原子。
氧化和还原是相互依存的过程,发生氧化必有还原,发生还原必有氧化。
2. 氧化态与电子转移氧化还原反应中,物质的氧化态发生变化,其中一部分物质的氧化态增加,称为被氧化剂;另一部分物质的氧化态减少,称为还原剂。
氧化还原反应中的电子转移是核心过程,被氧化剂接受电子,被还原剂失去电子。
3. 氧化还原反应的例子氧化还原反应的例子包括金属腐蚀、燃烧反应、电池反应等。
例如,金属与氧气反应产生金属氧化物即为氧化反应;还原剂还原过氧化氢为水和氧气的反应即为还原反应。
二、氧化还原反应的应用1. 有机合成在有机合成中,氧化还原反应常被用于构建碳-碳、碳-氧和碳-氮键等重要化学键的形成。
例如,醇的氧化可以得到醛、酮或羧酸;醛的还原可以生成醇;氧化剂可以将脂肪酸氧化成酮体等。
通过氧化还原反应,可以实现有机化合物的结构改变和功能增强,为有机合成提供了重要的手段。
2. 分析化学氧化还原反应在分析化学中具有广泛的应用。
通过氧化还原反应,可以确定物质的氧化态和还原态,进而用于分析物质的含氧量、测定物质的浓度等。
例如,氧化还原滴定常用于测定氧化性溶液中还原剂的浓度,电化学分析方法也常基于氧化还原反应进行分析。
3. 电池与储能技术氧化还原反应是电池中能量转换的基础。
电池的工作原理就是在正极发生氧化反应,正极释放出电子;在负极发生还原反应,负极接受电子。
通过引导电子的流动,在电池中产生电能。
氧化还原反应还被广泛应用于储能技术中,如锂离子电池、燃料电池等。
高中化学中“氧化-还原反应”的教学氧化-还原反应是高中化学中重要的概念之一,其在化学、生物学、环境科学等领域都有广泛的应用。
本文将从氧化-还原反应的定义、氧化剂和还原剂、氧化-还原号、氧化态和还原态等方面进行介绍,以帮助学生深入了解该概念。
一、氧化-还原反应的定义氧化-还原反应是指物质间转移电子的反应,其中一种物质失去电子被氧化,另一种物质接受电子被还原。
因此,氧化-还原反应也被称为电子转移反应或红ox反应。
在氧化-还原反应中,失去电子的物质称为还原剂,接受电子的物质称为氧化剂。
二、氧化剂和还原剂氧化剂是指在氧化-还原反应中接受电子的物质。
氧化剂通常具有较高的电子亲和力和电子的吸引能力,能够吸收他人的电子。
常见的氧化剂包括氧气、二氧化氯、过氧化氢等。
例如,在2H2+O2=2H2O的反应中,氧气就是氧化剂,它接受了氢原子释放的电子。
还原剂是指在氧化-还原反应中失去电子的物质。
还原剂通常比较容易失去电子,它们能够将自身的电子送到其他原子或离子中。
常见的还原剂包括金属、重氢、氢气等。
例如,在CuO+C=Cu+CO的反应中,C就是还原剂,它失去了一些电子把它们给了Cu离子。
三、氧化-还原号氧化-还原号是衡量物质是否氧化或还原的标志。
物质在参与氧化-还原反应时,其氧化号可能发生改变,也可能不发生改变。
通过对化学方程式中原子的氧化状态的计算,可以计算出反应前后物质的氧化还原号差值。
例如,在2H2+O2=2H2O的反应中,氧气的氧化号从0降至-2,说明氧气被还原了;而氢气的氧化号从0升至+1,说明氢气被氧化了。
因此,氧化-还原反应后氧气的氧化还原号差值为-2,氢气的氧化还原号差值为+1。
氧化态是反应物或产物中元素的化学价或电荷状态,其反映了元素电子的分布。
在化学反应中,元素的氧化态可能发生改变,可通过氧化号的计算进行确定。
还原态是指化学物质中离子或原子失去电子后的新状态。
化学反应中,元素的还原态通常指元素从反应前的高氧化级向低氧化级变化的程度。