无机化学:第九章 氧化还原反应与电化学基础解析
- 格式:docx
- 大小:610.99 KB
- 文档页数:17





《无机化学》电子教案第一章:绪论1.1 课程介绍了解无机化学的定义、范围和重要性了解无机化学的发展历程和现状了解无机化学与其他学科的联系1.2 基本概念物质、元素、化合物、离子、分子等基本概念原子结构、电子排布、离子键、共价键等基本概念1.3 化学方程式化学方程式的表示方法和平衡原理化学反应的类型和特点第二章:原子结构与元素周期律2.1 原子结构原子核的结构和组成电子云和电子轨道原子的大小和质量2.2 元素周期律元素周期表的排列原理和结构主族元素、过渡元素和稀有气体元素的特点元素周期律的应用2.3 化学键离子键的形成和特点共价键的形成和特点金属键的形成和特点第三章:氧化还原反应3.1 氧化还原反应的基本概念氧化还原反应的定义和特点氧化剂、还原剂、氧化数等基本概念3.2 电子转移和电荷守恒电子转移的类型和特点电荷守恒定律的应用3.3 氧化还原反应的平衡和动力学氧化还原反应的平衡常数和影响因素氧化还原反应的动力学原理和方法第四章:溶液与离子反应4.1 溶液的基本概念溶液的定义和分类溶剂的选择和溶解能力4.2 离子反应的基本概念离子反应的定义和特点离子反应的类型和规律4.3 离子反应的平衡和动力学离子反应的平衡常数和影响因素离子反应的动力学原理和方法第五章:化学键与晶体结构5.1 化学键的类型和特点离子键的形成和特点共价键的形成和特点金属键的形成和特点5.2 晶体结构的基本概念晶体的定义和分类晶格和晶胞的结构5.3 晶体结构的类型和特点离子晶体的结构特点和性质共价晶体的结构特点和性质金属晶体的结构特点和性质第六章:有机化学基础6.1 有机化合物的基本概念有机化合物的定义和特点有机化合物的命名规则6.2 有机化合物的结构碳原子的四价键特性有机化合物的立体化学6.3 有机化合物的性质有机化合物的物理性质有机化合物的化学性质第七章:有机化学反应7.1 有机化合物的合成反应加成反应、消除反应、取代反应等基本反应类型有机合成策略和催化方法7.2 有机化合物的分解反应热分解、光分解、氧化分解等反应类型有机化合物的稳定性7.3 有机化合物的转化反应醇、醚、酮等官能团的转化反应芳香族化合物的反应第八章:分析化学基础8.1 分析化学的基本概念分析化学的目标和任务分析化学的方法和分类8.2 定量分析方法滴定分析、原子吸收光谱法、质谱法等数据处理和误差分析8.3 定性分析方法光谱分析、色谱分析、电化学分析等定性分析的步骤和技巧第九章:物理化学基础9.1 热力学基本概念系统、状态、过程等基本概念能量、功、热量等基本物理量9.2 热力学定律热力学第一定律和第二定律熵和自由能的概念9.3 动力学基本概念反应速率和平衡常数化学动力学的级数和机理第十章:化学实验技能10.1 实验基本操作实验仪器的使用和维护实验安全常识和事故处理10.2 实验方案的设计与实施实验目的和步骤的制定实验数据的记录和分析实验报告的结构和内容实验结果的图表展示和讨论重点和难点解析重点环节1:原子结构与元素周期律原子结构的理解和电子轨道的概念是理解后续化学反应的基础。


![无机化学 第9章 氧化还原反应及电化学[1]](https://uimg.taocdn.com/a428e80f79563c1ec5da719d.webp)


第10章 氧化还原反应§10-1 氧化还原反应的基本概念如果我们从有无电子得失和转移(中学化学:化合价升降)的观点,可以将无机化学反应分为两大类:⑴非氧化还原反应在反应的过程中参加反应的物质在反应前后无电子的得失和化合价的变化。
例如,酸碱反应、沉沉反应等即是:AgNO 3+NaCl=AgCl ↓+NaNO 3在反应的过程中只是离子间交换伴侣,而并无电子的得失;⑵氧化还原反应在反应的过程中,参加反应的物质或被氧化,即在化学反应中某一物质失去电子(化合价升高)的变化;或被还原,即在化学反应中某一物质得到电子(化合价降低)的变化。
氧化还原反应就是在化学反应中电子从一个原子或离子转移到另一个原子或离子的过程。
例如:2e┌───┐Zn(s) + Cu 2+(aq) = Zn 2+(aq) + Cu(s)↓还原剂 氧化剂特征:(1)有电子的得失或转移(有化合价的变化)。
(2)同时发生于同一体系。
(3)得失或转移电子的总数必然相等(化合价的升高和降低的总数相等)。
10-1-1 氧化数氧化数是在中学化学的化合价基础上引入的新的概念。
元素氧化数的变化是划分氧化还原反应和非氧化还原反应的主要依据,也是定义氧化剂、还原剂和配平氧化还原方程式不可缺少的概念。
6=1-1-1 氧化数的概念及计算方法氧化数的定义:氧化数的概念是格拉斯通1948年首先提出的,19100国际纯化学和应用化学会议(IUPAC)对氧化数定义如下:氧化数(氧化值)是某元素一个原子的形式电荷数,这种电荷数是由假设把每个键中的电子指定给电负性更大的原子而求得的。
显然,按照定义,在化合物中电负性更大的元素的原子的氧化数应为负值。
氧化数的确定规则:⑴单质中元素的氧化数皆为零。
如O 2、N 2,白磷(P 4) 分子中的四面体由4个P-P 键构成,但因是由同种原子构成,元素的电负性相同,电子对不偏移,所以P 4中的P 的氧化数为零。
⑵在简单离子(单原子离子)中,离子的电荷数即其氧化数。
无机化学基本理论概述无机化学是研究无机物质的组成、性质和变化规律的科学。
它是化学的重要分支之一,对于人类的生产与生活具有重要意义。
在无机化学中,我们会涉及到一系列基本的理论与概念,本文将对这些基本理论进行概述。
一、物质的基本组成所有无机物质都是由元素构成的,而元素是构成物质的基本单位。
元素由原子组成,每个元素具有不同的原子结构和化学性质。
化学元素根据元素周期表的分类,可分为金属元素、非金属元素和过渡金属元素等不同类别。
二、化学键与分子结构无机化学中的化学键是指原子之间由电子共享或转移形成的连接。
最常见的化学键是共价键、离子键和金属键。
共价键是通过电子的共享形成的,离子键是通过正、负电荷之间的吸引形成的,金属键是由金属离子通过自由电子形成的。
在一种物质中,不同原子间的连接方式决定了其分子结构及其性质。
三、包络理论与晶体结构包络理论描述了配位化合物中金属离子与配体之间的化学键形成过程。
配位化合物中的金属离子能够形成不同数量的化学键,形成具有不同几何结构的配合物。
晶体结构是指固体物质中原子、离子或分子的有序排列方式。
通过晶体结构的研究,我们可以了解物质的性质及其在实际应用中的作用。
四、酸碱理论与溶液的性质酸碱理论是无机化学中的基本理论之一。
传统的酸碱理论是指布朗酸碱理论,即酸是能够给出H+离子的物质,碱是能够给出OH-离子的物质。
溶液中酸碱的中和反应会影响溶液的pH值,从而改变溶液的性质,例如导电性、颜色变化等。
五、氧化还原反应及电化学氧化还原反应是无机化学中的核心概念之一。
氧化是指物质失去电子,还原是指物质获取电子。
在氧化还原反应中,发生了电子的转移,因此也被称为电子转移反应。
电化学就是研究氧化还原反应及其与电能之间的相互转化关系的学科。
六、配位化学与配位化合物的性质配位化学是研究过渡金属离子与配体之间相互作用的科学。
在配位化学中,我们将阐述配合物的合成、稳定性、电子结构及其在催化、荧光等方面的应用。
第九章氧化还原反应和电化学基础一、氧化还原反应方程式的配平1、元素的氧化数(氧化值)(中学:化合价)❖定义:氧化数是某一个元素的荷电数,这种荷电数由假设把每个键中的电子数指定给电负性更大的原子而求得。
❖本质:a、离子化合物中,即正、负离子所带的电荷数;b、极性化合物中,即元素的一个原子提供参与共价键的电子数,其中电负性小,共用电子对离得较远的元素为正氧化数,电负性大、共用电子以离得较近的元素为负氧化数。
『①单质的氧化数为0-1;②在配合物中,当自由基或原子团作为配体时,其氧化数均看作 1;2❖定义:凡有电子得失或共用电子对偏移发生的反应。
氧化——失去电子或共用电子对偏离的变化,相应的物质称为“还原剂”;还原——得到电子或共用电子对接近的变化,相应的物质称为“氧化剂”。
❖氧化剂还原剂——氧化还原反应中,失去电子、氧化数升高的物质(发生氧化反应)因此,凡元素氧化数发生变化的过程,就是氧化还原反应!3、氧化还原反应方程式的配平方法与应用(一)氧化数法:适用于任何氧化还原反应❖依据:还原剂氧化数的升高总值 = 氧化剂氧化数降低总值例1:KMnO4 + FeSO4 + H2SO4 ==①根据反应事实,写出反应产物,注意介质酸碱性:KMnO4 + FeSO4 + H2SO4==MnSO4 +Fe2(SO4)3 + K2SO4 + H2O②调整计量系数,使氧化数升高值 = 降低值:+7 +2 +2 +3KMnO4 + 5 FeSO4 + H2SO4==MnSO4 + 5/2 Fe2(SO4)3 + K2SO4 + H2O③若出现分数,可调整为最小正整数:2 KMnO4 +10 FeSO4 + H2SO4==2 MnSO4 + 5 Fe2(SO4)3 + K2SO4 + H2O法2:配平各元素原子数(观察法)——先配平非H、O原子,后配平H、O原子。
①配平K+、SO42-数目 SO42-:左11,应+7;右182 KMnO4 + 10 FeSO4 + 8 H2SO4 ==2 MnSO4 + 5 Fe2(SO4)3 + K2SO4 + H2O②配平H+数目 H+:左2,应 8 H2O2 KMnO4 +10 FeSO4 + 8 H2SO4==2 MnSO4 +5 Fe2(SO4)3 + K2SO4 + 8 H2O③配平(或核对)O原子数目:已平衡。
小结:氧化数法配平氧化还原反应方程式的步骤(二)离子—电子法(半反应法):只适用于发生在水溶液中的氧化还原反应一个氧化还原反应是由两个半反应组成的,一个是还原剂发生的氧化反应,另一个则是氧化剂发生的还原反应。
在每个半反应中,又都由同种元素不同氧化数的两种物质构成,氧化数高的物质叫做氧化型物质,氧化数低的称为还原型物质。
这种由同种元素的氧化型与其对应的还原型物质所构成的整体叫做氧化还原电对,简称电对。
常记作氧化型/还原型(Ox/Red)。
如Zn2+/Zn。
❖注意:氧化还原电对是相对的,由参加反应的两电对氧化还原能力的相对强弱而定。
❖若在氧化还原反应过程中有H+,OH—,H2O参与,或伴有沉淀反应、配位反应,在半反应式中也要表现出来。
例2: MnO4—+ Fe2+ + H+→ Mn2+ + Fe3+ + H2O①把反应分为氧化反应,还原反应两个“半反应”(“电极反应”):MnO4—+ 8 H+ + 5e—→ Mn2+ + 4 H2O (还原反应)Fe2+→ Fe3+ + e—(氧化反应)②调整两个“半反应”的计量系数,使得电子总数 = 失电子总数.5 e 和 e 的计量系数最小公倍数是5 :MnO4—+ 8 H+ + 5e—→ Mn2+ + 4 H2O (还原反应)5 × (Fe2+→ Fe3+ + e— ) (氧化反应)③合并上述2个“半反应”:MnO4—+ 5 Fe2+ + 8 H+ = Mn2+ + 5 Fe3+ + 4 H2O❖关键:原子数配平后,以电子配平电荷小结:离子—电子法(半反应法)配平氧化还原反应方程式的步骤(三)应用:电极反应式与氧化还原反应方程式的配平❖电极反应的通式:氧化型+n e—==还原型A、酸介质以Cr2O7 2—/Cr3+电对为例,配平的方法与步骤如下:①氧化型写在左边,还原型写在右边 Cr2O7 2——— Cr3+②将变价元素的原子配平 Cr2O7 2——— 2Cr3+③在缺少n个O的一侧加上n个H2O,将O配平 Cr2O7 2———2Cr3++7H2O④在缺少n个H的一侧加上n个H+,将H配平 Cr2O7 2—+14H+——2Cr3++7H2O⑤加上电子以平衡电荷,完成配平 Cr2O7 2—+14H++6e—==2Cr3++7H2OB、碱介质以Ag2O/Ag电对为例,配平的方法与步骤如下:①氧化型写在左边,还原型写在右边 Ag2O—— Ag②将变价元素的原子配平 Ag2O—— 2Ag③在缺少n个O的一侧加上n个OH—,将O配平 Ag2O—— 2Ag+ OH—④在缺少n个H的一侧加上n个H2O,同时在另一侧加n个OH—,将H配平Ag2O+H2O—— 2Ag+ 2OH—⑤加上电子以平衡电荷,完成配平 Ag2O+H2O+2e—==2Ag+ 2OH—注意介质条件:✧酸性介质中,不应该出现碱性物质,如:OH—、S2—、CrO42—、MnO42—等。
✧碱性介质中,不应该出现酸性物质,如:H+、Zn2+、Cr2O7 2—等。
✧根据电对的存在形式,有时可以判断出介质;小结:配平过程中半反应左右两边添加H+,OH—,H2O的一般规律:✧酸性介质:多n个O,加2n个H+ ,另一边加n个H2O(氧多加氢生成水)✧碱性介质:多n个O,加n个H2O,另一边加2n个OH— (氧多加水生成OH—)✧中性介质:左边多n个O,加n个H2O,右边加2n个OH—;右边多n个O,加2n个H+ ,左边加n个H2O❖氧化还原方程式的配平例3:配平MnO4—+H2SO3==Mn2++SO42—解:①将反应写成两个电对 MnO4—/ Mn2+ SO42—/ H2SO3②分别配平这两个电极反应MnO4—+8H++5e———Mn2++4H2O (a)SO42—+4 H++2e———H2SO3+H2O (b)③调整化学计量数,使得两式中的e相等,然后两式相减,得2MnO4—+5H2SO3==2Mn2++5SO42—+4H++3 H2O例4:配平MnO4—+SO32—==MnO42—+SO42—解:从SO32—的存在形式来看,看出是碱性介质①MnO4—/ MnO42— SO42—/ SO32—②MnO4—+ e———MnO42—(a)SO32—+2OH———SO42—+ H2O+2e—(b)③(a)×2+(b)得,2MnO4—+SO32—+2OH—==2MnO42—+SO42—+ H2O例5:用离子—电子法配平氧化还原方程式 PbS+O3→PbSO4+O2解:①PbS/ PbSO4 O3/ O2②PbS+4 H2O-8e———PbSO4+8H+ (a)O3+2H++2e———O2+H2O (b) ×4PbS+4O3==PbSO4+4O2二、电极电势(重点)1、原电池❖氧化还原反应是电子转移的反应。
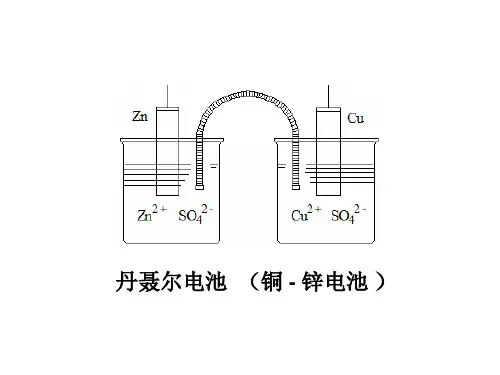
同一溶液内的氧化还原反应过程,电子转移时无定A、定义:借助于氧化还原反应产生电流即使化学能转变为电能的装置称为原电池。
以铜—锌原电池为例,介绍原电池原理和相关概念:❖在原电池中,组成原电池的导体称为电极。
『注: English: 发生氧化反应的电极记为Anode, 发生还原反应的电极记为Cathode.电池、蓄电池或电子管的负极用Cathode表示,而正极用Anode表示。
』拓展:四类常见电极①金属--金属离子电极(Me-Me n+电极 ):这种电极是金属棒插入到此金属的盐溶液中构成的,选择金属本身做电极。
电 对 电 极Zn 2+/Zn Zn|Zn 2+ (c )Cu 2+ / Cu Cu|Cu 2+ (c )②气体--离子电极(A-A n-电 极):将气体物质通入其相应离子的溶液中,气体与其溶液中的阴离子组成平衡体系。
由于气体不导电,需借助不参与电极反应的惰性电极起导电作用,这样的电极叫气体电极。
H + / H 2 Pt | H 2 (p) | H + (c )Cl 2 / Cl - Pt | Cl 2(p) | Cl - (c )O 2/H 2O(酸性) Pt | O 2(p) | H 2OO 2/OH -(碱性) Pt | O 2(p) | OH - (c )③氧化还原电极:它是将惰性电极(如铂或石墨)浸入含有同一元素的两种不同氧化值的离子的溶液中构成的。
『氧化还原电极的特点是没有单质参加反应。
』Fe 3+/Fe 2+ Fe 3+(c 1), Fe 2+(c 2)∣PtMnO 4- / Mn 2+ Pt | MnO 4- (c 1), Mn 2+ (c 2) , H +(c 3)④金属-金属难溶盐电极:这类电极是在金属表面上覆盖一层该金属难溶盐(或氧化物),然后将其浸入含有该盐阴离子的溶液中构成。
AgCl/Ag Ag ∣AgCl ∣Cl - (c )Hg 2Cl 2/Hg Hg ∣Hg 2Cl 2∣Cl -(c )的作用:作为正、负离子通道,使两个“半电池”的溶液都保持电中性,维持电路畅通。
KCl 2424❖B 、原电池的符号——以铜—锌原电池为例:(-) Zn(s) | ZnSO 4 (1 mol/dm 3) | | CuSO 4 (1 mol/dm 3) | Cu(s) (+)相界 浓度或活度 盐桥可简化为(不严格): (-) Zn(s) | ZnSO 4 | | CuSO 4 | Cu(s) (+)❖ 锌半电池: Zn 和ZnSO 4溶液组成。
电对Zn 2+/Zn 铜半电池: Cu 和CuSO 4溶液组成。
电对Cu 2+/Cu ◆ 原电池符号的书写规则①负极“-”在左边,正极“+”在右边。
②半电池中金属和溶液两相界面用“︱ ”分开,同相不同物种用“,”分开,非标准状态溶液、气体要注明c i ,p i (用括号表明),当溶液浓度为1mol·L -1时,可不写。
盐桥用“| |”表示。
③若电极反应无金属导体,用惰性电极Pt 或石墨(C)。
④纯液体、固体和气体写在惰性电极一边用“︱ ”分开。
例6:原电池 − 氢铁电池(-) (Pt), H 2(1 p θ)⎪H + (1 mol·dm -3) ⎥⎪ Fe 3+(1 mol·dm -3) , Fe 2+ (1 mol·dm -3) ⎢ Pt (+) ,请根据上述原电池,写出半反应(电极反应)和放电总反应。
解:负极:氧化半反应 H 2 = 2H + + 2e —正极:还原半反应 Fe 3++ e — = Fe 2+放电总反应: H 2 + 2 Fe 3+ = 2 H + + 2 Fe 2+2、电解池❖ 定义:电解池是使用直流电促使非自发的氧化还原反应 发生的装置,即电能→化学能的装置。