第八章氧化还原反应和电化学基础
- 格式:ppt
- 大小:1.12 MB
- 文档页数:95



氧化还原反应与电化学原理(基础知识)【考情分析】一、考纲要求1.理解氧化还原反应的本质和特征2.从多个角度理解氧化剂和还原剂等概念3.会比较与判断氧化性或还原性强弱4.知道常见的氧化剂和还原剂5.能判断氧化还原反应中的电子转移方向和数目6.能配平化学方程式7.能运用氧化还原反应的规律进行有关计算8.理解原电池原理。
熟记金属活动性顺序。
了解化学腐蚀与电化学腐蚀及一般防腐蚀方法。
9.通过电能转变为化学能的探究活动,了解电解池工作原理,能正确书写电解池的阴、阳极的电极反应式及电解反应方程式。
10.知道电解在氯碱工业、精炼铜、电镀、电冶金等方面的应用。
认识电能转化为化学能的实际意义。
二、命题趋向(1)由氧化还原反应方程式判断氧化性、还原性强弱。
(2)由氧化性、还原性强弱判断氧化还原反应方程式的正误。
(3)由氧化还原反应方程式判断氧化还原反应方程式的正误。
【考点剖析】普通的氧化还原反应在一处进行,不形成电流,化学能转变成热能或光能。
原电池中发生的反应具有两个特点:①是自发的氧化还原反应,②该反应在两处进行,分别叫正极和负极,其结果是化学能转变成电能。
电解池中发生的反应也具有两个特点:①是被迫发生的氧化还原反应,②该反应在两处进行,分别叫阴极和阳极,其结果是电能转变成化学能。
我们把研究电能与化学能相互转化的化学,叫做电化学。
氧化还原反应和电化学,作为高中化学中的基本概念和基础理论,在高考中占有非常重要的地位。
前者主要的考查点有:氧化剂、还原剂等概念的理解,氧化性、还原性强弱的判断,依据电子守恒进行配平和计算等。
后者的基本要求是:(1)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
了解常见化学电源的种类及其工作原理;(2)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施;(3)应用电解知识理解电镀铜、电解精炼铜、氯碱工业等化工生产原理。
氧化剂、还原剂等概念的理解,氧化性、还原性强弱的判断,依据电子守恒进行配平和计算等。

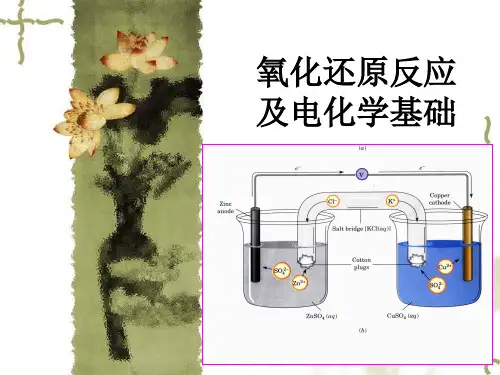




氧化还原反应与电化学氧化还原反应(简称氧化反应或还原反应)是化学反应的一种重要类型,也是电化学研究的基础。
电化学研究了物质在电场和电流的作用下的性质和变化规律,将电能与化学变化联系起来。
本文将着重介绍氧化还原反应与电化学之间的关系,探讨电流与氧化还原反应的本质联系,以及电化学在实际应用中的重要性。
1. 氧化还原反应的基本概念和原理氧化还原反应是指物质中的原子、离子或分子失去电子的过程为氧化反应,而得到电子的过程称为还原反应。
在氧化还原反应中,存在着氧化剂和还原剂两个参与物质,氧化剂接受电子,还原剂失去电子。
这一过程可以用化学方程式表示,例如:2Na + Cl2 → 2NaCl。
在这个反应中,钠(Na)失去了电子,发生了氧化反应;氯气(Cl2)接受了钠的电子,发生了还原反应。
2. 电流与氧化还原反应的联系氧化还原反应离不开电流的存在。
电流是指电荷在单位时间内通过导体横截面的量,其方向由正电荷流动的方向确定。
在氧化还原反应中,氧化剂接受电子,必须有电子从还原剂中流向氧化剂,才能维持反应的进行。
这个电子的流动过程形成了电流。
因此,可以说氧化还原反应是电流流动的结果,电流的存在促使了氧化还原反应的进行。
3. 电化学的研究内容电化学研究了物质在电场和电流的作用下的性质和变化规律。
其研究内容主要包括三个方面:电解学、电池学和电化学分析。
(1)电解学:电解学研究了物质在电解过程中的行为和特性。
电解是指将电能转化为化学能的过程,通过电解可以将化合物分解成对应的离子,或将离子还原为相应的化合物。
例如,通过电解水可以将水分解为氢气和氧气。
(2)电池学:电池学研究了电化学电池的工作原理和特性。
电化学电池是指利用氧化还原反应转化化学能为电能的装置。
电池由正极、负极和电解质组成,正极发生氧化反应,负极发生还原反应,通过电路和外部载荷与电解质之间的电子流动将化学能转化为电能。
(3)电化学分析:电化学分析是利用氧化还原反应进行分析的一种方法。

氧化还原反应与电化学氧化还原反应(Redox Reaction)是化学反应中常见的一种类型,也是电化学的基础。
在氧化还原反应中,物质会发生电荷转移过程,其中一个物质被氧化(失去电子),另一个物质被还原(获得电子)。
这种电荷转移过程伴随着电流的流动,因此氧化还原反应与电化学密切相关。
1. 氧化还原反应的基本原理在氧化还原反应中,常常可以观察到电子的转移与氧原子的参与。
在一些反应中,物质会失去电子,被称为氧化剂(Oxidizing Agent),而另一些物质则会获得电子,被称为还原剂(Reducing Agent)。
这种电子的转移与氧原子的参与使得物质的氧化态和还原态发生变化。
2. 氧化还原反应的重要性氧化还原反应在生活和工业中具有广泛的应用。
例如,我们所熟悉的腐蚀现象就是一种氧化还原反应。
金属物质在与氧气接触时会发生氧化反应,形成金属氧化物。
此外,氧化还原反应还被广泛应用于电池、电解、电镀等方面。
3. 电化学的基本概念电化学是研究化学反应与电流之间关系的学科。
它主要涉及电解反应(Electrolysis)和电化学电池(Electrochemical Cell)两个方面。
3.1 电解反应电解反应是在外加电压的作用下,将化学反应逆转的过程。
电解反应的基本原理是利用外部电压提供能量,使得自发不利反应变得可逆,从而实现物质的分解或转化。
3.2 电化学电池电化学电池是将化学能转化为电能的装置。
它由两个半电池组成,分别包含一个氧化反应和一个还原反应。
这两个半电池通过电解质溶液(Electrolyte)或电解质桥(Salt Bridge)连接起来,形成一个闭合的电路。
4. 电化学电池的工作原理电化学电池中,氧化反应和还原反应在两个半电池中同时进行。
在氧化反应中,电子流从还原剂移动到电解质溶液中;而在还原反应中,电子从电解质溶液流向氧化剂。
这一过程中,电子的流动经过外部电路,形成了电流。
根据电化学电池反应的性质和电流的方向,我们可以将电化学电池分为两类:电解池(Electrolytic Cell)和电池(Galvanic Cell)。

氧化还原反应和电化学氧化还原反应(简称“氧化还原反应”)是化学反应中一种非常重要的类型。
在氧化还原反应中,物质的电荷状态发生变化,原子失去或获得电子,从而形成离子,以完成化学反应。
电化学则是研究电能与化学能之间转化的学科。
一、氧化还原反应1. 概念和基本原理氧化还原反应是指在化学反应中,原子、离子或分子中的电子的互相转移过程。
氧化是指物质失去电子,而还原则是指物质获得电子。
在氧化还原反应中,存在着氧化剂和还原剂的概念。
氧化剂接受电子,自身被还原,而还原剂则失去电子,自身被氧化。
2. 氧化还原反应的应用氧化还原反应广泛应用于生活和工业领域。
例如,在电池中,氧化还原反应产生电能;在腐蚀过程中,金属发生氧化还原反应,导致金属的破坏;在生物体内,呼吸作用中的氧化还原反应产生能量。
二、电化学1. 电化学基本概念电化学是研究电能与化学能之间相互转化的学科。
它涉及到电解、电极反应、电池和电解质溶液等概念。
电化学通常分为两个分支:电解学和电池学。
2. 电化学实验电化学实验是研究电化学现象的重要手段。
在实验中,常见的电化学装置包括电解槽、电极、电解质溶液等。
通过实验可以观察到电流的流动和电极上发生的反应,从而揭示电化学过程的本质。
三、氧化还原反应与电化学的联系氧化还原反应与电化学紧密相关。
在电池中,氧化还原反应产生电能,而在电解槽中,电能则用于促使氧化还原反应发生。
此外,电极反应是电化学研究的重点之一,它涉及到氧化还原反应中电子的转移过程。
结论氧化还原反应是化学反应中重要的类型,通过氧化和还原的相互转化,实现能量的转化。
电化学则是研究电能与化学能之间相互转化的学科,它与氧化还原反应密切相关。
两者的研究和应用对于能源、环保等领域具有重要意义。
通过深入理解氧化还原反应和电化学,我们可以更好地应用于实际生活和工业中,促进科学技术的发展和进步。
这篇文章介绍了氧化还原反应和电化学的基本概念、原理和应用,并强调了两者之间的联系。
氧化还原反应和电化学的应用氧化还原反应(Redox reaction)是化学反应中常见的一种类型,与电化学密切相关。
本文将探讨氧化还原反应的基本概念,以及电化学在各个领域的广泛应用。
一、氧化还原反应的基本概念氧化还原反应是指化学反应中原子或离子的氧化态和还原态发生变化的过程。
其中,发生氧化反应的物质称为被氧化剂,而发生还原反应的物质则称为还原剂。
在氧化还原反应中,电子的转移是关键步骤,被氧化剂接受电子,而还原剂失去电子。
由于氧化还原反应涉及原子或离子的电子转移,因此与电化学有着密切的联系。
二、电化学基础知识1. 电解和电解质电解是指在外加电压的作用下,使电解质溶液或熔融的电解质发生化学反应。
在电解过程中,阳极发生氧化反应,阴极发生还原反应。
电化学中常用的电解质包括盐类、酸和碱等。
2. 电池和电解池电池是一种将化学能转化为电能的装置,通过氧化还原反应产生电流。
电池可以分为原电池和可充电电池两类。
原电池是指不能反复充放电使用的电池,如干电池;而可充电电池则可通过反向充电再次使用。
电解池是一种用来进行电解反应的装置,由阳极和阴极以及电解质组成。
电解质溶液经过电解后,在阳极发生氧化反应,在阴极发生还原反应。
三、电化学的应用1. 腐蚀与防腐金属在与空气中的氧发生氧化反应时,会产生腐蚀现象,导致金属表面的氧化。
通过电化学的方法,可以利用更活泼的金属作为还原剂,使其发生还原反应,从而减缓甚至阻止金属的腐蚀现象。
这就是常见的防腐处理技术,如镀锌、防锈漆等。
2. 电解制取金属在电解池中,可以通过电解质溶液将金属离子还原为纯金属。
这种方法被广泛应用于金属制备,如铝的电解制取、镀银、镀金等。
3. 锂离子电池锂离子电池是一种可充电电池,具有高能量密度、长寿命和较低的自放电率等特点。
锂离子电池基于锂离子在正负极材料之间的迁移和氧化还原反应来存储和释放电能。
锂离子电池在电子产品、电动汽车等领域得到了广泛应用。
4. 废水处理电化学方法也可以用于废水处理,通过电解质溶液中的氧化剂和还原剂的氧化还原反应,将污水中的有机物质氧化分解,达到净化水质的目的。
氧化还原反应和电化学氧化还原反应是化学反应中常见的一种反应类型,也是电化学研究的基础。
它涉及到物质的电子转移过程,包括氧化和还原两个半反应。
在氧化还原反应中,物质会失去或者获得电子,产生不同的氧化态。
本文将介绍氧化还原反应的基本概念及其在电化学中的应用。
一、氧化还原反应的概念氧化还原反应是指物质中的原子或离子发生电子转移的过程。
在氧化还原反应中,一个物质被氧化,失去电子,而另一个物质被还原,获得电子。
氧化还原反应的关键是电子的转移,可以通过半反应来描述。
在一个氧化还原反应中,通常会有氧化剂和还原剂。
氧化剂是指能够接受电子的物质,它在反应中被还原。
还原剂是指能够捐赠电子的物质,它在反应中被氧化。
氧化还原反应中,物质的氧化态会发生改变。
原子或离子失去电子后,氧化态变大;反之,获得电子后,氧化态变小。
氧化态的改变可以通过氧化数的变化来表示。
二、电化学中的氧化还原反应电化学是研究电与化学反应相互关系的学科。
氧化还原反应在电化学中具有重要的意义,电解和电池就是基于氧化还原反应而发展起来的。
1. 电解电解是指在外加电势的作用下,使溶液中发生氧化还原反应的过程。
在电解中,通过外加电势提供能量,促使物质发生电子转移。
正极受电子,发生还原反应;负极释放电子,发生氧化反应。
电解可以将电能转化为化学能,促使化学反应进行。
电解的应用十分广泛,例如铜的电镀、水的电解等。
2. 电池电池是将化学能转换为电能的装置,它利用氧化还原反应来产生电流。
电池由两个半电池组成,分别是氧化半反应和还原半反应。
在电池中,氧化半反应发生在负极(阴极),还原半反应发生在正极(阳极)。
通过电解质溶液或离子传导体,电子会从负极流向正极,形成电流。
电池的种类有很多,例如干电池、蓄电池、燃料电池等。
它们都利用氧化还原反应的电子转移特性来产生电流,满足人们对电能的需求。
三、电化学的应用电化学在生活和工业中有着广泛的应用,涉及到电解、电池、电镀等领域。
1. 电解用于金属提取和电解制氢电解在金属提取中起着重要的作用,例如铝的电解、锌的电解等。
化学氧化还原反应与电化学反应化学氧化还原反应与电化学反应是化学领域中两个重要的研究方向。
两者都涉及原子或分子的电子转移过程,但相应的反应机制和应用领域有所不同。
本文将从基本概念、反应机制和应用领域等方面对这两种反应进行分析和比较。
一、基本概念1.化学氧化还原反应化学氧化还原反应是指物质中的原子或分子通过转移电子而产生的化学反应。
在氧化还原反应中,发生氧化反应的物质叫做还原剂,接受电子的物质叫做氧化剂。
氧化还原反应可以通过氧化态的变化来判断。
还原剂的氧化态在反应前较高,在反应后较低;氧化剂的氧化态在反应前较低,在反应后较高。
2.电化学反应电化学反应是指以电解质溶液或电解质固体为介质,通过电流传递来引起的化学反应。
在电化学反应中,正极吸收电子,发生氧化反应,称为氧化反应;负极放出电子,发生还原反应,称为还原反应。
电化学反应可以分为两类,即电解反应和电池反应。
电解反应是通过外加电压将化学物质分解成离子,而电池反应则是通过电催化反应产生电流。
二、反应机制1.化学氧化还原反应机制化学氧化还原反应的机制与反应物之间的电子转移有关。
还原剂从反应物中吸收电子,氧化剂则释放电子给反应物。
在反应过程中,发生氧化反应的物质将电子从其他物质转移给自身,形成较低的氧化态;而发生还原反应的物质则将电子给予其他物质,形成较高的氧化态。
2.电化学反应机制电化学反应的机制与电解质溶液中离子的运动和电子的传递有关。
正极的氧化反应是在电流作用下离子接受电子的过程,负极的还原反应是在电流作用下离子失去电子的过程。
当两极之间的电压足够大时,离子会从正极移动到负极,而在此过程中发生氧化还原反应。
三、应用领域1.化学氧化还原反应的应用化学氧化还原反应在许多化学领域中广泛应用。
例如,在有机合成中,氧化还原反应可以用于生成新的化合物或改变化合物的结构;在环境保护中,氧化还原反应可以用于废水处理和空气净化;在能源领域,氧化还原反应可以用于燃料电池和太阳能电池的电化学反应。
氧化还原反应与电化学氧化还原反应是化学反应中十分重要的一类反应。
与之密切相关的是电化学,它研究的是电流与化学反应之间的关系。
本文将探讨氧化还原反应与电化学之间的联系以及其在实际应用中的重要性。
一、氧化还原反应的基本概念氧化还原反应是指物质失去电子的过程称为氧化,物质获得电子的过程称为还原。
氧化还原反应是通过电子的转移来达到化学变化的。
在氧化还原反应中,被氧化的物质被称为还原剂,因为它促使其他物质被氧化;而被还原的物质被称为氧化剂,因为它促使其他物质被还原。
氧化还原反应中,电子的转移通常会伴随着原子的转移,使得反应物在电荷上发生变化。
二、电化学基础知识电化学是研究电荷与化学反应之间相互转化关系的学科。
其中最重要的概念是电解质溶液和电解池。
电解质溶液是指在溶液中存在自由离子的物质,能够导电。
电解质溶液中,正负离子在电场作用下会迁移,形成电流。
而电解池是由两个电极和其中的电解质溶液构成的系统。
电极又分为阴极和阳极,阴极是在电解质溶液中的负极,而阳极则是正极。
电解质溶液中的离子在电极上发生氧化还原反应,产生电流。
三、氧化还原反应与电化学之间的联系氧化还原反应与电化学密不可分。
在电化学中,氧化还原反应是产生电流的基础。
电化学反应中,阴极上发生还原反应,而阳极上发生氧化反应。
阴极接受来自阳极的电子,使得阴极上的物质还原;而阳极失去电子,使得阳极上的物质氧化。
四、氧化还原反应在实际应用中的重要性氧化还原反应在实际应用中有着广泛的应用。
以下是一些例子:1. 电池:电池是将化学能转化为电能的装置。
其中的电化学反应是氧化还原反应的典型例子。
在电池中,化学反应将化学能转化为电能,提供给我们的日常生活所需。
2. 腐蚀:金属的腐蚀也是一种氧化还原反应。
金属与氧气或其他化合物反应,使金属表面形成氧化物,从而损坏金属的性能。
腐蚀的控制和防治是保护金属材料的重要方法。
3. 电解制氢:电解水是将水分解为氢气和氧气的过程。
在电解水过程中,水发生氧化还原反应,电流通过水分子,将水分解为氧气和氢气。