气体物理化学
- 格式:pptx
- 大小:533.89 KB
- 文档页数:32






物理化学气体性质习题答案物理化学气体性质习题答案气体是物理化学中一个重要的研究对象,其性质和行为对于我们理解自然界和应用科学原理具有重要意义。
在学习物理化学的过程中,我们经常会遇到一些关于气体性质的习题。
下面,我将为大家提供一些常见气体性质习题的答案,希望能对大家的学习有所帮助。
1. 问题:一定体积的气体在恒定温度下,压强与摩尔数成正比。
如果将气体的摩尔数增加一倍,压强会发生什么变化?答案:根据查理定律,一定体积的气体在恒定温度下,压强与摩尔数成正比。
因此,当气体的摩尔数增加一倍时,压强也会增加一倍。
2. 问题:一定质量的气体在恒定温度下,体积与压强成反比。
如果将气体的压强减小一半,体积会发生什么变化?答案:根据波义耳定律,一定质量的气体在恒定温度下,体积与压强成反比。
因此,当气体的压强减小一半时,体积会增加两倍。
3. 问题:一定质量的气体在恒定温度下,体积与摩尔数成正比。
如果将气体的摩尔数减少一半,体积会发生什么变化?答案:一定质量的气体在恒定温度下,体积与摩尔数成正比。
因此,当气体的摩尔数减少一半时,体积也会减少一半。
4. 问题:一定质量的气体在恒定温度下,压强与体积成正比。
如果将气体的体积增加一倍,压强会发生什么变化?答案:根据阿伏伽德罗定律,一定质量的气体在恒定温度下,压强与体积成正比。
因此,当气体的体积增加一倍时,压强也会减少一倍。
5. 问题:一定质量的气体在恒定温度下,压强与摩尔数成正比。
如果将气体的摩尔数减少一半,压强会发生什么变化?答案:一定质量的气体在恒定温度下,压强与摩尔数成正比。
因此,当气体的摩尔数减少一半时,压强也会减少一半。
以上是一些常见的物理化学气体性质习题的答案。
通过解答这些习题,我们可以更好地理解气体的性质和行为。
当然,除了这些基本的性质关系,气体还有很多其他的性质和行为,例如气体的扩散性、气体的溶解度等等。
希望大家在学习和应用物理化学的过程中,能够深入理解气体的性质,掌握相关的理论知识,并能够灵活运用于实际问题的解决中。
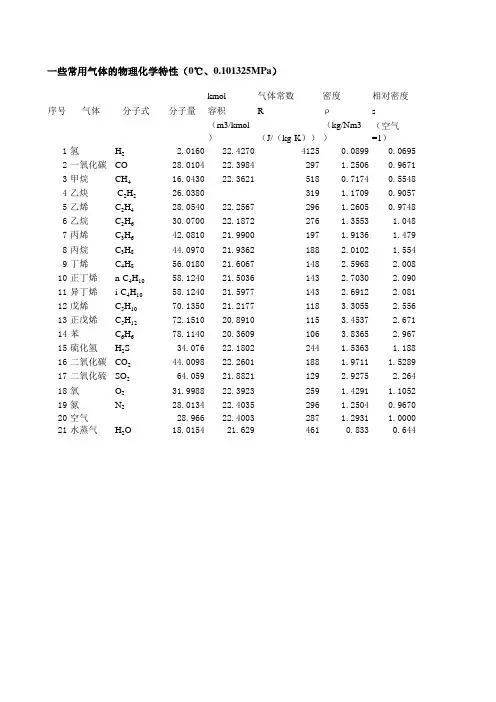
kmol气体常数密度相对密度容积Rρs(m3/kmol )(J/(kg·K ))(kg/Nm3)(空气=1)1氢H 2 2.016022.427041250.08990.06952一氧化碳CO28.010422.3984297 1.25060.96713甲烷CH 416.043022.36215180.71740.55484乙炔 C 2H 226.0380319 1.17090.90575乙烯C 2H 428.054022.2567296 1.26050.97486乙烷C 2H 630.070022.1872276 1.3553 1.0487丙烯C 3H 642.081021.9900197 1.9136 1.4798丙烷C 3H 844.097021.9362188 2.0102 1.5549丁烯C 4H 856.018021.6067148 2.5968 2.00810正丁烯n-C 4H 1058.124021.5036143 2.7030 2.09011异丁烯i-C 4H 1058.124021.5977143 2.6912 2.08112戊烯C 5H 1070.135021.2177118 3.3055 2.55613正戊烯C 5H 1272.151020.8910115 3.4537 2.67114苯C 6H 678.114020.3609106 3.8365 2.96715硫化氢H 2S34.07622.1802244 1.5363 1.18816二氧化碳CO 244.009822.2601188 1.9711 1.528917二氧化硫SO 264.05921.8821129 2.9275 2.26418氧O 231.998822.3923259 1.4291 1.105219氮N 228.013422.4035296 1.25040.967020空气28.96622.4003287 1.2931 1.000021水蒸气H 2O18.015421.6294610.8330.644一些常用气体的物理化学特性(0℃、0.101325MPa )序号气体分子式分子量定压比热绝热指数临界压力临界温度临界导热系数向空气的扩散系数c k Pc Tc压缩因子λD×104(kJ/(Nm3·K))(Mpa)(K)Z(W/(m·K))(m2/s)1.2980 1.4070 1.29733.30.3040.21630.6111.302 1.403 3.4961330.2940.023000.1751.545 1.309 4.641190.70.2900.030240.1961.909 1.2690.018721.888 1.258 5.117283.10.2700.01642.244 1.198 4.884305.40.2850.018610.1082.675 1.170 4.600365.10.2742.96 1.161 4.256369.90.2770.015120.0881.1463.71 1.144 3.800425.20.2740.013490.0751.144 3.648408.10.2831.121 3.374469.50.2693.266 1.1200.0077921.557 1.3200.013141.62 1.3047.387304.20.2740.013720.1381.779 1.2721.315 1.400 5.076154.80.2920.0250.1781.302 1.402 3.394126.20.2970.024891.306 1.401 3.3766132.50.024891.491 1.33522.126470.2300.016170.220运动粘度动力粘度常数最低着火温度ν×106μ×106C(m 2/s)(kg·s/m 2)(℃)高93.000.85290400H 2+0.5O 2=H 2O 28601313.30 1.690104605CO+0.5O 2=CO 228320814.50 1.060190540CH 4+2O 2=CO 2+2H 2O 8909438.0500.960198335C 2H 2+2.5O 2=2CO 2+H 2O 7.460.950257425C 2H 4+3O 2=2CO 2+2H 2O 14119316.410.877287515C 2H 6+3.5O 2=2CO 2+3H 2O 15608983.990.780322460C 3H 6+4.5O 2=3CO 2+3H 2O 20598303.810.765324450C 3H 8+5O 2=3CO 2+4H 2022214872.810.747385C 4H 8+6O 2=4CO 2+4H 2O 27191342.530.697349365C 4H 10+6.5O 2=4CO 2+5H 2O 2879057460C 4H 10+6.5O 2=4CO 2+5H 2O 28735351.990.669290C 5H 10+7.5O 2=5CO 2+5H 2O 33780991.850.648260C 5H 12+8O 2=5CO 2+6H 2O35384531.820.712380560C 6H 6+7.5O 2=6CO 2+3H 2O 33037507.63 1.190331270H 2S+1.5O 2=SO 2+H 2O5625727.09 1.4302664.14 1.23041613.60 1.98013113.30 1.70011213.40 1.75011610.120.860673(kj/kmol )热效应燃烧反应式CO 2低高低空气氧2420641275310794 2.380.5 1.02832081264412644 2.380.5 1.080293239842359069.52 2.0 2.0585025648811.90 2.5 2.013213545634385948214.28 3.0 2.01428792703516439716.66 3.5 3.01927808936718766721.42 4.5 3.020454241012709324423.80 5.0 4.0254300412584711769528.56 6.0 4.0265889413388512364930.94 6.5 4.0265343911304812285730.94 6.5 5.0315796915921114883735.707.5 5.0327430816937715673338.088.0 6.0317161416225915577035.707.5 1.051864425364233837.141.5理论烟Nm 3/Nm 3干kj/kmol )热效应理论空气需要量,耗氧量(Nm 3/Nm 3干燃气)热值(kj/Nm 3)燃烧热量温度(℃)H 2ON 2V f 0下上1.0 1.882.88 4.075.922101.88 2.8812.574.223702.07.5210.52 5.015.020431.09.4012.40 2.580.026202.011.2815.28 2.734.023433.013.1618.16 2.913.021153.016.9222.92 2.011.722244.018.8025.80 2.19.521554.022.5630.56 1.610.05.024.4434.44 1.58.521305.024.4434.44 1.88.521185.028.2038.20 1.48.76.030.0841.08 1.48.33.028.2037.20 1.28.022581.05.647.644.345.51900爆炸极限(%)常压,20℃理论烟气量(Nm 3/Nm 3干燃气)。


常用气体的基本物理化学参数1.氧气(O2)- 分子量:32 g/mol-密度:1.429g/L-沸点:-183°C-熔点:-218.8°C-溶解度:在水中溶解度较低,随温度的升高而降低-导电性:非电解质- 热容:21 J/(mol·K)2.二氧化碳(CO2)- 分子量:44 g/mol-密度:1.977g/L-沸点:-78.5°C-熔点:-57°C-溶解度:在水中溶解度较高,随温度升高而降低-导电性:非电解质- 热容:37 J/(mol·K)3.氮气(N2)- 分子量:28 g/mol-密度:1.165g/L-沸点:-195.8°C-熔点:-210°C-溶解度:在水中溶解度较低-导电性:非电解质- 热容:29 J/(mol·K)4.氢气(H2)- 分子量:2 g/mol-密度:0.09g/L-沸点:-252.8°C-熔点:-259.2°C-溶解度:在水中溶解度较低-导电性:非电解质- 热容:14 J/(mol·K)5.氨气(NH3)- 分子量:17 g/mol-密度:0.73g/L-沸点:-33.34°C-熔点:-77.73°C-溶解度:在水中溶解度较高-导电性:能部分电离为电解质- 热容:35 J/(mol·K)6.甲烷(CH4)- 分子量:16 g/mol-密度:0.66g/L-沸点:-161.5°C-熔点:-182.5°C-溶解度:在水中溶解度较低-导电性:非电解质- 热容:35 J/(mol·K)以上只是一些常见气体的基本物理化学参数,不同的气体在不同的条件下,这些参数可能会有所变化。
这些参数在化学工业和实验室研究中非常重要,对于研究气体的性质和反应有着重要的指导作用。
物理化学气体气体是一种物态,其分子之间的相互作用较弱,分子之间存在较大的距离。
气体的性质和行为在物理化学领域中被广泛研究。
本文将重点论述气体的物理化学特性、气体状态方程、气体溶解度以及气体变化过程。
一、气体的物理化学特性气体具有以下一些独特的物理化学特性:1. 可压缩性:由于气体分子之间较大的距离,气体具有较高的可压缩性。
当外界施加压力时,气体体积会减小。
2. 扩散性:气体分子由于高速运动,具有很强的扩散能力。
气体分子会自动均匀地在空间中扩散。
3. 可混溶性:气体之间具有较好的相互溶解性,可以相互扩散,并且气体之间没有明显的相互作用力。
4. 性质多变:气体在不同的温度、压力和浓度下,可以呈现出不同的性质和行为。
二、气体状态方程气体状态方程描述了气体在不同条件下的状态和性质。
最常用的气体状态方程有理想气体状态方程和实际气体状态方程。
1. 理想气体状态方程(理想气体定律):理想气体状态方程由PV = nRT 表示,其中P为气体的压力,V为气体的体积,n为气体的物质量,R为气体常数,T为气体的温度。
理想气体状态方程适用于气体分子间相互作用较弱的情况。
2. 实际气体状态方程:实际气体状态方程考虑了气体分子间的吸引力和排斥力,常用的实际气体状态方程有范德瓦尔斯方程和安托万方程等。
这些方程在气体分子间相互作用较强的情况下更准确地描述了气体的行为。
三、气体溶解度气体在液体中的溶解度可以通过亨利定律来描述。
亨利定律规定了在一定温度下,气体溶解度与气体压力成正比关系。
\[C = k \cdot P\]其中,C为气体在液体中的溶解度,P为气体的分压,k为亨利常数,表示单位分压下气体溶解度的增加量。
气体溶解度还受温度和溶解介质性质的影响。
一般来说,温度升高会降低气体溶解度,而溶解介质的性质(如溶剂的极性)也会对气体的溶解度产生影响。
四、气体变化过程气体在不同条件下会经历各种变化过程,包括气体的加热、冷却、压缩、扩容等。
物理化学气体知识点总结一、气体的基本概念1. 气体的定义气体是一种物态,它是一种没有固定形状和容积的物质。
2. 气体的分子结构气体由分子组成,分子之间没有规则的排列方式,分子之间的间距非常大,分子可以自由运动,并且具有较高的平均动能。
3. 气体的三态气体是物质的一种态态,它有三个基本态态,即固态、液态和气态。
气体是物质的一种常见状态,常见的气体有氧气、二氧化碳、氢气等。
4. 气体的性质气体具有一些独特的物理性质,如容易被压缩、能够扩散、熵增加等。
二、气体的物理性质1. 压强气体的压强是气体分子对容器壁施加的压力,它与气体分子的速度相关。
根据理想气体定律,气体的压强与温度和体积成正比。
2. 体积气体的体积是指气体所占据的空间大小,它是气体的一个重要物理性质。
根据理想气体定律,气体的体积与温度和压强成正比。
3. 温度气体的温度是指气体分子的平均动能,它是气体的一个重要物理性质。
根据理想气体定律,气体的温度与压强和体积成正比。
4. 密度气体的密度是指单位体积内气体的质量,它是气体的一个重要物理性质。
气体的密度与气体的种类、压强和温度都有关。
5. 扩散气体的扩散是指气体分子能够在空间中自由运动并占据整个容器的能力,它是气体的一个重要物理性质。
气体的扩散速度与气体的分子质量有关。
6. 热容气体的热容是指单位质量或单位摩尔气体在温度变化下所吸收或释放的热量,它是气体的一个重要物理性质。
气体的热容与气体的种类和温度有关。
7. 比热容气体的比热容是指单位质量或单位摩尔气体在温度变化下吸收或释放的热量,它是气体的一个重要物理性质。
气体的比热容与气体的种类和温度有关。
三、气体的化学性质1. 反应性气体具有很强的反应性,它们常与其他物质发生化学反应,如氧化、还原、分解、合成等。
2. 溶解性气体在液体中的溶解性是气体的一个重要化学性质,与气体与液体分子之间的相互作用力有关。
溶解性常用来描述气体在液体中的溶解程度。
3. 反应速度气体的反应速度是气体与其他物质发生化学反应的速度,它与反应物的浓度、温度和压强等有关。