物理化学:气体的pVT关系
- 格式:ppt
- 大小:11.13 MB
- 文档页数:56
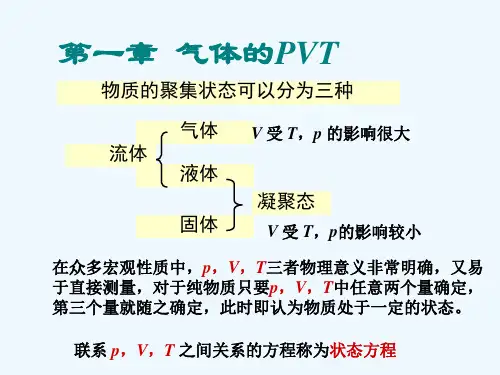


第一章 气体的pVT 关系主要公式及使用条件1. 理想气体状态方程式nRT RT M m pV ==)/(或 RT n V p pV ==)/(m式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。
m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。
R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。
此式适用于理想气体,近似地适用于低压的真实气体。
2. 气体混合物 (1)组成摩尔分数 y B (或x B ) =∑AAB /n n体积分数/y B m ,B B *=V ϕ∑*AVy Am ,A式中∑AAn 为混合气体总的物质的量。
Am,*V表示在一定T ,p 下纯气体A 的摩尔体积。
∑*AA m ,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。
(2)摩尔质量∑∑∑===BBBB B BB mix //n M n m M y M式中∑=BB m m 为混合气体的总质量,∑=BB n n 为混合气体总的物质的量。
上述各式适用于任意的气体混合物。
(3)V V p p n n y ///B B B B *===式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。
*B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。
3. 道尔顿定律p B = y B p ,∑=BBp p上式适用于任意气体。
对于理想气体VRT n p /B B =4. 阿马加分体积定律V RT n V /B B =*此式只适用于理想气体。
5. 范德华方程RT b V V a p =-+))(/(m 2mnRT nb V V an p =-+))(/(22式中a 的单位为Pa · m 6 · mol -2,b 的单位为m 3 · mol -1,a 和b 皆为只与气体的种类有关的常数,称为范德华常数。

物理化学主要公式第一章 气体的pVT 关系1.理想气体状态方程式nRT RT M m pV ==)/(或 RT n V p pV ==)/(m式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。
m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。
R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。
此式适用于理想气体,近似地适用于低压的真实气体。
2.气体混合物 (1) 组成摩尔分数 y B (或x B ) = ∑AA B /n n体积分数 /y B m,B B *=V ϕ∑*AVy Am ,A式中∑AA n 为混合气体总的物质的量。
A m,*V 表示在一定T ,p 下纯气体A 的摩尔体积。
∑*AA m ,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。
(2) 摩尔质量∑∑∑===BBBB B BB mix //n M n m M y M式中 ∑=BB m m 为混合气体的总质量,∑=BB n n 为混合气体总的物质的量。
上述各式适用于任意的气体混合物。
(3)V V p p n n y ///B B B B *=== 式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。
*B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。
3.道尔顿定律p B = y B p ,∑=BB p p上式适用于任意气体。
对于理想气体V RT n p /B B =4.阿马加分体积定律V RT n V /B B =*此式只适用于理想气体。
5.范德华方程RT b V V a p =-+))(/(m 2mnRT nb V V an p =-+))(/(22式中a 的单位为Pa · m 6 · mol -2,b 的单位为m 3 · mol -1,a 和b 皆为只与气体的种类有关的常数,称为范德华常数。

气体的pVT 关系 主要公式及使用条件1. 理想气体状态方程式nRT RT M m pV ==)/(或 RT n V p pV ==)/(m式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。
m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。
R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。
此式适用于理想气体,近似地适用于低压的真实气体。
2. 气体混合物 (1) 组成摩尔分数 y B (或x B ) = ∑AA B /n n体积分数 /y B m,B B *=V ϕ∑*AVy Am,A式中∑AA n 为混合气体总的物质的量。
Am,*V表示在一定T ,p 下纯气体A 的摩尔体积。
∑*AA m,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。
(2) 摩尔质量∑∑∑===BBBB B BB mix //n M n m M y M式中 ∑=BB m m 为混合气体的总质量,∑=BB n n 为混合气体总的物质的量。
上述各式适用于任意的气体混合物。
(3) V V p p n n y ///B B B B *===式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。
*B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。
3. 道尔顿定律p B = y B p ,∑=BB p p上式适用于任意气体。
对于理想气体V RT n p /B B =4. 范德华方程RT b V V a p =-+))(/(m 2mnRT nb V V an p =-+))(/(22式中a 的单位为Pa · m 6 · mol -2,b 的单位为m 3 · mol -1,a 和b 皆为只与气体的种类有关的常数,称为范德华常数。
此式适用于最高压力为几个MPa 的中压范围内实际气体p ,V ,T ,n 的相互计算。




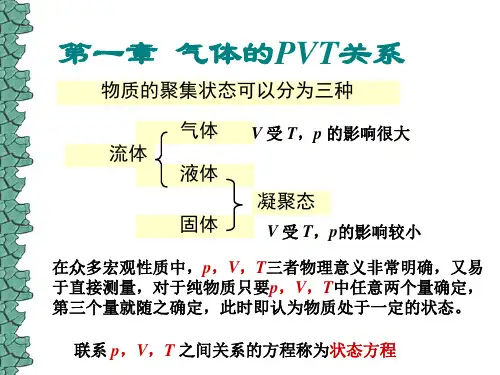
物理化学主要公式第一章 气体的pVT 关系1. 理想气体状态方程式nRT RT M m pV ==)/( 或 RT n V p pV ==)/(m式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。
m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。
R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。
此式适用于理想气体,近似地适用于低压的真实气体。
2. 气体混合物(1) 组成摩尔分数 y B (或x B ) = ∑AA B /n n体积分数 /y B m,B B *=V ϕ∑*AV y A m ,A式中∑A A n 为混合气体总的物质的量。
A m,*V 表示在一定T ,p 下纯气体A 的摩尔体积。
∑*AA m ,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。
(2) 摩尔质量∑∑∑===B BB B B B B mix //n M n m M y M式中 ∑=B B m m 为混合气体的总质量,∑=BB n n 为混合气体总的物质的量。
上述各式适用于任意的气体混合物。
(3)V V p p n n y ///B B B B *=== 式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。
*B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。
3. 道尔顿定律p B = y B p ,∑=BB p p上式适用于任意气体。
对于理想气体V RT n p /B B =4. 阿马加分体积定律V RT n V /B B =*此式只适用于理想气体。
5. 范德华方程RT b V V a p =-+))(/(m 2mnRT nb V V an p =-+))(/(22式中a 的单位为Pa · m 6 · mol -2,b 的单位为m 3 · mol -1,a 和b 皆为只与气体的种类有关的常数,称为范德华常数。
第一章气体的pvT关系⑴波义尔定律:当n、T一定时,PV=常数⑵盖-吕萨克定律:当n、P一定时,V/T=常数⑶阿伏伽德罗定律:当T、P一定时,V/n=常数●⑷理想气体状态方程:PV=(m/M)RT= nRT或者或PVm=p(V/n)=RTR=8.314mol-1·K-1称为摩尔气体常数;T为华氏温度⑸摩尔分数:X B=n B/n总●⑹道尔顿定律:P B=P总X B;P总=P分⑺实际气体状态方程:PV=znRT(z为压缩因子)●⑻理想气体特征:①分子间无相互作用力②分子本身不占有体积第二章热力学第一定律热力学第一定律(能量守恒定律)●⑴系统:①隔离系统:无能量、无物质交换②★封闭系统:有能量、无物质交换(热力学基础;热力学研究对象)③敞开系统:有能量、有物质交换●⑵状态函数:P、V、T、U、H、G、A、S (P、T、C p, m、C V,m 为强度量,其他均为广度量) 状态函数特征:①有可微分性,能计算②只与始末状态有关●途径函数:Q、W●⑶热:系统从环境中吸热(Q>0);系统对环境做功(W<0)●⑷热力学能:△U=Q+W(封闭系统);U只是温度T的函数;只与首末有关非体积功的计算①气体向真空膨胀时体积功所的计算W=0②恒外压过程体积功W=-p(V2-V1)=-p△V③对于理想气体恒压变温过程W=-p△V=-nR△T④可逆过程体积功W=-p(v2-v1)●⑤理想气体恒温可逆过程体积功 W=-p(v2-v1)或者W=-nRTln(V1/V2)或者W=nRTln(p2/ p1)⑥理想气体绝热可逆过程体积功W=-p(v2-v1)=(-)γ= C p, m /C V,m(双原子气体为1.4)T2/T1=(V1/V2) 的γ-1次方;T2/T1=(P1/P2)的(γ-1)/γ次方;P2/P1=(V1/V2)的γ次方●⑦恒温膨胀可逆功最大,系统对环境作最大功;恒温可逆压缩,环境对系统做最小功⑧可逆相变体积功W=-pdV恒热容、恒压热,焓⑴焓定义:H=U + PV⑵焓变:△H=△U+△(pV)式中△(pV)为p V乘积的增量,只有在恒压下△(pV)=p(V2-V1)在数值上等于体积功。
第一章 气体的pVT 关系 主要公式及使用条件1. 理想气体状态方程式nRT RT M m pV ==)/(或 RT n V p pV ==)/(m此式适用于理想气体,近似地适用于低压的真实气体。
2. 道尔顿定律p B = y B p ,∑=BB p p上式适用于任意气体。
对于理想气体V RT n p /B B =3. 范德华方程RT b V V a p =-+))(/(m 2mnRTnb V V an p =-+))(/(22式中a 的单位为Pa · m 6· mol -2,b 的单位为m 3· mol -1,a 和b 皆为只与气体的种类有关的常数,称为范德华常数。
此式适用于最高压力为几个MPa 的中压范围内实际气体p ,V ,T ,n 的相互计算。
第二章热力学第一定律主要公式及使用条件1. 热力学第一定律的数学表示式W Q U +=∆或 'am b δδδd δdU Q W Q p V W =+=-+规定系统吸热为正,放热为负。
系统得功为正,对环境作功为负。
式中 p amb 为环境的压力,W ’为非体积功。
上式适用于封闭体系的一切过程。
2. 焓的定义式 3. 焓变(1) )(pV U H ∆+∆=∆式中)(pV ∆为pV 乘积的增量,只有在恒压下)()(12V V p pV -=∆在数值上等于体积功。
(2) 2,m 1d p HnC T ∆=⎰此式适用于理想气体单纯pVT 变化的一切过程,或真实气体的恒压变温过程,或纯的液体、固体物质压力变化不大的变温过程。
4. 热力学能(又称内能)变此式适用于理想气体单纯pVT 变化的一切过程。
pVU H +=2,m 1d V U nC T∆=⎰5. 恒容热和恒压热V Q U =∆ (d 0,'0)V W == p Q H =∆ (d 0,'0)p W == 6. 热容的定义式 (1)定压热容和定容热容δ/d (/)p p p C Q T H T ==∂∂δ/d (/)V V V C Q T U T ==∂∂(2)摩尔定压热容和摩尔定容热容,m m /(/)p p p C C n H T ==∂∂ ,m m /(/)V V V C C n U T ==∂∂上式分别适用于无相变变化、无化学变化、非体积功为零的恒压和恒容过程。