氧气的化学性质1
- 格式:ppt
- 大小:320.00 KB
- 文档页数:13

氧气的化学性质【知识点的认识】氧气的化学性质主要是指氧气具有助燃性或氧化性,还有能支持呼吸.即它是一种化学性质比较活泼的气体,可以与非金属、金属、化合物等多种特物质发生氧化反应,反应剧烈程度因条件不同而异,可表现为缓慢氧化、燃烧或爆炸等,但在反应中都放出大量的热.具体情况如下:中考化学学霸提分笔记,中考提分必备¥30购买1.氧气与非金属反应,例如:(1)木炭在氧气里剧烈燃烧,发出白光,生成无色、无气味能使澄清石灰水变浑浊的气体(即二氧化碳);(但是,当氧气不充足时,会生成一氧化碳)(2)硫在氧气里剧烈燃烧,产生明亮的蓝紫色火焰(在空气中燃烧发出微弱的淡蓝色火焰),生成无色、有刺激性气味的气体(即二氧化硫);(3)红磷在氧气里剧烈燃烧,生成大量的白烟(即五氧化二磷),发出白光(在空气中燃烧产生黄色火焰),而白磷可以与空气中氧气的发生缓慢氧化,达到着火点(40℃)时,引起自燃,(4)氢气在氧气中燃烧,产生淡蓝色火焰,罩一干冷烧杯在火焰上会有水雾生成.2.氧气与金属反应,例如:(1)镁在氧气中或在空气中剧烈燃烧,发出耀眼白光,生成白色粉末状物质(即氧化镁);(2)红热的铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体物质(即四氧化三铁);(3)铜在氧气中或在空气中加热,会逐渐变成黑色的固体(氧化铜).3.氧气与化合物反应,例如:(1)一氧化碳在氧气中燃烧产生蓝色火焰,生成能使澄清石灰水变浑浊的气体(即二氧化碳);(2)甲烷(沼气)在氧气中燃烧火焰明亮呈蓝色,生成能使石灰水变浑浊的气体(即二氧化碳),罩一干冷烧杯在火焰上还会有水雾生成.(3)酒精(乙醇)在氧气中或在空气中燃烧,产生淡蓝色的火焰,生成能使石灰水变浑浊的气体(即二氧化碳),罩一干冷烧杯在火焰上还会有水雾生成.(4)蜡烛在氧气中燃烧发出白光,在空气中燃烧发黄光,集气瓶的内壁有水珠出现,并能使澄清的石灰水变浑浊的气体(即二氧化碳).(5)葡萄糖在酶作用下经缓慢氧化转变成二氧化碳和水,同时放出能量,供机体活动和维持恒定体温的需要.4.呼吸作用是生物从自然界里吸入氧气,而呼出二氧化碳的过程.实际上它是一种缓慢氧化.∙化学∙中考∙教育。

氧气的制取和性质
一. O 2的物理性质:
O 2是一种无色无味的气体,密度比空气略大,不易溶于水.
二. O 2的检验方法:
将带火星的木条伸入集气瓶中,若木条复燃,证明该
气体是O 2。
三.O 2的化学性质:(助燃性)
1. 木炭在O 2中燃烧:
现象:燃烧更加剧烈,发白光,放热,产生能使澄清
结论:碳
+ (化学反应的文字表达式) C O 2 co 2
2. 硫在O 2中燃烧:
现象:
结论:硫 +
S O 2 so 2
3. 红磷在O 2中燃烧:
现象:
结论:磷 +
P O 2 p 2o 5
4.铁丝在O2中燃烧:
现象:
结论:铁+
Fe O2Fe3o4
5.石蜡在O2中燃烧:
现象:燃烧更旺,瓶壁上有水雾出现,产生能使澄清
石灰水变浑浊的气体。
点燃
结论:石蜡+氧气—→二氧化碳+水
?O2co2H2o。

氧气的性质和制取氧气的性质和实验室制法一.检验氧气的方法:把带火星的木条伸入集气瓶中,木条复燃说明瓶中气体为氧气检验空气、氧气、二氧化碳气体的方法:分别用燃着的木条伸入三瓶气体中,木条燃烧更旺的为氧气;继续燃烧无明显变化的为空气;迅速熄灭的为二氧化碳。
二.(1)氧气的物理性质:常温下为无色无味的气体,密度比空气大,不易溶于水,熔沸点低氧气的化学性质:具有氧化性。
用途:支持燃烧,供给呼吸(2)氧气与下列物质反应现象(3)铁燃烧要在集气瓶底部放少量水或细砂的目的:防止溅落的高温熔化物炸裂瓶底*铁、铝在空气中不可燃烧。
硫在燃烧时集气瓶中加入少量的水或加入氢氧化钠溶液目的是吸收生成二氧化硫避免污染空气。
为什么磷在氧气中燃烧时集气瓶中加入少量的水?(1)、防止磷燃烧放出热量使集气瓶破裂(2)、吸收产生的P2O5,防止污染实验前应将铁丝用砂布打磨,除掉铁丝表面的铁锈和氧化膜,有利于铁丝燃烧。
夹持木炭和铁丝的坩埚钳要缓慢伸入集气瓶中目的是与氧气充分反应,防止产生的热量使氧气逸出。
铁丝要绕成螺旋状目的是增大受热面积,有利于铁丝持续燃烧。
铁丝末端要系一根火柴目的是引燃铁丝,使温度达到着火点。
火柴要等到将要燃尽时在伸入集气瓶中目的尽量使火柴少消耗氧气。
物质在空气中燃烧的现象与氧气中不同,氧气的浓度越大燃烧越剧烈。
铁丝伸入集气瓶中没有看到火星四射的现象分析原因:1.铁丝表面有铁锈或油漆 2.氧气的浓度太低3.火柴没有将铁丝引燃。
三.氧气的制备:工业制氧气——分离液态空气法(原理:氮气和氧气的沸点不同物理变化)实验室制氧气原理 2H2O2MnO22H2O + O2↑ 2KMnO△K2MnO4+ MnO2+ O2↑2KClO3MnO22KCl+3O2↑四.气体制取与收集装置的选择△发生装置:固固加热型、固液不加热型由反应物的状态和反应条件决定的。
高锰酸钾是紫黑色的固体,氯酸钾是白色的固体,二氧化锰是黑色的固体。
过氧化氢溶液是无色液体。


氧气是一种无色、无味、无臭的气体,分子式为O2,在常温常压下为无色无臭的气体。
氧气是生命必需的元素,在人体中具有重要的生理作用。
氧气的化学性质如下:
1、氧气是一种活性气体,易与其他元素发生化学反应。
2、氧气是燃料的有效氧化剂,能使燃料完全燃烧。
3、氧气与炭素、氢气发生反应时会产生热量,可以用于加热、焊接等。
4、氧气与有机物发生反应时会产生二氧化碳、水和热量,可以用于焚烧、加工等。
5、氧气能与碱金属、铁、铜等发生反应,使它们生成氧化物。
6、氧气是强氧化剂,能与一些脆性物质发生反应,使它们分解。
7、氧气与某些有机物发生反应时,可能产生危险的自燃性气体,需要注意安全。
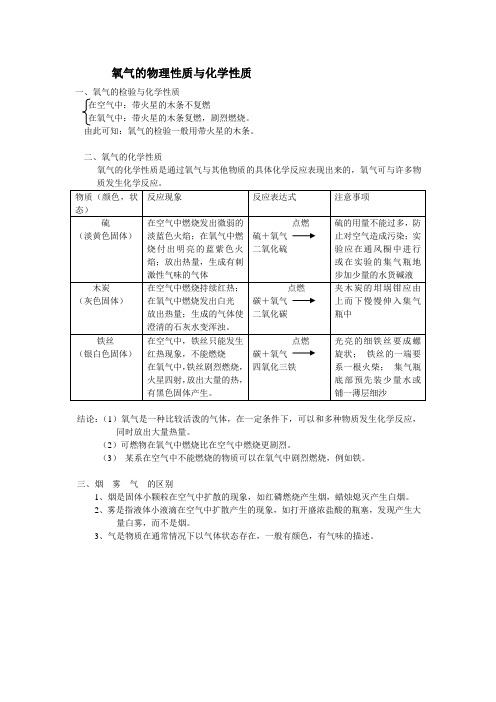
氧气的物理性质与化学性质
一、氧气的检验与化学性质
在空气中:带火星的木条不复燃
在氧气中:带火星的木条复燃,剧烈燃烧。
由此可知:氧气的检验一般用带火星的木条。
二、氧气的化学性质
氧气的化学性质是通过氧气与其他物质的具体化学反应表现出来的,氧气可与许多物
结论:(1)氧气是一种比较活泼的气体,在一定条件下,可以和多种物质发生化学反应,同时放出大量热量。
(2)可燃物在氧气中燃烧比在空气中燃烧更剧烈。
(3)某系在空气中不能燃烧的物质可以在氧气中剧烈燃烧,例如铁。
三、烟雾气的区别
1、烟是固体小颗粒在空气中扩散的现象,如红磷燃烧产生烟,蜡烛熄灭产生白烟。
2、雾是指液体小液滴在空气中扩散产生的现象,如打开盛浓盐酸的瓶塞,发现产生大
量白雾,而不是烟。
3、气是物质在通常情况下以气体状态存在,一般有颜色,有气味的描述。
化学氧气知识点1.物理性质:1颜色、味道和状态:通常为无色无味气体;2密度:标准状况下,密度为1.429g/l,略大于空气;p、 S:一般指20℃,1.01×105pa;标准条件下为0℃,1.01×105pa;3溶解性:氧气不易溶于水4三态变化:冷却后,氧气可以变成淡蓝色的液体,甚至是淡蓝色的雪花状固体。
问题:有什么事实可以证明氧气溶解在天然水中?答:水中的生物依靠水中溶解的氧气生存。
2.化学性质:木炭在氧气中燃烧黑色固体实验现象:剧烈燃烧,发出白光,放热,生成一种无色无味气体,该气体能使澄清石灰水变浑浊。
文字表达式:碳c+氧气o2点燃二氧化碳co2在空气中燃烧:木炭是红热、无烟、无火焰的,产生无色无味的气体2铁丝在氧气中燃烧银白色固体——介绍铝箔在氧气中可以燃烧实验现象:剧烈燃烧,火花四射,铁丝融化成小球,形成黑色固体。
文字表达式:铁fe+氧气o2点燃四氧化三铁fe3o4注意事项:在钢瓶底部放置少量细砂或加入少量水,防止产生的固体物质溅到钢瓶底部,导致钢瓶爆裂。
在空气中加热:持续加热后变红,离开火后变冷。
3蜡烛在氧气中燃烧白色固体实验现象:它比空气中燃烧得更猛烈,发出白光。
集气筒内壁出现水滴,有无色无味的气体使澄清的石灰水浑浊。
文本表达:石蜡+氧气O2点燃二氧化碳CO2水H2O空气中燃烧情况:燃烧产生黄色火焰,放热,稍有黑烟。
4镁带在氧气中燃烧银白色固体实验现象:剧烈燃烧,发出耀眼的白光,放热,生成白色粉末状固体。
字面表达:镁+氧O2点燃氧化镁MgO5铜丝在空气中灼烧红色固体实验现象:加热后,铜线呈红热状态。
冷却后,铜线表面会出现一层黑色材料。
文字表达式:铜cu+氧气o2加热氧化铜cuo6红磷在氧气中燃烧暗红色固体的实验现象:强烈燃烧、白光、热量和大量白烟文字表达式:磷p+氧气o2点燃五氧化二磷p2o5空气中燃烧:黄色和白色火焰,放热,大量白烟,7种其他物质与氧气反应某些物质在一些条件下,与氧气发生缓慢的氧化反应,成为缓慢氧化。
初三化学氧气知识点总结归纳到了初三,我们通过学习化学这门课程,将会了解很多物质的组成、结构、性质及其变化规律,那么你掌握了氧气的相关知识点了吗?下面是店铺为大家整理的初三化学重要知识点,希望对大家有用!初三化学氧气知识点总结归纳1一、氧气的性质1、氧气的物理性质:无色无味的气体,密度比空气的密度略大,不易溶于水。
在一定的条件下可液化成淡蓝色液体或固化成淡蓝色固体。
2、氧气的化学性质:化学性质比较活泼,具有氧化性,是常见的氧化剂。
(1)能支持燃烧:用带火星的木条检验,木条复燃。
(2)氧气与一些物质的反应:参加反应物质与氧气反应的条件,与氧气反应的现象生成物的名称和化学式,化学反应的表达式硫S+O2==SO2(空气中—淡蓝色火焰;氧气中—紫蓝色火焰)铝箔4Al+3O2==2Al2O3碳C+O2==CO2铁3Fe+2O2==Fe3O4(剧烈燃烧,火星四射,放出大量的热,生成黑色固体)磷4P+5O2==2P2O5(产生白烟,生成白色固体P2O5)二、氧气的实验室制法1、药品:过氧化氢和二氧化锰或高锰酸钾或氯酸钾和二氧化锰。
2、反应的原理:(1)过氧化氢:水+氧气(2)高锰酸钾,锰酸钾+二氧化锰+氧气(导管口要塞一团棉花)(3)氯酸钾:氯化钾+氧气3、实验装置4、收集方法:密度比空气大——向上排空气法(导管口要伸到集气瓶底处,便于将集气瓶内的空气赶尽)难溶于水或不易溶于水且不与水发生反应——排水法(刚开始有气泡时,因容器内或导管内还有空气不能马上收集,当气泡连续、均匀逸出时才开始收集;当气泡从集气瓶口边缘冒出时,表明气体已收集满)。
本方法收集的气体较纯净。
5、操作步骤:查:检查装置的气密性。
将药品装入试管,用带导管的单孔橡皮塞塞紧试管。
定:将试管固定在铁架台上点:点燃酒精灯,先使试管均匀受热后对准试管中药品部位加热。
收:用排水法收集氧气离:收集完毕后,先将导管撤离水槽。
熄:熄灭酒精灯。
6、检验方法:用带火星的木条伸入集气瓶内,如果木条复燃,说明该瓶内的气体是氧气。
二、氧气的化学性质
1.木炭在氧气中燃烧
现象:剧烈燃烧,发出白光,放出热量,生成的无色气体能使澄清石灰水变浑浊。
结论:C+O2CO2
2.硫在氧气中燃烧
现象:剧烈燃烧,发出明亮的蓝紫色火焰,放出热量,生成有刺激性气味的气体。
结论:S+O2SO2
3.铁在氧气中燃烧
现象:剧烈燃烧,火星四射,放出大量热,生成的黑色固体。
结论: 3Fe+2O2Fe3O4
铁丝一端要系上一段火柴梗是要引燃铁丝。
装氧气的集气瓶要预先装少量的水或瓶底铺上一层细沙,是为了防止生成的灼热的四氧化三铁跌落炸裂瓶底。
4.蜡烛在氧气中燃烧
现象:火焰十分明亮,发出白光,放出热量,瓶壁有水珠生成,有能使澄清石灰水变浑浊的无色气体生成。
结论:蜡烛+氧气二氧化碳+水
5.磷在氧气中燃烧
现象:剧烈燃烧,发出明亮的黄色火焰,放出热量,生成大量白烟。
结论:4P+5O22P2O5。