药物的构效关系
- 格式:docx
- 大小:10.73 KB
- 文档页数:1

药物的构效的关系山西大同大学医学院药理教研室李进霞1学习目标※掌握药物构效关系的含义;※掌握药物结构产生药效的主要因素;※了解药物的理化性质,电子云密度、立体结构、脂水分配系数和解离度与药效的关系;※了解识别结构特异性和结构非特异性药物;※了解不同类别药物的构效关系。
2构效关系 药物的化学结构和药效之间的关系,简称构效关系(structure-activity relationships SAR)。
3•非特异性结构药物:主要受药物的理化性质的影响•特异性结构药物依赖于药物分子的特异的化学结构,及其某种特异的空间关系,作用于体内特定的受体46(一)药物在作用部位的浓度药物必须药物必须以一定的浓度到达作用部位以一定的浓度到达作用部位,才,才能产生应有的药效该因素与药物的转运(吸收、分布、排泄)密切相关理化性质一、药物产生药效的决定性因素 口服抗疟药 人体胃肠道粘膜血流红细胞膜疟原虫细胞膜疟原虫体内(二)药物和受体的相互作用7受体与配体间的作用具有三个主要特征:①特异性;②饱和性;③高度的亲和力和内在活性。
8(三)其他因素⏹化学稳定性⏹药物的配伍⏹药物剂型⏹给药途径⏹……910二、药物的基本结构对药效的影响具有相同药理作用的药物,将其化学结构中相同的部分,称为基本结构或药效结构 (pharmacophore )或药效团(pharmacophore )ArCOX(CH 2)nN局部麻醉药磺胺类药物NSROCHNOCH 3CH 3COOH青霉素类药物第二节药物理化性质和药效的关系⏹溶解度⏹ 分配系数⏹ 解离度⏹ 官能团1213一、溶解度对药效的影响水是生物系统的基本溶剂–体液血液和细胞浆液的实质都是水溶液脂质的生物膜 包括各种细胞膜、线粒体和细胞核的外膜等二、分配系数对药效的影响分配系数P:药物在互不混溶的非水相和水相中分配平衡后,在非水相中的浓度Co的比值。
即:和水相中的浓度Cw非水相中的浓度C oP =水相中的浓度C w14药物的化学结构决定其水溶性和脂溶性⏹药物分子中引入-COOH、-NH2、-OH等极性基团时→增强水溶性,可使脂水分配系数下降。

药物的构效关系药物的构效关系是指药物分子结构与其生物学活性之间的关系。
通过研究药物的构效关系,可以帮助科学家设计和改进药物分子结构,以提高药物的活性、选择性、药代动力学和毒性等方面的性能。
构效关系研究可以帮助研究人员预测药物分子结构的活性,从而提高药物的有效性,并减少不必要的合成实验和临床试验的成本。
药物的构效关系研究可以从以下几个方面入手:1. 影响药物活性的基本结构单元:通过研究药物分子结构中的基本结构单元的功能和特点,可以发现特定结构单元与药物活性之间的关系。
例如,研究大环、环氧、酮、酯、醚、杂环等基本结构对药物活性的影响。
2. 功能团的关键性质:药物分子中的功能团通常具有决定其生物活性的重要作用。
通过研究不同功能团的性质和作用机制,可以揭示功能团与药物活性之间的关系。
例如,羟基、氨基、羧基等功能团对药物的亲水性、溶解度和代谢途径等方面起到重要的影响。
3. 空间构型的影响:药物分子的空间构型对其生物活性具有重要影响。
通过研究不同空间构型对药物活性的影响,可以揭示空间立体构型与药物相互作用的关系。
例如,立体异构体的研究可以帮助研究人员理解立体结构对药物活性的影响机制。
4. 分子杂化:通过将两种或更多的药物结构和/或配体结构合并为一个新的结构,可以产生具有更高活性和选择性的药物分子。
分子杂化是一种重要的构效关系研究方法,可以通过合并两种结构的优点,从而改善药物的性能。
药物的构效关系研究是一项复杂而综合的工作,除了上述几个方面,还需要考虑诸如药物与靶标分子之间的相互作用、代谢途径、毒性等因素的影响。
通过多种研究方法,如计算化学、分子模拟、合成化学和生物学实验等,来揭示药物的构效关系,可以为药物的设计和优化提供有力的支持。
总之,药物的构效关系研究是药物研究的重要组成部分,它可以帮助科学家了解药物分子结构与其生物学活性之间的关系,从而为药物的设计和优化提供指导。
这项研究需要综合考虑药物的基本结构单元、功能团的特性、空间立体构型以及分子杂化等多个因素,并与药物与靶标的相互作用、代谢途径和毒性等进行综合研究。

药物化学构效关系1.局部麻醉药的构效关系:①亲脂性部分:可变范围较大,可为芳环或芳杂环,但以苯环的作用较强,是局麻药物的必需部位。
当酯类药物苯环的邻位或对位引入给电子集团,如氨基、烷氧基时,局麻作用均较未取代得苯甲酸衍生物强;对氨基苯甲酸酯类苯环的邻位上若再有其他取代基如氯、氨基、烷氧基时,由于位阻作用而延长了酯的水解,因此活性增强,作用时间延长。
②中间连接部分:由羰基部分和烷基部分共同组成。
羰基部分与麻醉药持效时间及作用强度有关,作用持续时间为:酮﹥酰胺﹥硫代酯﹥酯;麻醉作用强度:硫代酯﹥酯﹥酮﹥酰胺。
烷基部分碳原子数以2~3个为好,当烷基部分为—CH2CH2CH2—时,麻醉作用最强。
③亲水性部分:大多数为叔胺,易形成可溶性的盐类。
氮原子上取代基的碳原子总和以3~5时作用最强,也可为酯环胺,其中以哌啶的作用最强。
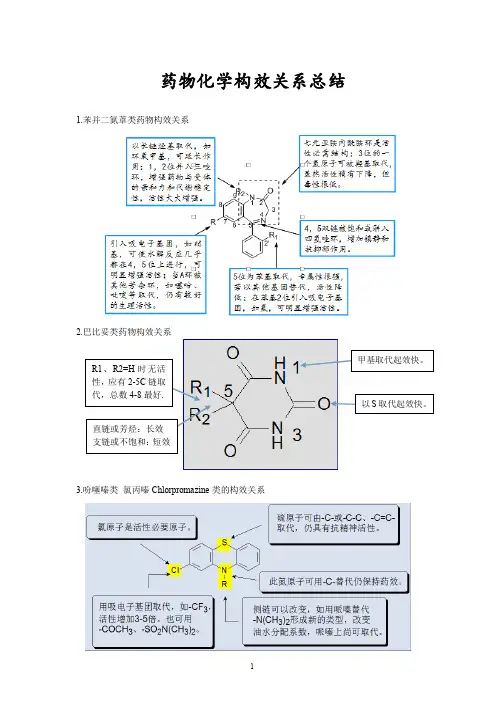
2. 苯二氮卓类药物的构效关系:① 1、2位拼入三氮唑环,使代谢稳定性增加,提高与受体的亲和力,活性显著增加;② 3位引入手性碳,分子构想更稳定,对受体亲和力增强;③ 4、5位引入恶唑环,增强稳定性;④7位有吸电子取代基时,药物活性明显增强,且吸电子性越强,活性增加越明显,NO2>Br>CF3>Cl;⑤ 5位苯环的2’位引入体积较小的吸电子基团如F、Cl,可使活性增强。
①镇静作用的强度和起效快慢,与药物的理化性质有关。
【酸性解离常数pKa】巴比妥酸和5位取代的巴比妥类有较强的酸性,在生理pH=7.4几乎全都电离成离子状态,不易透过血脑屏障,无镇静催眠作用;5,5-二取代的巴比妥类,酸性减弱,生理pH条件下不易电离,易进入脑中发挥作用,显效快,作用强。
【脂水分配系数】5位无取代基时,分子有一定极性,亲脂性强,不易透过血脑屏障,无镇静催眠作用;5位取代基碳原子总数在7~8之间作用最强,若亲脂性过强,作用下降甚至出现惊厥。
药物有最适当的的脂溶性,有利于药物透过细胞膜和血脑屏障,起效快,作用强。

局部麻醉药构sheng效关系1.分类芳酸酯类、酰胺类、氨基醚类、氨基酮类、其他类2.构效关系亲酯部分中间链亲水部分⑴亲脂部分:芳烃或芳杂环,这一部分修饰对理化性质变化大,但苯环作用较强。
苯环上引入给电子取代基,麻醉作用增强,而吸电子取代基则作用减弱。
⑵中间部分:此部分决定药物稳定性,和局麻作用持续时间有关⑶亲水部分:常为仲胺和叔胺,仲胺刺激性较大;烃基链3~4个碳原子作用最强,杂环以哌啶环作用最强巴比妥类药构效关系(1)、分子中5位上应有两个取代基。
(2)、5位上的两个取代基的总碳数以4—8为最好(3)、5位上的两个取代基的总碳数以4—8为最好. (4)、在酰亚胺氮原于上引入甲基,可降低酸性和增加脂溶性。
(5)、将C2上的氧原子以硫原子代替,则脂溶性增加,起效快,作用时间短。
苯二氮卓类药物的构效关系(1)1,3-二氢-5-苯基-2H-1,4-苯二氮卓-2-酮是此类药物基本结构;(2)环A7位引入吸电子取代基活性增加(3)环B为七元亚胺-内酰胺结构是产生药理作用的必要结构(4)5位苯环上的取代基时产生药效的重要结构之一,(5)1,2位的酰胺键和4,5位的亚胺键在酸性条件下易水解开环.吩噻嗪类药构效关系R1 部分必须由三个成直链的碳原子组成,若为支链,与多巴胺受体B 部分立体上不匹配,抗精神病活性明显下降,抗组胺作用增强。
顺式吩噻嗪类药物与多巴胺的优势构象能部分重叠,活性高(当侧链与氯取代的苯环同侧时,成为顺式构象)。
丁酰苯类药物的构效关系(1)丁酰苯基为必需的基本骨架(2)侧链末端连一碱性叔胺(3)苯环的对位一般具有氟取代(4)侧链湠基于碱基之间以三个碳原子最好镇痛药的一般特征(1)分子中具有一个平坦的芳香结构(2)有一个碱性中心能在生理PH条件下大部分电离为阳离子(3)含有哌啶或类似于哌啶的空间结构吗啡的构效关系(半合成类镇痛药)叔胺是镇痛活性的关键基团,氮原子引入不同的取代基可使μ 受体激动剂转变为拮抗剂。

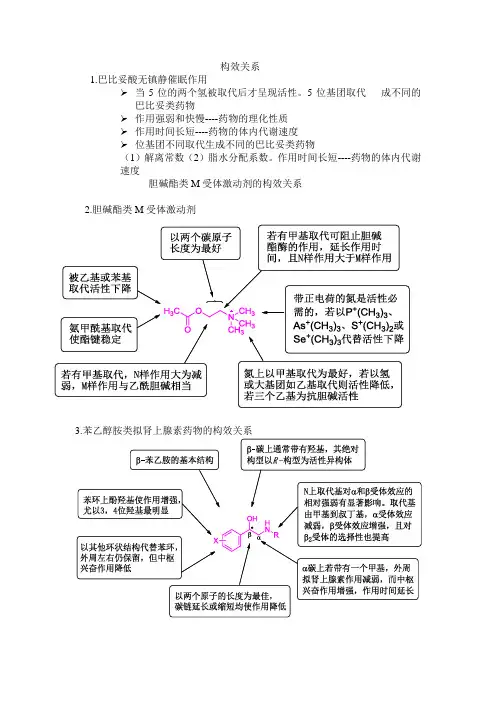
构效关系1.巴比妥酸无镇静催眠作用➢当5位的两个氢被取代后才呈现活性。
5位基团取代成不同的巴比妥类药物➢作用强弱和快慢----药物的理化性质➢作用时间长短----药物的体内代谢速度➢位基团不同取代生成不同的巴比妥类药物(1)解离常数(2)脂水分配系数。
作用时间长短----药物的体内代谢速度胆碱酯类M受体激动剂的构效关系2.胆碱酯类M受体激动剂3.苯乙醇胺类拟肾上腺素药物的构效关系4.局部麻醉药的构效关系亲脂性部分•可为芳烃、芳杂环,以苯环作用较强。
•苯环上邻对位给电子取代基如氨基、烷氧基有利于增加活性;而吸电基会使活性下降。
中间部分-决定药物稳定性•作用时间:-CH2CO->-CONH->-COS->-COO-•作用强度:-COS->-COO-> -CH2CO-> -CONH-•通常以n = 2-3碳原子为最好•在苯环和羰基之间插入-CH2-,-O-,破坏了共轭体系,活性下降;插入-CH=CH-,则保持活性。
亲水性部分•可为仲胺和叔胺,或脂环胺如吡咯烷、哌啶、吗啉等,以叔胺最为常见。
•不可以是伯胺,不稳定而且毒性大。
5.b受体阻滞剂的构效关系1,4-二氢吡啶环是必需结构,吡啶或六氢吡啶环则无活性,1位N不被取代为佳。
2,6-位取代基应为低级烷烃。
若C4有手性,立体结构有选择作用。
4位取代苯基上邻、间位有吸电子基团时活性较佳。
3,5-位取代基酯基是必要结构,-COCH3,-CN活性降低,硝基则激活钙通道。
7.组胺H2受体拮抗剂的构效关系(SAR)9.喹诺酮类抗菌药物的构效关系(1)吡啶酮酸的A 环是抗菌作用必需的基本药效基团,变化较小。
其中3位COOH和4位C=O与DAN螺旋酶和拓扑异构酶Ⅳ结合,为抗菌活性不可缺少的部分。
3位的羧基被磺酸基、乙酸基、磷酸基、磺酰氨基等酸性替团替代以及4位酮羰基被硫酮基、亚氨基等取代均使抗菌活性减弱。
(2)B环可作较大改变,可以是并合的苯环(X=CH,Y=CH)、吡啶环(X=N,Y=CH)、嘧环(X=N,Y=N)等。


药物构效关系药物构效关系一、引言药物构效关系是指药物分子结构与其生物活性之间的关系,即药物分子结构的特定部分对生物活性具有决定性影响的现象。
药物构效关系研究是药物设计和发现的重要基础,能够为新药研究提供指导和支持。
二、药物分子结构与生物活性1. 药效团药效团是指对于一类化合物具有相同或类似生物活性的结构单元。
常见的药效团包括苯环、咪唑环、吡啶环等。
不同的化合物中,同一种或相似的药效团往往具有相似或相同的生物活性。
2. 亲和力亲和力是指药物分子与靶标分子之间的结合力度,通常用Kd值来表示。
亲和力越大,说明两者之间结合越紧密,对应的生物活性也越强。
3. 立体构型立体构型对于化合物的生物活性具有重要影响。
同一种化合物可能存在多种立体异构体,它们之间可能存在巨大差异。
例如,左旋麻黄素具有强烈的生物活性,而右旋异构体则几乎没有生物活性。
三、药物构效关系的研究方法1. QSAR模型QSAR(Quantitative Structure-Activity Relationship)是一种基于药物分子结构与生物活性之间定量关系的建模方法。
通过对已知化合物的结构和生物活性进行统计分析,建立数学模型,预测新化合物的生物活性。
2. 分子对接分子对接是指将药物分子与靶标分子进行结合模拟,预测它们之间的相互作用。
通过计算药物与靶标之间的亲和力、空间位阻等参数,预测化合物的生物活性。
3. 分子动力学模拟分子动力学模拟是一种通过计算机模拟药物分子在溶液中运动状态和相互作用的方法。
通过对化合物在不同条件下运动状态和相互作用进行模拟,预测其可能存在的构象、稳定性等参数。
四、应用举例1. 抗癌药研究抗癌药研究中,常常采用QSAR方法来预测新化合物的抗癌活性。
例如,在顺铂类药物的研究中,通过对不同结构的顺铂类化合物进行QSAR分析,发现其抗癌活性与配体中的氮、硫、氧等原子数目和位置有关。
2. 新型抗菌药研究新型抗菌药研究中,常常采用分子对接方法来预测化合物与靶标之间的相互作用。

药物的构效关系名词解释一、引言药物是人类提取自各种自然或合成物质的化合物,用于治疗、预防和诊断疾病。
药物的研发离不开对其构效关系的深入探索和解释。
构效关系研究的主要目的是揭示药物分子结构与其生物活性之间的关系,以便更好地设计和合成出具有特定疗效的药物分子。
本文将对药物的构效关系名词进行解释,并探讨其在药物研发中的重要性。
二、1.构效关系构效关系是指药物分子的结构特征与其生物活性之间的定量或定性关系。
这种关系可以包括药物分子的空间构型、功能基团的位置、取代基的类型和位置等。
通过研究药物分子结构与生物活性之间的关系,可以为合理设计和优化药物提供理论依据。
2.构效关系研究构效关系研究是指通过实验和计算方法,寻找药物分子结构与其生物活性之间的关系,并进行定量或定性分析。
在构效关系研究中,科学家通常会综合考虑药物分子的物理化学性质、分子对接研究、定量构效关系等方面的内容,以便更好地了解药物分子的结构与生物活性之间的关联。
3.药效团药效团是指药物分子中具有特定生物活性的结构或基团。
药效团可以是药物分子中的一个或多个功能基团,也可以是药物分子中的特定原子团。
通过研究药效团与生物活性之间的关系,可以揭示药物的药理机制,并为药物设计提供重要的指导。
4.定量构效关系定量构效关系是指通过定量方法,系统研究药物结构与生物活性之间的数量关系。
这种研究需要大量的实验数据和统计方法的支持,通过建立数学模型来描述药物分子结构与生物活性之间的关联,从而提供合理的理论指导。
5.取代基效应取代基效应是指在药物分子中,替换或添加不同的取代基会对其生物活性产生明显的影响。
取代基的类型和位置可能会导致药物的效果不同,因此在药物研发中需要充分考虑取代基效应,以优化药物的性能。
三、药物构效关系在药物研发中的重要性药物的构效关系研究在药物研发中具有重要的意义。
通过深入了解药物分子的结构特征与其生物活性之间的关系,可以实现以下几个方面的优化和改进:首先,药物的构效关系研究可以为药物分子的设计合成提供理论指导。

药物的构效关系名词解释
药物的构效关系(Structure-activity relationship,简称SAR)指的是药物的分子结构与其生物活性之间的关系。
药物的构效关系研究的目的是通过改变药物的分子结构来调控其活性、选择性、毒性等性质,以寻求更有效和安全的药物。
通常,药物的构效关系研究包括以下几个方面:
1. 结构基团的重要性:药物的分子结构通常包含多个基团,构效关系研究通过改变这些基团来研究其对药物活性的影响,以确定哪些基团是活性所必需的。
2. 结构活性相关性:药物的分子结构与其生物活性之间存在着一定的相关性,构效关系研究通过分析结构-活性数据,建立定量的结构-活性模型,来预测和优化药物的活性。
3. 结构选择性相关性:药物在生物体内与特定的分子靶标发生相互作用,构效关系研究通过改变药物的分子结构来研究其对不同分子靶标的选择性,以提高药物的疗效和减少副作用。
4. 结构毒性相关性:药物的分子结构可能与其毒性之间存在一定的关系,构效关系研究可以通过改变药物的分子结构来降低其毒性,提高药物的安全性。
总之,药物的构效关系研究对于药物设计和优化具有重要的指导作用,可以帮助科学家更好地理解药物与生物体间的相互作用,为新药的开发提供理论基础。
药物化学构效关系(第二版尤启冬主编)主要药物的构效关系应用抗肿瘤作用机理:1、药物在体内能形成缺电子活泼中间体(碳正离子)或其他具有活泼的亲电性基团的化合物,进而与肿瘤细胞的生物大分子(DNA,RNA,酶)中富电子基团(氨基,巯基,羟基等)发生共价结合,使其丧失活性,致肿瘤细胞死亡。
2、属细胞毒类药物,在抑制和毒害增生活跃的肿瘤细胞的同时,对其它增生较快的细胞产生抑制。
如骨髓细胞、肠上皮细胞、毛发细胞和生殖细胞等。
副作用大:影响造血功能和机体免疫功能,恶心、呕吐、骨髓抑制、脱发等。
氮芥类药物脂肪氮芥:氮原子的碱性比较强,在游离状态和生理PH(7.4)时,易和β位的氯原子作用生成高度活泼的亚乙基亚胺离子,为亲电性的强烷化剂,极易与细胞成分的,亲核中心发生烷基化反应。
脂肪族氮芥:烷化历程是双分子亲核取代反应(SN2),反应速率取决于烷化剂和亲核中心的浓度。
脂肪氮芥属强烷化剂,对肿瘤细胞的杀伤能力也较大,抗肿瘤谱较广;但选择性比较差,毒性也较大。
芳香族氮芥:氮原子与苯环共轭,减弱了碱性,碳正离子中间体,单分子的亲核取代反应。
氮芥类药物及大多数烷化剂主要是通过和,DNA上鸟嘌呤或胞嘧啶碱基发生烷基化,产生DNA链内、链间交联或DNA蛋白质交联而抑制,DNA的合成,阻止细胞分裂。
β-内酰胺类抗生素的化学结构特点:1分子内有一个四元的β-内酰胺环,除了单环β-内酰胺外,该四元环通过N原子和邻近的第三碳原子与另一个五元环或六元环相稠合。
2除单环β-内酰胺外,与β-内酰胺环稠合的环上都有一个羧基。
3所有β-内酰胺类抗生素的β-内酰胺环羰基α-碳都有一个酰胺基侧链。
4β-内酰胺环为一个平面结构,但两稠环不共平面β-内酰胺类药物可抑制粘肽转肽酶的活性和青霉素结合蛋白青霉素构效关系(1)6位的侧链酰胺基团决定其抗菌谱。
改变其极性,使之易于透过细胞膜可以扩大抗菌谱。
例如,在芳环乙酰氨基的α位上引入-NH2、-COOH、和-SO3H等亲水性基团,可以扩大抗菌谱,增强亲水性有利于对革兰阴性菌的抑制作用并能增强对青霉素结合蛋白的亲和力。
药物的构效关系药物的构效关系(Structure-activity relationship, SAR)是指药物的结构与其生物活性之间的关系。
通过研究不同化合物的结构特征和生物活性数据,可以揭示药物分子的作用机制,指导药物设计和优化,提高研发效率和成功率。
药物的构效关系研究对于药物化学、药理学和药代动力学等领域都有重要的意义。
以下是一些常见的构效关系的参考内容:1. 功能团对药效的影响:研究表明,药物分子中的特定功能团如羟基、酰胺、酯等,可以影响药物的生物活性。
例如,对于抗菌药物,羟基和酰胺基团通常与细菌靶标结合,从而发挥药效。
2. 结构类似性对药效的影响:药物分子的结构类似性对于药效也有重要的影响。
通常来说,结构相似的化合物可能具有相似的生物活性。
因此,通过对已知药物结构进行改良和优化,可以获得具有更高活性和选择性的新化合物。
3. 空间构型对药效的影响:药物分子的空间结构对于其与靶标的相互作用和选择性也起着重要作用。
例如,药物分子的立体异构体可能具有不同的生物活性。
研究不同空间构型的药效差异,有助于设计和优化具有更好活性和选择性的药物。
4. 电子结构对药效的影响:电子结构指的是药物分子中原子和键的电荷分布和云密度。
电子结构的差异可以影响药物分子与靶标的相互作用和药效。
例如,芳香环的电子密度与药物的溶解度、生物利用度和靶标的亲和性有关。
5. 氢键和离子键对药效的影响:氢键和离子键是药物分子与靶标相互作用的常见方式。
氢键的强度和方向性可以影响分子的亲和性和选择性。
离子键的形成可以改变药物分子的溶解度和稳定性。
6. 毒性与构效关系:药物的构效关系研究中还要考虑药物的毒性和副作用。
通过研究药物结构与毒性之间的关系,可以优化药物的安全性和耐受性,减少不良反应。
总的来说,药物的构效关系研究可以从多个角度考察药物分子的结构与生物活性之间的关系。
通过深入理解药物分子的作用机制,可以为药物设计和优化提供重要的理论指导。
一、喹诺酮类构效关系:1、A环是必须的药效团,3羧和4酮为抗菌活性不可少的部分;2、B环可以是苯、吡啶、嘧啶;3、1位乙基及环丙基活性强,环丙基最佳(环丙沙星);4、2位取代活性低;5、5位氨基可增强活性.(司帕沙星)6、6位F改善细胞的通透性;7、7位引入杂环,增强抗菌活性,哌嗪最好;8、8位F、甲氧基或与1位成环,增强活性(左氧氟沙星),甲基、甲氧基光毒性减少二、苯二氮卓构效关系要点.1、3位引入羟基(奥沙西泮)降低毒性,并产生手性碳,右旋体作用强。
2、7位有吸电子基可增加活性,吸电子越强,作用越强,其次序为NO 2>Br>CF3>Cl3、5位苯是产生药效的重要基团,5位苯环的2’位引入体积小的吸电子基团.(如F、Cl )可使活性增强。
4、1,2位拼入三氮唑可提高稳定性,并提高与受体的亲和力,活性显著增加。
5、苯环用生物电子等排体噻吩杂环置换,保留活性。
6、1位取代基在体内代谢去烃基,仍有活性。
三、吩噻嗪类药物的构效关系:以氯丙嗪为先导化合物,对吩噻嗪类进行结构改造。
三方面:1、吩噻嗪环上的取代基:吩噻嗪环只有2位引入吸电子基团时可增强活性。
作用强度与吸电子性能成正比,CF3>Cl>COCH3>H>OH。
2位乙酰基可降低药物的毒性和副作用。
2、10位N上的取代基:母核上的10位N原子与侧链碱性氨基之间相隔3个直链碳原子时作用最强,是吩噻嗪类抗精神病药的基本结构。
侧链末端的碱性基团常为叔胺,也可为氮杂环,以哌嗪取代作用最强。
3、三环的生物电子等排体。
四、μ受体选择性激动剂构效关系1、芳环和碱性叔胺氮原子是μ受体激动剂的必要结构部分,二者通过2个或3个碳原子的碳链相连接。
2、芳环3位酚羟基的存在使活性显著增强。
氮原子上以甲基取代活性好,当N-取代基增大到3~5个碳原子时,如烯丙基(纳洛酮)、环丁基甲基时,由激动剂转变为拮抗剂。
3、μ受体选择性激动剂的药效构象相同,其芳环以直立键与哌啶环相连。
构效关系的名词解释
构效关系的名词解释是:药物或其他生理活性物质的化学结构与其生理活性之间的关系,是药物化学的主要研究内容之一。
狭义的构效关系研究的对象是药物,广义的构效关系研究的对象则是一切具有生理活性的化学物质,包括药物、农药、化学毒剂等。
最早期的构效关系研究以直观的方式定性推测生理活性物质结构与活性的关系,进而推测靶酶活性位点的结构和设计新的活性物质结构,随着信息技术的发展,以计算机为辅助工具的定量构效关系成为构效关系研究的主要方向,定量构效关系也成为合理药物设计的重要方法之一。
药物的构效关系:
例如拟胆碱药的化学结构与乙酰胆碱相似,都有季胺或叔胺基团,都能与胆碱受体结合,形成具有活性的复合物,因而表现出相似的作用。
又如,磺胺药与对氨基苯甲酸化学结构相似,因而能与对氨基苯甲酸竞争二氢叶酸合成酶而影响细菌叶酸的代谢。
在具有基本结构的任何一类药物中,药理作用的类型是由它们的基本结构决定的,而它们的药理作用的相对强度,是由基本结构上各个取代基团的性质决定的,如磺胺类药物。
但也有化学结构相似而作用相拮抗的情况,如磺胺与对氨基苯甲酸、氨丙啉与硫胺等。
同时,也有化学结构不同而药理作用相似的情况,如麻黄碱与茶碱。
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表本人。
本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。
如发现本站有涉嫌抄袭侵权/违法违规的内容请联系客服!。
药物的构效关系
药物的构效关系是通过研究药物的分子结构和生物活性之间的关系来揭示药物的作用
机制。
构效关系的研究有助于设计和合成更有效的药物。
药物的分子结构可以通过化学合成或天然来源获得。
药物的分子结构包括分子的骨架、官能团、立体构型等。
在药物的分子结构中,不同的官能团、官能团的位置和立体构型等
因素会对药物的生物活性产生重要影响。
药物的生物活性可以通过化学试验和生物试验来评价。
化学试验主要包括溶解度、稳
定性等方面的评价,而生物试验主要包括体内、体外的药效学和药代动力学研究。
在药物的构效关系研究中,常见的方法包括结构活性关系(SAR)研究和定量构效关系(QSAR)研究。
SAR研究是通过对一系列结构类似但稍有差异的化合物进行生物活性评价,从而寻找
药效与结构之间的关系。
通过SAR研究可以确定哪些结构因素对药物的活性起关键作用,
进而指导设计更活性的药物。
QSAR研究则是将药效与分子结构进行定量相关分析,建立数学模型来预测和优化药物的活性。
通过QSAR研究可以预测药物的活性、选择性、毒性等性质,为药物的设计和优化提供有价值的信息。