物化03_第一定律,功,可逆过程
- 格式:ppt
- 大小:182.50 KB
- 文档页数:18



第一章热力学第一定律一、基本概念系统与环境,状态与状态函数,广度性质与强度性质,过程与途径,热与功,内能与焓。
二、基本定律 热力学第一定律:ΔU =Q +W 。
三、基本关系式1、体积功的计算 δW = -p 外d V恒外压过程:W = -p 外ΔV定温可逆过程(理想气体):W =nRT 1221ln ln p p nRT V V = 2、热效应、焓:等容热:Q V =ΔU (封闭系统不作其他功)等压热:Q p =ΔH (封闭系统不作其他功)焓的定义:H =U +pV ; ΔH =ΔU +Δ(pV )焓与温度的关系:ΔH =⎰21d p T T T C3、等压热容与等容热容:热容定义:V V )(T U C ∂∂=;p p )(T H C ∂∂= 定压热容与定容热容的关系:nR C C =-V p热容与温度的关系:C p ,m =a +bT +cT 2四、第一定律的应用1、理想气体状态变化等温过程:ΔU =0 ; ΔH =0 ; W =-Q =⎰-p 外d V等容过程:W =0 ; Q =ΔU =⎰T C d V ; ΔH =⎰T C d p等压过程:W =-p e ΔV ; Q =ΔH =⎰T C d p ; ΔU =⎰T C d V可逆绝热过程:Q =0 ; 利用p 1V 1γ=p 2V 2γ求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d pC V (㏑T 2-㏑T 1)=nR(㏑V 1-㏑V 2)(T 与V 的关系)C p (㏑T 2-㏑T 1)=nR(㏑P 2-㏑P 1) (T 与P 的关系)不可逆绝热过程:Q =0 ;利用C V (T 2-T 1)=-p 外(V 2-V 1)求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d p2、相变化 可逆相变化:ΔH =Q =n ΔH ; W=-p (V 2-V 1)=-pV g =-nRT ; ΔU =Q +W3、实际气体节流膨胀:焦耳-汤姆逊系数:μJ-T (理想气体在定焓过程中温度不变,故其值为0;其为正值,则随p 降低气体T 降低;反之亦然)4、热化学标准摩尔生成焓:在标准压力和指定温度下,由最稳定的单质生成单位物质的量某物质的定压反应热(各种稳定单质在任意温度下的生成焓值为0) 标准摩尔燃烧焓:…………,单位物质的量的某物质被氧完全氧化时的反应焓第二章 热力学第二定律一、基本概念 自发过程与非自发过程二、热力学第二定律热力学第二定律的数学表达式(克劳修斯不等式)T Q dS δ≥ “=”可逆;“>”不可逆三、熵(0k 时任何纯物质的完美结晶丧子为0)1、熵的导出:卡若循环与卡诺定理(页522、熵的定义:T Q dS r δ=3、熵的物理意义:系统混乱度的量度。
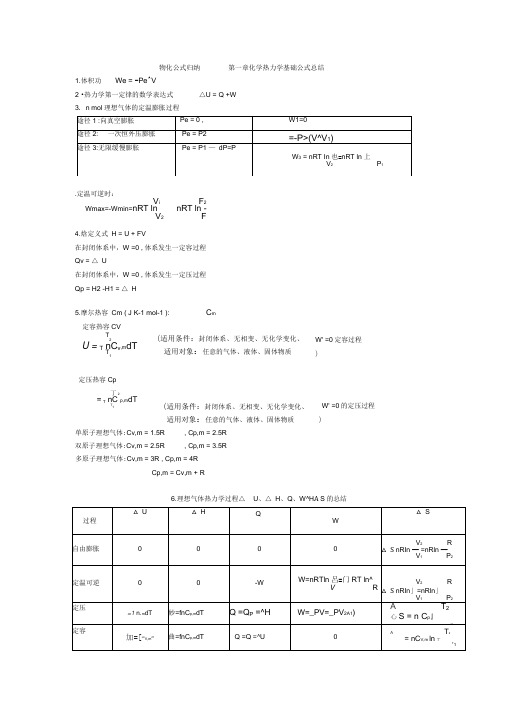
物化公式归纳 第一章化学热力学基础公式总结1.体积功 We = -Pe ^V2 •热力学第一定律的数学表达式△U = Q +W 3. n mol 理想气体的定温膨胀过程 .定温可逆时: V iF 2Wmax=-Wmin=nRT ln nRT ln -V 2F4.焓定义式 H = U + FV 在封闭体系中,W =0 ,体系发生一定容过程 Qv = △ U 在封闭体系中,W =0 ,体系发生一定压过程 Qp = H2 -H1 = △ H5.摩尔热容 Cm ( J K-1 mol-1 ):C m 定容热容CV T2 U = T nC v ,m dTT 1(适用条件:封闭体系、无相变、无化学变化、适用对象:任意的气体、液体、固体物质 W' =0定容过程 )定压热容Cp 丁2= T nC p,m dT T1(适用条件:封闭体系、无相变、无化学变化、W' =0的定压过程适用对象:任意的气体、液体、固体物质 ) 单原子理想气体:Cv,m = 1.5R , Cp,m = 2.5R 双原子理想气体:Cv,m = 2.5R, Cp,m = 3.5R 多原子理想气体:Cv,m = 3R , Cp,m = 4R Cp,m = Cv,m + R6.理想气体热力学过程△ U 、△ H 、Q 、W^H A S 的总结C p dT△ Cp ( T2 - T1)10.热机的效率为 对于卡诺热机 W Q 亠 Q 2Q 2--- zzj -------------- =1 "r : Q Q [ ---------------- Q [W Q 1 Q Q 1Q|★ ~T 2 T 1可逆循环过程不可逆循环过程11.熵变定义式 (体系经历一可逆过程的热温商之和等于该过程的熵变.)7. 定义:△ fHm 9 (kJ mol-1)-- 标准摩尔生成焓 △ H —焓变;△ rHm —反应的摩尔焓变 △ rHm 9 — 298K 时反应的标准摩尔焓变;△ fHm 9 (B) — 298K 时物质B 的标准摩尔生成焓; △ cHm 9 (B) — 298K 时物质B 的标准摩尔燃烧焓。

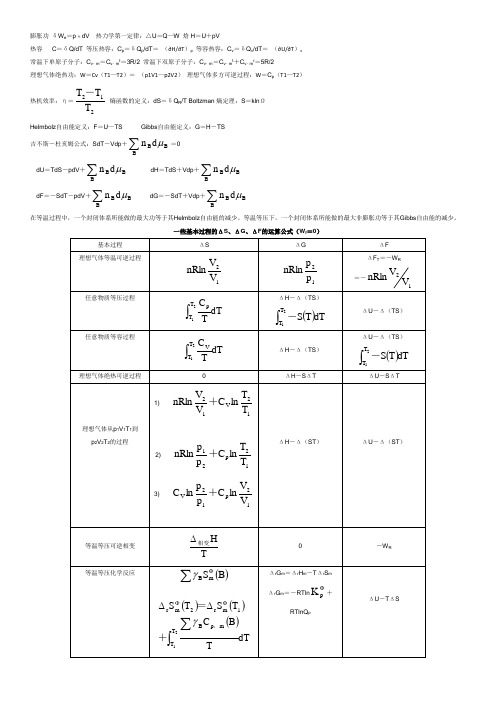
膨胀功 δW e =p 外dV 热力学第一定律:△U =Q —W 焓H =U +pV热容 C =δQ/dT 等压热容:C p =δQ p /dT = (∂H/∂T )p 等容热容:C v =δQ v /dT = (∂U/∂T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2 常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2理想气体绝热功:W =Cv (T1—T2)= (p1V1—p2V2) 理想气体多方可逆过程:W =C p (T1—T2)热机效率:η=212T T T - 熵函数的定义:dS =δQ R /T Boltzman 熵定理:S =kln ΩHelmbolz 自由能定义:F =U —TS Gibbs 自由能定义:G =H -TS 吉不斯-杜亥姆公式:SdT -Vdp +∑BBBd nμ=0dU =TdS -pdV +∑B BBd nμ dH =TdS +Vdp +∑B BBd nμdF =-SdT -pdV +∑BBBd nμ dG =-SdT +Vdp +∑BBBd nμ在等温过程中,一个封闭体系所能做的最大功等于其Helmbolz 自由能的减少。
等温等压下,一个封闭体系所能做的最大非膨胀功等于其Gibbs 自由能的减少。
一些基本过程的ΔS 、ΔG 、ΔF 的运算公式(W f =0)基本过程ΔSΔGΔF 理想气体等温可逆过程12V V nRln12p p nRlnΔF T =-W R=-12V V nRln任意物质等压过程dTTC 21T T p ⎰ΔH -Δ(TS )()dTT S 21T T ⎰-ΔU -Δ(TS )任意物质等容过程dTTC 21T T V ⎰ΔH -Δ(TS )ΔU -Δ(TS )()dTT S 21T T ⎰-理想气体绝热可逆过程ΔH -S ΔT ΔU -S ΔT理想气体从p 1V 1T 1到p 2V 2T 2的过程1)12V 12T T lnC V V nRln+ 2)12p 21T T lnC p p nRln+3)12p 12V V V lnC p p ln C +ΔH -Δ(ST )ΔU -Δ(ST )等温等压可逆相变TH 相变∆-W R等温等压化学反应()B S m B∑Φγ()()()dTTB C T S T S 21T T m p B 1mr 2mr ⎰∑ΦΦ∆∆,+=γΔr G m =Δr H m -T Δr S m Δr G m =-RTln Φp K +RTlnQ pΔU -T ΔS溶液组成的表示法:(1)物质的量分数:B B n x n=(2)质量摩尔浓度:B B An m W =(3)物质的量浓度:B B n c V=(4)质量浓度B ω拉乌尔定律A A A p p x *= 亨利定律:x m B c Bp k x k m k c ===化学势的各种表示式和某些符号的物理意义: 气体:(1)纯理想气体的化学势()()T,p T RT ln ppμμΦΦ=+ 标准态:任意温度,p =p φ=101325Pa 。