2016版优化方案高考化学(浙江专用)二轮复习上篇专题四化学实验基础第十一讲专题强化训练
- 格式:doc
- 大小:437.00 KB
- 文档页数:6


第十二题自选模块——物质结构与性质1.(2015·浙江宁波高三期末)元素周期表第4周期中共有18种元素,请回答下列有关问题。
(1)金属钒(V)在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的外围电子排布式为__________________。
第4周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但Ga的第一电离能却明显低于Zn的,原因是________________________________________________________________________ ________________________________________________________________________。
(2)已知四溴化锗是电子工业中的一种常用试剂,其熔点为26.1 ℃,沸点为186 ℃,则GeBr4晶体的类型为________。
(3)第4周期ⅤA~ⅦA族的元素中,电负性由大到小的顺序为________________________________________________________________________(用元素符号表示)。
2.氟是电负性最大的非金属元素,又因其半径较小,极易和金属元素反应,并将它们氧化到最高价态,生成MnF7、VF5、CaF2等。
氟还可以和氧形成一系列的氟化物,如OF2、O2F2、O4F2等。
请回答下列问题:(1)V原子的核外电子排布式为________________________________________________________________________。
如图所示为一个完整的CaF2晶胞,则图中空心球表示________(填“F-”或“Ca2+”)。
(2)OF2被称为氟化物而不被称为氧化物的原因是________________________________________________________________________ ________________________________________________________________________。
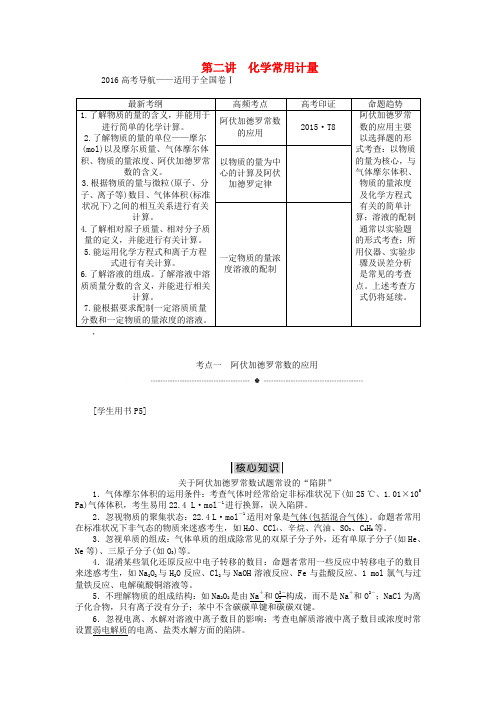
第二讲 化学常用计量2016高考导航——适用于全国卷Ⅰ考点一 阿伏加德罗常数的应用[学生用书P5]关于阿伏加德罗常数试题常设的“陷阱”1.气体摩尔体积的运用条件:考查气体时经常给定非标准状况下(如25 ℃、1.01×105Pa)气体体积,考生易用22.4 L·mol -1进行换算,误入陷阱。
2.忽视物质的聚集状态:22.4 L·mol -1适用对象是气体(包括混合气体)。
命题者常用在标准状况下非气态的物质来迷惑考生,如H 2O 、CCl 4、辛烷、汽油、SO 3、C 6H 6等。
3.忽视单质的组成:气体单质的组成除常见的双原子分子外,还有单原子分子(如He 、Ne 等)、三原子分子(如O 3)等。
4.混淆某些氧化还原反应中电子转移的数目:命题者常用一些反应中转移电子的数目来迷惑考生,如Na 2O 2与H 2O 反应、Cl 2与NaOH 溶液反应、Fe 与盐酸反应、1 mol 氯气与过量铁反应、电解硫酸铜溶液等。
5.不理解物质的组成结构:如Na 2O 2是由Na +和O 2-2构成,而不是Na +和O 2-;NaCl 为离子化合物,只有离子没有分子;苯中不含碳碳单键和碳碳双键。
6.忽视电离、水解对溶液中离子数目的影响:考查电解质溶液中离子数目或浓度时常设置弱电解质的电离、盐类水解方面的陷阱。
7.忽视可逆反应不能进行到底:如2NO2 N 2O 4、2SO 2+O 2催化剂△2SO 3、合成氨反应等。
有关阿伏加德罗常数的正误判断1.(概念应用类)(2015·高考全国卷Ⅰ,T8,6分)N A 为阿伏加德罗常数的值。
下列说法正确的是( )A .18 g D 2O 和18 g H 2O 中含有的质子数均为10N AB .2 L 0.5 mol·L -1亚硫酸溶液中含有的H +离子数为2N AC .过氧化钠与水反应时,生成0.1 mol 氧气转移的电子数为0.2N AD .密闭容器中2 mol NO 与1 mol O 2充分反应,产物的分子数为2N A[破题关键] D 2O 和H 2O 为10电子分子,但摩尔质量不同;亚硫酸为弱酸,不能完全电离;Na2O 2中O 元素为-1价,产生1 mol 氧气转移2N A 个电子;由于2NO 2 N 2O 4的存在,故NO 2分子数会减少。


仿真模拟训练(四)(时间:45分钟,满分:100分)一、选择题(本题包括7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
)7.(2015·浙江台州高三调考)下列说法不正确的是()A.合成氨反应在低温下能够自发进行,是因为反应物键能之和大于生成物键能之和B.元素分析仪可以确定物质中是否含有C、H、O、N、S、Cl、Br等元素,原子吸收光谱可以确定物质中含有哪些金属元素C.人们利用元素周期律在过渡元素中寻找各种性能优良的催化剂,以降低化学反应的活化能,从而起到很好的节能效果D.超高分辨率荧光显微镜能够观察到纳米尺度的物质,用它可以获得蛋白质溶液中的分子图像8.下列图示实验正确的是()9.(2015·浙江东北三校高三四模)下列说法不正确的是()A.等物质的量的甲烷、乙烯、乙酸乙酯分别在空气中充分燃烧,所耗用氧气的量依次增多B.由单体CH2===CH—CH===CH2和CH2===CH—CN可合成C.三硬脂酸甘油酯的分子式是C57H110O6,它不能使酸性KMnO4溶液褪色D.一个甘氨酸(H2N—CH2—COOH)分子和一个丙氨酸()分子脱水缩合最多可形成5种有机分子10.X、Y、R、Q是短周期元素,R、Q和X、Y分别处于同一周期,R、Y处于同一主族,Q2-和X2+具有相同的电子层结构,其中Q是地壳中含量最高的元素,R最外层电子数是次外层的2倍。
下列说法正确的是()A.离子半径:Q2->X2+B.原子序数:Y>R>QC.简单气态氢化物的稳定性:R>Q>YD.原子最外层电子数:X>Y>Q11.锂-空气电池能够提供相当于普通锂离子电池10倍的能量,因此它是最有前途的电池技术之一。
如图是锂-空气电池放电和充电时的工作示意图。
下列说法正确的是()A.a极为原电池的正极B.电池充电时,b极发生的反应为O2+2H2O+4e-===4OH-C.放电时,a极锂的化合价未发生变化D.充电时,溶液中Li+由b极向a极迁移12.(2015·浙江嘉兴高三教学测试)常温下0.10 mol·L-1亚硫酸溶液中H2SO3、HSO-3、SO2-3三者所占物质的量分数(α)随pH变化的关系如图所示。

1.由不同种类的原子组成的物质可能是()①纯净物②混合物③单质④化合物⑤金属⑥非金属⑦酸⑧碱⑨盐⑩氧化物A.①③⑤⑦⑨B.②④⑥⑧⑩C.①③D.全部解析:选D。
H和Cl能组成氯化氢(属于酸、化合物、纯净物);He和Ne组成的混合气体属于混合物;由同位素11H和21H能组成氢气(属于非金属、单质);由同位素39K和40K能组成金属钾(属于金属、单质);Na和Cl能组成氯化钠(属于盐、纯净物、化合物);Na和O、H能组成氢氧化钠(属于碱、纯净物、化合物);Na和O能组成氧化钠(属于氧化物、纯净物、化合物),故选D。
2.下列变化中,前者是物理变化,后者是化学反应,且都有明显颜色变化的是() A.打开盛装NO的集气瓶;冷却NO2气体B.用冰水混合物冷却SO3气体;加热氯化铵晶体C.木炭吸附NO2气体;将氯气通入品红溶液中D.向品红溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液解析:选C。
打开盛装NO的集气瓶和冷却NO2气体都会发生化学反应,不符合题意;用冰水混合物冷却SO3气体是物理变化,加热氯化铵晶体发生化学反应,但两者均无颜色变化,不符合题意;木炭吸附NO2气体是物理变化,将氯气通入品红溶液中发生化学反应,且两者均有颜色变化,符合题意;向品红溶液中加入Na2O2和向FeCl3溶液中滴加KSCN溶液均发生化学反应,不符合题意。
3.下列有关物质的性质、应用等的说法正确的是()A.SiO2不能溶于任何酸B.在同浓度、同体积的碳酸钠和碳酸氢钠溶液中,各加入两滴酚酞试液,碳酸氢钠溶液中红色较深C.浓硫酸能干燥SO2等气体,说明浓硫酸具有脱水性D.铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料解析:选D。
A项,SiO2能溶于氢氟酸,错误;B项,同浓度、同体积的碳酸钠和碳酸氢钠溶液,碳酸钠溶液碱性强,各加入两滴酚酞试液后碳酸钠溶液中红色较深,错误;C项,浓硫酸能干燥SO2等气体是利用了浓硫酸的吸水性,错误。
1.下列说法一定不正确的是()A.某些花岗石产生氡(22286Rn),从而对人体产生伤害,22286Rn 的质量数是222B.Se是人体必需的微量元素,7834Se和8034Se互为同位素C.23592U的浓缩一直被国际社会关注,23592U与23892U是两种不同的核素D.136C-NMR(核磁共振)可用于含碳化合物的结构分析,136C的中子数为6解析:选D。
元素左上角的数字表示质量数,A正确;质子数相同而中子数不同的同一元素的不同核素互为同位素,B正确;核素是指具有一定数目质子和一定数目中子的一种原子,C正确;质量数为13的碳原子,其中子数为7,D错误。
2.(2015·浙江温州一模)元素的原子结构决定其性质和在元素周期表中的位置。
下列说法正确的是()A.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素B.某微粒的结构示意图为,则该元素在周期表中位于第3周期第ⅥA族C.Be(OH)2的碱性比Mg(OH)2的碱性强D.原子半径:Na>Si>O解析:选D。
元素周期表中位于金属和非金属分界线附近的元素属于半导体元素,过渡元素在副族和Ⅷ族中,A错误;该微粒是氯离子,氯元素在周期表中位于第3周期第ⅦA族,B 错误;同主族中,Be的金属性比Mg的金属性弱,则Be(OH)2的碱性比Mg(OH)2的碱性弱,C错误;同周期中原子半径Na>Si>S,同主族中S>O,故原子半径Na>Si>O,D正确。
3.(2015·浙江东阳高三模拟)短周期主族元素X、Y、Z、W、Q的原子序数依次增大,Y 原子的核外电子数是内层电子数的4倍,X的气态氢化物极易溶于Y的氢化物中,常温下,Z 的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。
下列说法不正确的是()A.元素Q的最高价氧化物对应的水化物酸性比W的强B.化合物W2Q2中,各原子最外层均达8电子结构C.工业上通过电解Z与Q形成的化合物制备Z单质D.Y单质与X的气态氢化物可发生置换反应解析:选C。
1.(2015·高考安徽卷)下列有关实验的选项正确的是()解析:选B。
A.配制溶液时,固体不能在容量瓶中溶解,应在烧杯中溶解,溶液恢复至室温后再转入容量瓶中。
B.在通过NaOH溶液时,CO中的CO2气体被吸收,而CO不能被吸收。
C.由于苯的密度比水的小,故含I2的苯溶液应从上口倒出,而不是从下口放出。
D.滴定管的小刻度在上,即越向下刻度越大,故读数为11.80 mL。
2.(2015·浙江丽水高三统考)下列有关实验的叙述,正确的是()A.燃着的酒精灯不慎碰倒失火,应立即用湿布盖灭B.酸碱中和滴定实验中,滴定管和锥形瓶都要用待装溶液润洗C.用浓氨水洗涤做过银镜反应的试管D.测某溶液的pH时,将pH试纸浸入待测溶液中,过一会儿取出,与标准比色卡进行对比解析:选A。
B项,酸碱中和滴定实验中,锥形瓶不需要用待装溶液润洗;C项,浓氨水和银不反应,应用稀硝酸洗涤做过银镜反应的试管;D项,测某溶液的pH时,应将pH试纸放在表面皿或玻璃片上,用玻璃棒蘸取待测液点在试纸中央,待试纸变色后,与标准比色卡进行对比。
3.(2015·浙江嘉兴高三一模)化学教材中,常借助示意图表达实验装置的要点、阐述化学过程的原理等。
下列有关示意图表现的内容一定不正确的是()解析:选B。
A中的橡胶管使分液漏斗和烧瓶内的气体压强相同,分液漏斗中的液体借助重力作用能顺利流下,A正确;乙醇和乙酸互溶,无法用分液漏斗分离,B错误;C中将止水夹夹紧,关闭分液漏斗下端的活塞,向分液漏斗中加入一定量的水,再打开分液漏斗下端的活塞,分液漏斗中的水滴入烧瓶数滴后不能继续滴下,表明气密性良好,C正确;D中从短管进气可收集氨气,D正确。
4.(2015·浙江八市联考)仅用下表提供的仪器和药品,就能达到相应实验目的的是()解析:选A。
B项,要证明非金属性:Cl>C>Si,需要通过酸性:HClO4>H2CO3>H2SiO3来证明,药品中给的是盐酸而不是HClO4,故达不到实验目的;C项,缺少锥形瓶和酸碱指示剂,无法完成滴定实验;D项,提纯混有MgCl2杂质的AlCl3溶液需要利用过量的NaOH溶液把MgCl2转化为Mg(OH)2沉淀,然后过滤,向滤液中加入适量的盐酸将NaAlO2再转化为AlCl3,过滤需要的仪器中缺少漏斗和玻璃棒,药品中缺少盐酸,无法完成实验。
5.(2015·浙江台州高三质检)某澄清透明溶液中,可能大量存在下列离子中的若干种:H+、NH+4、K+、Mg2+、Cu2+、Br-、AlO-2、Cl-、SO2-4、CO2-3。
进行实验:①用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先变浑浊后又变澄清,有无色气体放出。
将溶液分成两份。
②在一份溶液中逐滴加入NaOH溶液至过量,溶液先变浑浊后又变澄清,加热,将湿润的红色石蕊试纸置于试管口,未见明显现象。
③在另一份溶液中加入新制的氯水和CCl4,振荡后静置,下层溶液显橙红色。
根据实验,下列推断正确的是()A.溶液中一定有K+、Br-、CO2-3、AlO-2B.溶液中一定有Mg2+、Cu2+、Cl-、NH+4C.不能确定溶液中是否有H+、K+、SO2-4、Cl-D.溶液中一定有NH+4、Mg2+、Br-、CO2-3解析:选A。
根据实验①可知,溶液中逐滴加入稀盐酸至过量,溶液先变浑浊后又变澄清,说明溶液中存在AlO-2,有无色气体放出,说明溶液中存在CO2-3,根据离子共存原则可知,能与AlO-2反应的H+、NH+4和能与CO2-3形成沉淀的Mg2+、Cu2+均不存在。
在实验①中,AlO-2已经转变为Al3+,根据实验②可知加入NaOH溶液至过量,溶液先变浑浊后又变澄清,应为Al3+→Al(OH)3→AlO-2,进一步证明原溶液中有AlO-2,同时没有Mg2+、Cu2+,而加热后,湿润的红色石蕊试纸在试管口无明显现象,也进一步证明原溶液中无NH+4,由电荷守恒可知,原溶液中必存在K+。
由实验③可知,原溶液中存在Br-。
综上所述,原溶液中一定有AlO-2、CO2-3、Br-、K+,一定没有H+、NH+4、Mg2+、Cu2+,不能确定有无Cl-、SO2-4,因此只有A项正确。
6.(2015·浙江金华十校高三模拟)下列说法不正确的是()A.用干燥洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pHB.实验时受溴腐蚀致伤,先用苯或甘油清洗伤口,再用水洗C.可用重结晶法提纯含少量NaCl的KNO3晶体D.容量瓶、滴定管上都标有使用温度,容量瓶无“0”刻度,滴定管有“0”刻度;使用前水洗后滴定管还需润洗,而容量瓶不需要润洗解析:选A。
NaClO具有强氧化性,不能用pH试纸测其pH,A项错误;溴易溶于苯和甘油,在实验室发生溴腐蚀致伤时,应先用苯或甘油清洗伤口,再用水洗,B项正确;含少量NaCl的KNO3晶体,用冷却热饱和溶液的方法结晶提纯,形成KNO3饱和溶液使KNO3从混合溶液中结晶析出,并可采用多次结晶的方法,提纯含少量NaCl的KNO3晶体,C项正确;容量瓶上标有温度、规格、刻度线,滴定管上标有温度、规格,容量瓶无“0”刻度,滴定管“0”刻度在最上面,使用前滴定管水洗后还需润洗,但容量瓶水洗后不用润洗,D项正确。
7.将某黑色固体A加热至红热,投入到一种无色浓溶液B中,产生由两种气体组成的混合气体X,将X进行如图所示的实验:下列说法正确的是()A.无色气体C为CO2B.无色气体E为O2C.混合气体X为无色D.D和F反应生成的气体E是NO解析:选D。
由题意可推出A和B分别为碳和浓硝酸,X为二氧化碳、二氧化氮的混合气体,二氧化氮为红棕色,故C项错误;C为二氧化碳、一氧化氮的混合气体,故A项错误;E、F、G分别为一氧化氮、铜、硝酸铜溶液,故B项错误;稀硝酸与铜反应生成无色气体一氧化氮,故D项正确。
8.下面a~e是中学化学实验中常见的几种定量仪器:a.量筒b.容量瓶c.滴定管d.托盘天平e.温度计(1)其中标出仪器使用温度的是________(填编号,下同)。
(2)实验时用来精确量取液体体积的是________。
(3)使用前要检查仪器是否漏液的是________。
(4)由于操作错误,使得到的数据比正确数据偏小的是________。
A.中和滴定达终点时俯视滴定管内液面的读数B.使用容量瓶配制溶液时,俯视刻度线定容所得溶液的浓度(5)称取10.5 g固体样品(1 g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为______g。
解析:(1)所有测量体积的仪器如量筒、容量瓶、滴定管等都标出使用温度。
(2)量筒是粗略测量液体体积的仪器,容量瓶是定容仪器,滴定管是精确量取液体体积的仪器。
(3)容量瓶和滴定管在使用前要检查是否漏液。
(4)A中操作导致读数结果偏小,读数时视线应与凹液面最低处相平;B中操作所配制溶液的体积偏小,根据c=nV可知溶液浓度偏大。
(5)从题给信息可知砝码质量为10 g,游码表示的质量为0.5 g。
托盘天平使用时,称量物体应放在左盘,砝码放在右盘:m(物)=m(游码)+m(砝码)。
若称量的样品与砝码颠倒,则m(物)+m(游码)=m(砝码),m(物)=m(砝码)-m(游码)=10 g-0.5 g=9.5 g。
答案:(1)abc(2)c(3)bc(4)A(5)9.59.某学习兴趣小组探究氨气的制取实验:(1)甲同学拟用下列实验方法制备氨气,其中合理的是________(填序号,下同)。
A.将氯化铵固体加热分解B.将浓氨水滴入氢氧化钠固体中C.将氢氧化钠固体加入浓氨水中D.将氯化铵稀溶液滴入氢氧化钠固体中(2)根据上述正确的原理,该同学欲用下列常见的实验室制气装置制取氨气,适宜的装置是________。
(3)气体的性质是气体收集方法选择的主要依据,下列性质与收集方法无关的是________。
①密度②颜色③溶解性④热稳定性⑤与氧气是否反应(4)下图是甲同学设计收集氨气的几种装置,其中可行的是________,集气的原理是________________________________________________________________________ ________________________________________________________________________。
解析:(1)A.加热氯化铵产生氯化氢和氨气,遇冷又转化为氯化铵固体,不能用来制取氨气;B.用浓氨水与氢氧化钠固体混合制氨气时,将浓氨水滴入氢氧化钠固体中更方便操作,而且节约氨水的用量;D.氨气极易溶于水,若用稀溶液制取,产量较少。
(2)根据(1)中所选原理可知该反应不需要加热。
(3)收集气体可采用排空气法(气体密度比空气大或小、不能被氧气氧化等),也可采用排水法(气体不易溶于水),与气体的颜色和热稳定性无关。
(4)氨气极易溶于水,采用向下排空气法收集。
答案:(1)B(2)C(3)②④(4)d利用氨气密度小于空气,采用短管进氨气,长管出空气,即可收集氨气10.(2015·高考全国卷Ⅰ)草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。
草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。
草酸晶体(H2C2O4·2H2O)无色,熔点为101 ℃,易溶于水,受热脱水、升华,170 ℃以上分解。
回答下列问题:(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
装置C中可观察到的现象是________________________________________________________________________ ________________________________________________________________________,由此可知草酸晶体分解的产物中有____________。
装置B的主要作用是________________________________________________________________________ ________________________________________________________________________。
(2)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
D E FG H I①乙组同学的实验装置中,依次连接的合理顺序为A、B、____________________。
装置H反应管中盛有的物质是________。
②能证明草酸晶体分解产物中有CO的现象是________________________________________________________________________ ________________________________________________________________________。