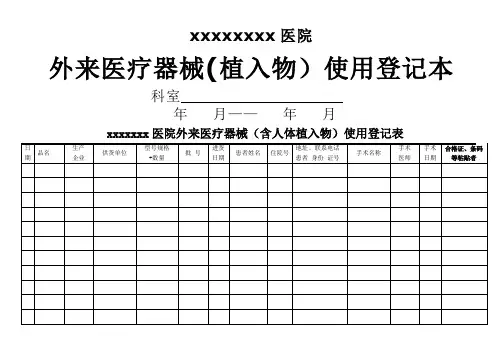
外来医疗器械使用登记本 (1)
- 格式:docx
- 大小:12.37 KB
- 文档页数:2

医疗器械注册登记表(范文模版)第一篇:医疗器械注册登记表(范文模版)医疗器械注册登记表是什么?所谓的医疗器械产品注册登记表,也就是医疗器械的“副本”,医疗器械注册证包括注册登记表,一般记载:生产企业名称,企业注册地址,生产地址,型号规格,产品标准,产品性能结构及组成,产品适用范围产品禁忌症等内容(此为国产医疗器械的注册登记表)。
(奥咨达医疗器械咨询)另外,2000年《医疗器械注册管理办法》(已作废)规定(第一章第四条):(1)境内企业生产的医疗器械注册证附有《医疗器械产品生产制造认可表》,与证书同时使用;(2)境外企业申请办理的产品注册证附有《医疗器械产品注册登记表》,与证书同时使用。
(只专注于医疗器械)综上,注册登记表和生产制造认可表是相同的东西,都是附属于医疗器械产品注册证的。
第二篇:医疗器械注册管理办法医疗器械注册管理办法【颁布单位】国家药品监督管理局【颁布日期】20000405 【实施日期】20000410 【题注】《医疗器械注册管理办法》于2000年3月27日经国家药品监督管理局局务会审议通过,现予发布,自2000年 4月10日起施行。
国家药品监督管理局局长:郑筱萸二OOO年四月五日第一章总则第一条为规范医疗器械产品的注册管理,保证医疗器械安全有效,根据《医疗器械监督管理条例》,制定本办法。
第二条在中国境内销售、使用的医疗器械产品均应按本办法的规定申报注册,未经核准注册的医疗器械,不得销售使用。
第三条国家对医疗器械实行分类注册。
境内企业生产的第一类医疗器械由设区市药品监督管理部门审查,批准后发给产品注册证书。
境内企业生产的第二类医疗器械由省级药品监督管理部门审查,批准后发给产品注册证书;境内企业生产的第三类医疗器械由国家药品监督管理局审查,批准后发给产品注册证书;境外企业生产的医疗器械由国家药品监督管理局审查,批准后发给产品注册证书。
境内企业生产的医疗器械系指最终生产程序在中国境内完成的产品。
![2024版医疗器械使用培训记录表(A4版)[1]](https://uimg.taocdn.com/c535e3fe64ce0508763231126edb6f1aff0071c4.webp)


备案编号:第一类医疗器械备案表(格式)产品名称(产品分类名称):备案人名称:—1—填表说明1.本表用于进口和境内第一类医疗器械、体外诊断试剂备案。
2.要求填写的栏目内容应使用中文、完整、清楚、不得空白,无相关内容处应填写“∕”。
因备案表格式所限而无法填写完整时,请另附附件。
3.境内医疗器械、体外诊断试剂只填写备案人名称、住所和生产地址中文栏。
进口医疗器械、体外诊断试剂备案人的住所和生产地址中文栏自行选择填写。
进口医疗器械、体外诊断试剂备案人名称、进口医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中文栏必填。
4.进口医疗器械、体外诊断试剂产品名称、备案人名称、住所和生产地址原文栏必填,原文填写内容应与备案人住所或生产地所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件中载明内容和文种一致。
如备案系统不支持原文文种填写,则原文栏填写英文,英文内容必须与原文一致。
5.境内医疗器械备案人应填写统一社会信用代码。
6.进口医疗器械、体外诊断试剂产品名称、备案人名称、住所和生产地址英文栏必填。
如原文非英文,英文内容必须与原文一致。
7.所填写各项内容应与所提交备案材料内容相对应。
8.医疗器械产品分类编码均使用《第一类医疗器械产品目录》的分类编码,分类编码填写为“子目录编号-一级产品类别编号-二级产品类别编号”。
体外诊断试剂分类编码为“6840”。
组合包类产品以包内对其预期用途起主要作用的医疗器械的分类编码作为该组合包的分类编码。
9.备案人、代理人住所栏填写备案人和代理人企业营业执照等相关关联文件上载明的住所。
10.备案人、代理人所在地系指备案人和代理人住所所在国家(地区)或省(区、市)。
11.境内备案人委托生产的,应当填写受托企业名称及其统一社会信用代码。
12.如有其他需要特别说明的问题,请在本表“其他需要说明的问题”栏中说明。
—2——3——4—。

第一类医疗器械备案表产品名称(产品分类名称):备案人:成都市食品药品监督管理局制填表说明1. 本表用于进口和境内第一类医疗器械、体外诊断试剂备案。
2. 要求填写的栏目内容应使用中文、打印完整、清楚、不得空白,无相关内容处应填写“∕” 因备案表格式所限而无法填写完整时,请另附附件。
3. 备案时应一并提交含有备案表内容(含附件)的电子文档(Excel 形式)。
4. 境内医疗器械、体外诊断试剂只填写备案人名称、注册地址和生产地址中文栏。
进口医疗器械、体外诊断试剂备案人名称、注册地址和生产地址中文栏自行选择填写。
进口医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中文栏必填。
5. 如系统支持,则进口医疗器械产品名称、备案人名称、注册地址和生产地址原文栏必填,原文填写内容应与备案人注册地址或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件中载明内容和文种一致。
6. 境内医疗器械备案人应填写组织机构代码。
7. 进口医疗器械产品名称、备案人名称、注册地址和生产地址英文栏必填。
如原文非英文,英文内容必须与原文一致。
8. 所填写各项内容应与所提交备案材料内容相对应。
9. 产品类别及分类编码应根据医疗器械分类规则和医疗器械分类目录、第一类医疗器械产品目录、第一类体外诊断试剂分类子目录等相关文件填写。
10. 备案人、代理人注册地址栏填写备案人和代理人企业营业执照等相关证明性文件上载明的注册地址。
11. 备案人、代理人所在地系指备案人和代理人注册地址所在国家(地区)或省(区、市)。
12. 如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
应附资料1.产品风险分析资料□2.产品技术要求□3.产品检验报告□4.临床评价资料□5.生产制造信息□6.产品说明书及最小销售单元标签设计样稿□7.证明性文件□8.符合性声明□□其他需要说明的问题备案人/ 代理人(签章)日期:年月日第一类医疗器械备案变更表共页,第页共页,第页注:如实申报,填写完整、规范第一类医疗器械备案凭证补发表受理号:共页,第页共页,第页注:如实申报,填写完整、规范。

医疗器械登记表一、产品信息1. 产品名称:________________________2. 产品分类:________________________3. 产品型号:________________________4. 生产商:___________________________5. 产地:_____________________________二、技术参数1. 产品规格:________________________2. 适用范围:________________________3. 材质:_____________________________4. 功能:_____________________________5. 外观尺寸:_________________________长度:_____________________________宽度:_____________________________高度:_____________________________6. 重量:_____________________________三、注册证信息1. 注册证编号:______________________2. 注册证有效期:____________________3. 发证机构:________________________四、市场准入信息1. 参考标准:________________________2. 法规要求:________________________3. 产品检验报告:____________________五、生产许可信息1. 生产许可证编号:__________________2. 许可证有效期:____________________3. 发证机构:________________________六、质量管理体系1. ISO质量管理体系认证:_____________认证编号:________________________认证有效期:______________________2. 生产过程控制方法:_________________七、产品功效与安全性评价1. 产品功效:________________________2. 安全性评价报告:__________________八、临床试验报告1. 临床试验目的:____________________2. 试验结果:________________________九、不良事件监测与报告1. 不良事件监测报告:_________________监测结果:________________________2. 不良事件报告:_____________________报告数量:________________________十、产品存储与运输条件1. 存储条件:________________________2. 运输条件:________________________十一、售后服务1. 售后服务机构:____________________2. 联系人:__________________________3. 联系电话:________________________十二、其他备注_______________________________________________________________________________________________________________以上是本医疗器械的登记表,所有填写的信息必须准确无误。


第⼀类医疗器械备案(变更、补发、取消)表格第⼀类医疗器械备案表产品名称(产品分类名称):备案⼈:成都市⾷品药品监督管理局制填表说明1.本表⽤于进⼝和境内第⼀类医疗器械、体外诊断试剂备案。
2.要求填写的栏⽬内容应使⽤中⽂、打印完整、清楚、不得空⽩,⽆相关内容处应填写“⁄”。
因备案表格式所限⽽⽆法填写完整时,请另附附件。
3.备案时应⼀并提交含有备案表内容(含附件)的电⼦⽂档(Excel形式)。
4.境内医疗器械、体外诊断试剂只填写备案⼈名称、注册地址和⽣产地址中⽂栏。
进⼝医疗器械、体外诊断试剂备案⼈名称、注册地址和⽣产地址中⽂栏⾃⾏选择填写。
进⼝医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中⽂栏必填。
5.如系统⽀持,则进⼝医疗器械产品名称、备案⼈名称、注册地址和⽣产地址原⽂栏必填,原⽂填写内容应与备案⼈注册地址或⽣产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明⽂件中载明内容和⽂种⼀致。
6.境内医疗器械备案⼈应填写组织机构代码。
7.进⼝医疗器械产品名称、备案⼈名称、注册地址和⽣产地址英⽂栏必填。
如原⽂⾮英⽂,英⽂内容必须与原⽂⼀致。
8.所填写各项内容应与所提交备案材料内容相对应。
9.产品类别及分类编码应根据医疗器械分类规则和医疗器械分类⽬录、第⼀类医疗器械产品⽬录、第⼀类体外诊断试剂分类⼦⽬录等相关⽂件填写。
10.备案⼈、代理⼈注册地址栏填写备案⼈和代理⼈企业营业执照等相关证明性⽂件上载明的注册地址。
11.备案⼈、代理⼈所在地系指备案⼈和代理⼈注册地址所在国家(地区)或省(区、市)。
12.如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
注:填表前,请详细阅读填表说明第⼀类医疗器械备案变更表共页,第页第⼀类医疗器械备案凭证补发表受理号:共页,第页共页,第页注:如实申报,填写完整、规范。
第⼀类医疗器械备案取消表受理号:注:如实申报,填写完整、规范。

医疗器械表格-设施设备档案表一、员工培训签到表----------------------------------------------2二、员工个人培训记录-------------------------------------------3三、个人健康档案表----------------------------------------------4四、直接接触器械人员健康状况汇总表-----------------------5五、设施设备档案表-----------------------------------------------6六、设施设备使用记录--------------------------------------------7七、设施设备维护保养记录--------------------------------------8八、采购退出通知单-----------------------------------------------9九、购进器械验收记录--------------------------------------------10十、医疗器械销售记录--------------------------------------------11十一、医疗器械出库复核记录-----------------------------------12十二、销后退回器械审批表--------------------------------------13十三、器械追回通知单--------------------------------------------14十四、不合格产品处理记录--------------------------------------15 十五、不合格器械报损审批表-----------------------------------16 十六、质量投诉记录表--------------------------------------------17 十七、产品维修登记表--------------------------------------------18 十八、售后服务登记表--------------------------------------------19 十九、质量事故和不良事件报告记录表-----------------------20 二十、器械召回记录-----------------------------------------------21 二十一、器械召回确认联系函-----------------------------------22 二十二、医疗器械拆零管理记录--------------------------------23员工培训签到表员工个人培训记录所在部门:个人健康档案表直接接触器械人员健康状况汇总表年度设施设备档案表建档日期:年月日设施设备使用记录设备名称:设备编号:设施设备维护保养记录采购退出通知单购进器械验收记录医疗器械表格-设施设备档案表医疗器械销售记录医疗器械表格-设施设备档案表医疗器械出库复核记录医疗器械表格-设施设备档案表销后退回器械审批表退货单位:年月日注:本表存仓储部器械追回通知单器械追回通知单不合格产品处理记录医疗器械表格-设施设备档案表不合格器械报损审批表质量投诉记录表产品维修登记表售后服务记录表质量事故和不良事件报告记录表器械召回记录医疗器械表格-设施设备档案表器械召回确认联系函医疗器械拆零管理记录医疗器械表格-设施设备档案表医疗器械采购记录医疗器械表格-设施设备档案表验收不合格产品记录医疗器械表格-设施设备档案表医疗器械检查记录医疗器械表格-设施设备档案表售后服务管理记录医疗器械表格-设施设备档案表医疗器械表格-设施设备档案表。
医院外来医疗器械首次接收测试流程图审核许可
清晰消毒效果测试评估及制定
灭菌效果测试
记录存档1.根据外来医疗器械及植入的说明书选择清晰消毒方式
2.对外来医疗器械及植入物清洗消毒并确认效果
1.根据说明书的要求评估CSSD清晰消毒剂灭菌的条件是否符合
2.制定清洗消毒灭菌流程及灭菌有效性测试方案
3.确认监测指示物放置于包内最难灭菌的位置
根据医院相关部门提供的供应商及外来医疗器械与植入物准入清单进行确认
建立外来医疗器械及植入物首次接收测试档案并保存
1.根据外里奥医疗器械及植入物的说明书选择灭菌方式和灭菌参数
2.对外来医疗器械及之植入物进行灭菌参数有效性测试及湿包检查并确认结果。
采购记录表
年 NO
验收记录表
年 NO:
!
销售记录表
年 NO:
出库记录表。
入库记录表
温湿度记录表
(年月)
适应相对温度范围: - ℃ 适应相对湿度范围:
定期检查记录表
年 NO:
不合格医疗器械销毁记录
记录人:
不良事件停止经营和通知记录年
医疗器械召回记录年
设施设备登记表
设施设备校准记录(年)
质量管理培训记录
质量投诉记录
接到日期:年月日编号:
填表人:
事故调查和处理报告记录
编号:
各岗位培训记录
基础设施及相关设备检查清洁和维护记录
设备名称:设备编号:使用部门:保养人:年月
予以记录
温湿度计检定记录
医疗器械查询记录
退货管理处理记录
文件发放记录记录编号:
文件回收记录
记录编号:
年
文件销毁记录记录编号:
首营企业审批表
首营品种审批表
-。