医疗器械登记表
- 格式:doc
- 大小:42.00 KB
- 文档页数:4


医疗器械注册登记表格式(一)境内医疗器械注册登记表格式:医疗器械注册登记表注册号:×(×)1(食)药监械(准)字××××3第×4××境内第一类医疗器械注册申请材料要求(一)境内医疗器械注册申请表;(二)医疗器械生产企业资格证明:营业执照副本;(三)适用的产品标准及说明:采用国家标准、行业标准作为产品的适用标准的,应当提交所采纳的国家标准、行业标准的文本;注册产品标准应当由生产企业签章。
生产企业应当提供所申请产品符合国家标准、行业标准的声明,生产企业承担产品上市后的质量责任的声明以及有关产品型号、规格划分的说明。
这里的“签章”是指:企业盖章,或者其法定代表人、负责人签名加企业盖章(以下涉及境内医疗器械的,含义相同);(四)产品全性能检测报告;(五)企业生产产品的现有资源条件及质量管理能力(含检测手段)的说明;(六)医疗器械说明书;(七)所提交材料真实性的自我保证声明:应当包括所提交材料的清单、生产企业承担法律责任的承诺。
申报麻醉药品和精神药品定点经营申请表┌──────┬──────────────┬────────┬──────┐│企业名称││药品经营许可证号││├──────┼──────────────┼────────┼──────┤│企业地址││邮政编码││├──────┼──────────────┴────────┴──────┤│申报定点类别││├──────┴──────────────────────────────┤│企业申报事由及自查情况:│││││││││││├─────────────────────────────────────┤│受理部门检查情况:││││││检查人签字:││年月日│├─────────────────────────────────────┤│受理部门审查意见:││││││盖章:││年月日│└─────────────────────────────────────┘申请零售第二类精神药品的零售连锁企业应当报送的资料一、加盖企业公章的《药品经营许可证》、《企业法人营业执照》、《药品经营质量管理规范认证证书》复印件;二、拟从事第二类精神药品零售的门店名单,加盖公章的门店《药品经营许可证》、《营业执照》复印件,以及本企业实行统一进货、统一配送、统一管理的情况说明;三、企业和门店负责人、质量负责人、专门管理第二类精神药品经营人员情况;四、企业、门店经营第二类精神药品的安全管理制度,安全设施明细;五、企业安全管理和向药品监督管理部门或其指定机构报送经营信息的网络说明材料和操作手册。


医疗器械注册登记表是什么?
所谓的医疗器械产品注册登记表,也就是医疗器械的“副本”,医疗器械注册证包括注册登记表,一般记载:生产企业名称,企业注册地址,生产地址,型号规格,产品标准,产品性能结构及组成,产品适用范围产品禁忌症等内容(此为国产医疗器械的注册登记表)。
(奥咨达医疗器械咨询)
另外,2000年《医疗器械注册管理办法》(已作废)规定(第一章第四条):(1)境内企业生产的医疗器械注册证附有《医疗器械产品生产制造认可表》,与证书同时使用;
(2)境外企业申请办理的产品注册证附有《医疗器械产品注册登记表》,与证书同时使用。
(只专注于医疗器械)
综上,注册登记表和生产制造认可表是相同的东西,都是附属于医疗器械产品注册证的。

医疗器械登记表I. 登记表介绍本登记表用于记录医疗器械的相关信息,包括器械的基本信息、注册者的资料、产品的使用范围及申请注册的流程。
II. 器械基本信息1. 器械名称:_____________________2. 器械分类:_____________________3. 型号规格:_____________________4. 生产厂商:_____________________5. 产地国家/地区:________________6. 器械材质:_____________________7. 外观照片:_____________________III. 注册者信息1. 公司名称:_____________________2. 公司注册地址:_________________3. 企业类型:_____________________4. 联系人姓名:___________________5. 联系电话:_____________________6. 电子邮件:_____________________7. 技术联系人姓名:_______________8. 技术联系人电话:_______________9. 技术联系人电子邮件:___________IV. 产品使用范围请清晰描述你的医疗器械产品的主要特点、功能、适用人群以及在医疗领域的使用范围。
可以附上详细的产品说明书或材料。
V. 产品注册流程1. 根据所在国家/地区的法规要求,描述产品注册的流程,并标明需要提供的材料和文件。
2. 说明注册申请的审批时间和费用。
3. 提醒注册者注意提交完整准确的材料,并保持及时沟通以加快审批进程。
VI. 申请人声明在此,我(注册者姓名)确认所提供的信息真实有效,并知晓如有虚假陈述或隐瞒事实,将承担相应的法律责任。
VII. 签字处请注册者签字确认提交的信息真实有效,并保留相关文件以备将来审查。
注意事项:- 所有文件和材料应按照规定的要求进行备份和保留,包括但不限于产品规格、注册者资料、产品说明书等。

医疗器械登记表一、产品信息1. 产品名称:________________________2. 产品分类:________________________3. 产品型号:________________________4. 生产商:___________________________5. 产地:_____________________________二、技术参数1. 产品规格:________________________2. 适用范围:________________________3. 材质:_____________________________4. 功能:_____________________________5. 外观尺寸:_________________________长度:_____________________________宽度:_____________________________高度:_____________________________6. 重量:_____________________________三、注册证信息1. 注册证编号:______________________2. 注册证有效期:____________________3. 发证机构:________________________四、市场准入信息1. 参考标准:________________________2. 法规要求:________________________3. 产品检验报告:____________________五、生产许可信息1. 生产许可证编号:__________________2. 许可证有效期:____________________3. 发证机构:________________________六、质量管理体系1. ISO质量管理体系认证:_____________认证编号:________________________认证有效期:______________________2. 生产过程控制方法:_________________七、产品功效与安全性评价1. 产品功效:________________________2. 安全性评价报告:__________________八、临床试验报告1. 临床试验目的:____________________2. 试验结果:________________________九、不良事件监测与报告1. 不良事件监测报告:_________________监测结果:________________________2. 不良事件报告:_____________________报告数量:________________________十、产品存储与运输条件1. 存储条件:________________________2. 运输条件:________________________十一、售后服务1. 售后服务机构:____________________2. 联系人:__________________________3. 联系电话:________________________十二、其他备注_______________________________________________________________________________________________________________以上是本医疗器械的登记表,所有填写的信息必须准确无误。

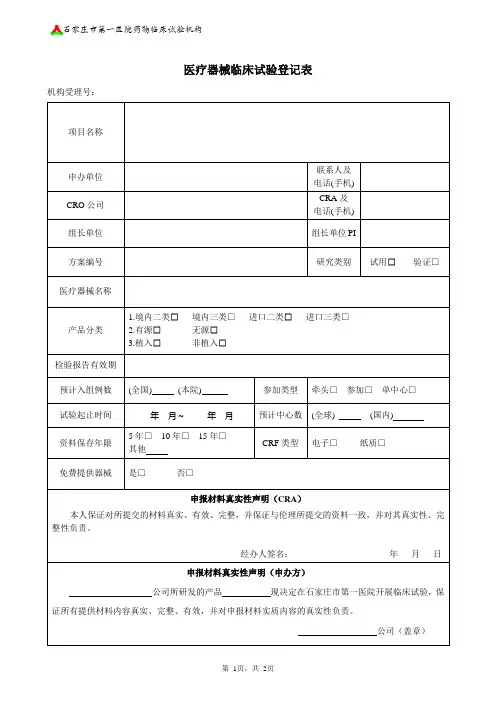
医疗器械临床试验登记表机构受理号:
项目名称
申办单位
联系人及电话(手机)
CRO公司
CRA及电话(手机)
组长单位组长单位PI
方案编号研究类别试用□验证□医疗器械名称
产品分类1.境内二类□境内三类□进口二类□进口三类□
2.有源□无源□
3.植入□非植入□
检验报告有效期
预计入组例数(全国)(本院)参加类型牵头□参加□单中心□试验起止时间年月~年月预计中心数(全球) (国内)
资料保存年限5年□10年□15年□
其他
CRF类型电子□纸质□
免费提供器械是□否□
申报材料真实性声明(CRA)
本人保证对所提交的材料真实、有效、完整,并保证与伦理所提交的资料一致,并对其真实性、完整性负责。
经办人签名:年月日
申报材料真实性声明(申办方)
公司所研发的产品现决定在石家庄市第一医院开展临床试验,保证所有提供材料内容真实、完整、有效,并对申报材料实质内容的真实性负责。
公司(盖章)
研究团队成员:
姓名职务/职称是否有GCP证书项目组中分工签名
无利益冲突和申报材料真实性声明(PI)
本人自觉接受国家有关法律和法规的约束,对该项目的所有临床研究资料及相关内容保密,保护受试者权益及隐私,并郑重承诺与该项目无任何利益冲突。
本人已审阅所有临床试验资料,并保证所提交的材料真实、有效、完整。
同意并确认上述人员参加该临床试验。
主要研究者签字:年月日(此由机构填写)
机构意见:经形式审查资料合格。
审查人签字:年月日
注:1. 所有选择项目的“□”内用“×”标注
2. 机构登记表正反面打印。
3. 研究团队成员必须经过GCP培训。