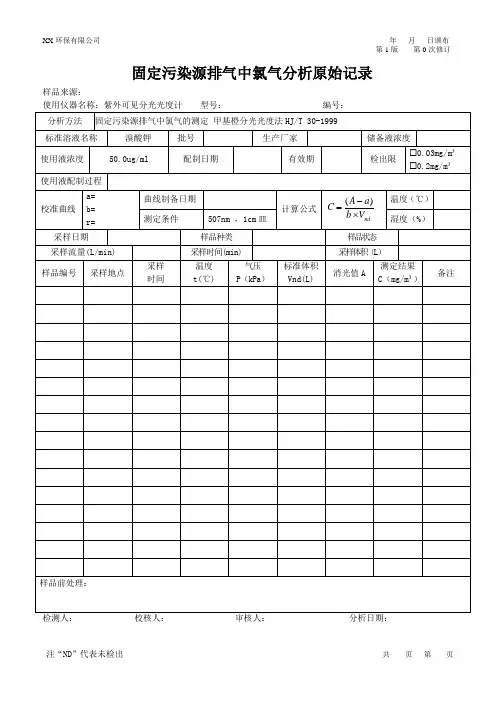
固定污染源排气中氯气的测定-甲基橙分光光度法
- 格式:doc
- 大小:33.50 KB
- 文档页数:5

编号:XXXXXX有限公司方法验证报告固定污染源氯气的测定甲基橙分光光度法《空气和废气监测分析方法》(第四版增补版)国家环保总局2003年方法验证人员:方法验证日期:一、实验室基本情况1.1人员情况公司安排分析人员XXX和XXX进行了《固定污染源氯气的测定甲基橙分光光度法《空气和废气监测分析方法》(第四版增补版)(国家环保总局2003年)》分析方法的验证。
验证人员通过培训学习熟悉了该标准方法原理及分析流程,能够熟练操作仪器,独立完成整个分析过程,并通过了公司自认定考核。
分析人员见表1。
表1 分析人员一览表1.2仪器设备及试剂、标准物质该标准主要使用的仪器设备由XXX股份有限公司进行校准,具体内容见表2。
表2仪器设备(包括仪器、前处理装置)标准除非另有说明,分析时均使用符合国家标准的分析纯化学试剂;实验用水为新制备的蒸馏水或去离子水。
本次方法验证使用试剂见表3。
表3试剂1.3实验室环境条件标准方法对测试环境无特殊要求,符合实验室日常环境控制即可。
目前实验室环境监控设备配置有温湿度表。
实验室配有通风橱,实验人员配备防毒面具。
二、方法简介2.1样品2.1.1样品采集2.1.1.1有组织排放样品采集将采样管头部塞适量玻璃棉后,插入排气筒采样点,用两支串联,内装10.0mL甲基橙吸收液的多孔玻板吸收管,以0.2L/min的流量采样。
当吸收液颜色有明显减退时,即可停止采样。
如不褪色,采样时间选择60min。
2.1.1.2无组织排放样品采集串联两支内装10.0mL的甲基橙吸收液的多孔玻板吸收管,以0.6L/min 的流量采样。
当甲基橙吸收液颜色明显减退时,即可停止采样如不褪色,采样时间选择60min。
2.1.2样品保存采样后,将两管样品溶液全部转移到100mL容量瓶中,用水洗涤吸收管,合并转移到此容量瓶中。
用水稀释至标线,混匀,待测定。
该样品显色完成后溶液颜色稳定,常温下至少可保存15d。
2.2实验方法原理及实验过程2.2.1适用范围本方法适用于测定固定污染源有组织排放和无组织排放的氯气。



标识:GXEMC-TR-028方法确认表项目类别编号:参数范围、检测 1.适用范围本标准适用于固定污染源有组织排放和无组织排放的光气测定。
在本标准规定的条件下,氯气浓度大于1600mg/m 3时对光气测定有干扰。
2.本标准方法的检出限在无组织排放样品分析中,当采样体积为60L 时,光气的检出限为0.02mg/m 3,定量测定的浓度范围为0.06-1.0mg/m 3。
在有组织排放样品分析中,当采样体积为15L 时,光气的检出限为0.4mg/m 3,定量测定的浓度范围为1.2-20mg/m 3.3.方法原理含光气(COCL 2)的气体先经装有硫代硫酸钠和无水碳酸钠的双联玻璃球,以除去氯、二氧化氮、氨等干扰气,而后被苯胺溶液吸收,生成1,3-二苯基脲,用溶剂在酸性条件下萃取,在波长257nm 处测定吸光度,其值与光气含量成正比。
反应如下:4.样品采集和保存4.1有组织排放样品采集串接两支内装50ml 吸收液(5.11)的多孔玻板吸收瓶(7.2),以0.3-0.5L/min 的流量,采气3.0-5.0L 。
4.2无组织排放样品采集串联两支U 型多孔玻板吸收管(7.3),内各装10ml 吸收液(5.11),以0.5-1.0L/min 的流量,采气30-60L 。
4.3样品保存无组织排放和有组织排放样品,均应于3-5℃冷藏,并于12h 内测定完毕。
5.主要试剂除非另有说明,分析中均使用符合国家标准的分析纯试剂和去离子水。
5.1硫酸:p=1.84g/ml 。
5.2甲醇。
5.3硫代硫酸钠。
5.4无水碳酸钠。
5.5苯胺常压蒸馏,收集183-184℃的馏分。
5.6正己烷在1000ml 分液漏斗中,按正己烷与浓硫酸(5.1)50+3(V/V )的比例,将浓硫酸(5.1)缓慢加入试剂中,上塞,倒置分液漏斗,用力震荡数分钟(注意经常放气),静置分层后弃去浓硫酸。
再重复上述步骤,直至弃去的浓硫酸为浅色止。
酸洗结束后再用去离子水水洗,步骤同上,直至弃去的去离子水PH为7左右,然后进行蒸馏,收集68-69℃的馏分。

氯气的测定甲基橙分光光度法原理方程甲基橙分光光度法是一种常用的分析方法,可用于定量测定水中氯离子的含量。
该方法基于甲基橙与氯离子之间的反应,通过分析其吸收光谱来测定氯离子的浓度。
甲基橙是一种有机染料,其分子结构中含有苯环和吡啶环。
当甲基橙与氯离子反应时,氯离子与甲基橙分子中的苯环上的亲电取代基发生取代反应,生成氯代甲基橙。
这个反应是一个快速的化学反应,且是可逆反应。
甲基橙与氯离子反应的化学方程式如下:甲基橙 + 氯离子→ 氯代甲基橙在甲基橙分光光度法中,我们通过测定氯代甲基橙的吸收光谱来间接测定氯离子的浓度。
氯代甲基橙溶液在紫外-可见光区域有特征性的吸收峰,其最大吸收波长为460 nm。
根据比尔-朗伯定律,溶液中溶质的吸光度与溶质的浓度成正比。
根据以上原理,可以建立甲基橙分光光度法测定氯离子浓度的方程。
假设溶液中氯离子的浓度为C,甲基橙溶液的吸光度为A,则有以下关系:A = εlc其中,A为吸光度,ε为摩尔吸光系数,l为光程(溶液的厚度),c为溶液中氯离子的浓度。
根据比尔-朗伯定律,吸光度与浓度成正比,因此可以通过测定甲基橙溶液的吸光度来计算氯离子的浓度。
在实际操作中,首先需要制备一系列不同浓度的氯离子标准溶液,然后分别测定它们的吸光度。
利用标准曲线法,将浓度与吸光度的关系进行线性拟合,得到一个标准曲线方程。
通过测定待测溶液的吸光度,再利用标准曲线方程,可以计算出溶液中氯离子的浓度。
除了甲基橙分光光度法,还有其他方法可以测定氯离子的浓度,如电化学法、滴定法等。
每种方法都有其特定的优点和适用范围。
甲基橙分光光度法具有操作简便、准确度高和灵敏度较好的优点,因此在实际分析中得到了广泛应用。
总结起来,甲基橙分光光度法通过测定氯代甲基橙的吸收光谱来测定氯离子的浓度。
根据比尔-朗伯定律,通过测定甲基橙溶液的吸光度,可以计算出溶液中氯离子的浓度。
该方法操作简便、准确度高,因此在水质分析等领域得到了广泛应用。

甲基橙分光法测氯气曲线概述及解释说明1. 引言1.1 概述本文旨在介绍甲基橙分光法测氯气的曲线概述及解释说明。
该方法是一种常用于测定氯气浓度的分析技术,根据甲基橙和氯气发生反应后产生的颜色变化来确定样品中的氯气含量。
1.2 文章结构本文将按照以下结构进行叙述:首先,我们将在第2部分介绍甲基橙分光法测氯气的原理和实验方法;然后,我们将在第3部分详细讨论曲线生成过程、曲线特征解释以及曲线应用案例分析;最后,在第4部分给出结论,并对实验结果进行分析,并提出对未来研究的展望。
1.3 目的本文旨在提供关于甲基橙分光法测量氯气曲线的全面说明。
通过阐述该方法的原理、实验方法以及数据处理步骤,读者可以更好地理解如何利用该方法准确测量样品中的氯气含量。
同时,通过对曲线特征进行解释和应用案例分析,读者可以了解该曲线在实际应用中的重要性和可靠性。
最后,本文还将总结回顾实验过程并提出对未来研究的期望。
以上是文章“1. 引言”部分的内容。
2. 甲基橙分光法测氯气2.1 原理介绍甲基橙分光法是一种常用于测量氯气浓度的方法。
其原理基于甲基橙与氯气发生反应后发生颜色变化的特性。
甲基橙是一种指示剂,它在酸性条件下呈现黄色,而在受到还原剂氯气作用时,会转变成无色。
2.2 实验方法为了进行氯气的浓度测量,首先需要准备一个标准溶液,并对该溶液进行稀释以得到不同浓度的溶液。
然后,将所需测试的样本中的氯气释放到溶液中,并观察颜色变化。
具体实验步骤如下:1. 准备甲基橙溶液:称取适量的甲基橙固体,并加入适量去离子水中,制备成一定浓度的甲基橙溶液。
2. 稀释标准溶液:取一定体积的标准溶液,加入适量去离子水稀释至所需浓度。
3. 样品处理:将待测试样品中的氯气释放到甲基橙溶液中,促使反应发生。
4. 观察颜色变化:观察溶液的颜色变化,并进行比较和记录。
2.3 数据处理在甲基橙分光法测量氯气浓度时,一般使用比色法来定量。
通过测量溶液的吸光度,并根据事先建立的标准曲线,可以得到相应的氯气浓度值。

1目的规范固定污染源有组织排放的操作程序,正确使用仪器,保证采样工作顺利进行和人员的安全。
2适用范围本方法适用于固定污染源有组织排放采样。
3 采样位置3.1采样位置应避开对测试人员操作有危险的场所。
3.2采样位置应优先选择在垂直管段,应避开烟道弯头和断面急剧变化的部位。
采样位置应设置在距弯头、阀门、变径管下游方向不小于6倍直径,和距上述部件上游方向不小于3倍直径处。
对矩形烟道,其当量直径D=2AB/(A+B),式中A、B为边长。
采样断面的气流速度最好在5m/s以上。
3.3测试现场空间位置有限,很难满足上述要求时,可选择比较适宜的管段采样,但采样断面与弯头等的距离至少是烟道直径的1.5倍,并应适当增加测点的数量和采样频次。
3.4对于气态污染物,由于混合比较均匀,其采样位置可不受上述规定限制,但应避开涡流区。
3.5必要时应设置采样平台,采样平台应有足够的工作面积使工作人员安全、方便地操作。
平台面积应不小于1.5m2,并设有1.1m高的护栏和不低于10cm的脚部挡板,采样平台的承重应不小于200kg/m2,采样孔距平台面约为 1.2m~1.3m。
4 采样孔和采样点4.1在选定的测定位置上开设采样孔,采样孔的内径应不小于80mm,采样孔管长应不大于50mm。
不使用时应用盖板、管堵或管帽封闭。
当采样孔仅用于采集气态污染物时,其内径应不小于40mm。
4.2对正压下输送高温或有毒气体的烟道,应采用带有闸板阀的密封采样孔(图1)。
4.3对圆形烟道,采样孔应设在包括各测点在内的互相垂直的直径线上(图2)。
对矩形或方形烟道,采样孔应设在包括各测点在内的延长线上(图3、图4)。
图1 带有闸板阀的密封采样孔图2 圆形断面的测定点图3 长方形断面的测定点图4 正方形断面的测定点5 采样点的位置和数目5.1圆形烟道5.1.1将烟道分成适当数量的等面积同心环,各测点选在各环等面积中心线与呈垂直相交的两条直径线的交点上,其中一条直径线应在预期浓度变化最大的平面内,如当测点在弯头后,该直径线应位于弯头所在的平面A-A 内(图5)。
用X光看片机检查每张滤膜不得有针孔或缺陷,在15~30℃任一点条件下,滤膜在干燥器中平衡24h,称重。
将已编号并称重滤膜绒面向上,放在滤膜支持网上,放上滤膜夹,对正,拧紧,使不漏气。
样品采完后,打开采样头,用镊子轻轻取下滤膜,采样面向里,将滤膜对折,放入号码相同的滤膜带中。
样品采完后,尘膜在恒温箱中,与干净滤膜平衡条件相同温度、湿度、平衡24小时。
滤膜称量精确到。
空气:Saltzman法:短时间采样(1h以内):10ml吸收液(5g对氨基苯磺酸)乙二胺盐酸盐)大气综合采样器长时间采样(24h以内):或50ml吸收液液柱不低于80mm,采气时吸收液温度保持在20±4℃,空气采样器采样、样品运输和存放过程中时应避光。
气温超过25℃时,长时间运输及存放样品应采取降温措施。
空气中臭氧浓度超过m3,采样时在吸收瓶入口端串联一段15~20cm长的硅胶管,不干扰NO2测定水平。
空气方法一:Saltzman法短时间采样(1h以内):取二支10ml吸收液和一支内装5~10ml酸性高锰酸钾溶液的氧化瓶(液柱不低于80mm),用尽量短的硅橡胶管将氧化瓶串联在二支吸收瓶之间。
大气综合采样器长时间采样(24h):取二支25或50ml吸收液(液柱不低于80mm)和一支内装50ml酸性高锰酸钾溶液的氧化瓶(液柱不低于80mm),用尽量短的硅橡胶管将氧化瓶串联在二支吸收瓶之间,采气时吸收液温度报纸在20±4℃空气采样器方法二:三氧化铬—石英砂氧化法取一支10ml吸收液(5g对氨基苯磺酸+50ml冰乙酸和50mlN-(1-萘基)乙二胺盐酸盐),用一小段硅橡胶管将氧化管连接在吸收瓶入口端。
采样、运输时应避光。
氧化瓶管适合在空气相对湿度30%~70%时使用。
氧化管因吸湿引起板结或部分变为绿色,应及时更换。
气温超过25℃时,长时间运输及存放样品应采取降温措施。
空气中臭氧浓度超过m3,采样时在吸收瓶入口端串联一段15~20cm长的硅胶管,可排除干扰。

甲基橙分光光度法测氯气的探讨研究
张勇慧;王万祥;许潇晓
【期刊名称】《环境科学与管理》
【年(卷),期】2008(033)001
【摘要】氯气是目前环境空气和污染源重要项目监测之一,根据国家标准方法要求,采用甲基橙分光光度法.标准曲线的正确与否直接关系到数据的准确性.在实际工作中,环境空气标准曲线及污染源标准曲线,相关性均做不到三个9,且两者曲线的斜率、截距波动较大,直接影响数据的准确性,尤其对浓度较低的数据影响更大.本文针对这一问题,对氯气曲线的标准溶液浓度和加标量进行了改进.改进后环境空气和污染源
标准曲线相关性可达到三个9,斜率和截距波动不大.经回收率实验,该方法可获得满意结果.
【总页数】2页(P159-160)
【作者】张勇慧;王万祥;许潇晓
【作者单位】洛阳市环境监测站,河南,洛阳,471000;洛阳市环境监测站,河南,洛
阳,471000;洛阳市环境监测站,河南,洛阳,471000
【正文语种】中文
【中图分类】X830.2
【相关文献】
1.甲基橙分光光度法测定氯气方法的条件优化 [J], 谢有亮;种丽娜;孙桂珍
2.“甲基橙分光光度法测下水道中氯气含量”的标准化验证研究 [J], 郭彦娟
3.甲基橙分光光度法测定氯气分析方法的探讨 [J], 王延花;高静;窦筱艳
4.甲基橙分光光度法测定环境中氯气的分析方法研究 [J], 方晶晶;许林军;徐新宏;潘沪湘
5.甲基橙分光光度法测定固定污染源无组织排气中氯气分析方法的改进 [J], 吴燕因版权原因,仅展示原文概要,查看原文内容请购买。
①固定污染源排气中氰化氢的测定异烟酸-吡唑啉酮分光光度法(HJ/T28-1999)①环境空气氰化氢的测定异烟酸-吡唑啉酮分光光度法《空气和废气监测分析方法》(第四版)一、填空题1.根据异烟酸-吡唑啉酮分光光度法对环境空气或废气中氰①固定污染源排气中氯气的测定甲基橙分光光度法(HJ/T30-1999)②氯气的测定甲基橙分光光度法《空气和废气监测分析方法》 (第四版)一、判断题1.甲基橙分光光度法测定环境空气或废气中氯气时,甲基橙吸收贮备液在常温下放于暗处可保存一年。
( )①②答案:错误正确答案为:可保存半年。
2.甲基橙分光光度法测定环境空气中氯气时,盐酸气和氯化物对测定产生负干扰。
( )①②答案:错误正确答案为:盐酸气和氯化物不干扰测定。
3.甲基橙分光光度法测定环境空气或废气中氯气,甲基橙吸收液颜色有明显褪色时,即可停止采样;若吸收液不褪色,采样时间选择30min。
( )①②答案:错误正确答案为:若吸收液不褪色,采样时间选择大于50min。
4.甲基橙分光光度法测定废气中氯气时,因为游离溴有和氯相同的反应而产生正干扰,微量二氧化硫对测定也有明显正干扰。
( )①②答案:错误正确答案为:微量二氧化硫对测定有明显负干扰。
5.甲基橙分光光度法测定环境空气或废气中氯气时,若显色温度低于20℃,必须延长显色时间或将采样后吸收液置于30℃恒温水浴中40min。
( )①②答案:正确二、选择题1.甲基橙分光光度法测定环境空气或废气中的氯气时,采样后的样品溶液转移到100m1容量瓶中,放置 min后,比色测定。
( )①②A. 30 B.40 C.20答案:B2.甲基橙分光光度法测定固定源排气中氯气时,采样管的材质可以选用、或。
( )①②A.硬质玻璃,氟树脂,氯乙烯树脂 B.塑料,硬质玻璃,聚四氟乙烯C.聚四氟乙烯,氟树脂,氯乙烯答案:A3.甲基橙分光光度法测定环境空气中的氯气时,采样流量为 L/min。
( )①②A.0.2 B.0.6 C.0.5答案:B4.甲基橙分光光度法测定环境空气或废气中氯气时,样品显色完成后溶液颜色稳定,常温下放置暗处至少可保存 d。
XXXX有限公司新项目方法验证能力确认报告项目名称:固定污染源排气中氯气的测定甲基橙分光光度法HJ/T30-1999负责人:审核人:日期:固定污染源排气中氯气的测定甲基橙分光光度法HJ/T 30-1999方法验证能力确认报告1、方法依据及适用范围本标准适用于固定污染源有组织排放和无组织排放的氯气测定。
当采集无组织排放样品体积为30 L时,方法的检出限为0.03 mg/m3,定量测定的浓度范围为0.086-3.3mg/m3。
当采集有组织排气样品体积为5.0L 时,方法的检出限为0.2mg/m3.定量测定的浓度范围为0.52-20 mg/m3。
2、方法原理含溴化钾、甲基橙的酸性溶液和氯气反应,氯气将溴离子氧化成溴,溴能在酸性溶液中将甲基橙溶液的红色减退,用分光光度法测定其退色的程度来确定氯气的含量。
3、主要仪器、设备及试剂除非另有说明,分析时均使用符合国家标准的分析纯试剂。
实验用水为新制备的去离子水或蒸馏水。
1.浓硫酸:ρ=l.84 g/ml。
2.甲基橙。
3.溴化钾。
4.溴酸钾:基准试剂。
5.硫酸溶液:1+6。
量取100 ml浓硫酸(1),缓慢地、边倒边搅拌加入到600 ml水中。
6.甲基橙吸收贮备液:称取0.1000g甲基橙(2).溶解于100ml40-50℃的水中,冷却至室温,加无水乙醇20 ml,移入1000ml容量瓶中,加水稀释至刻度,混匀。
此溶液放置暗处可保存半年。
7.甲基橙吸收使用液:用吸管移取甲基橙吸收储备液(6)250ml,置于l 000 ml 容量瓶中,加入500mll+6硫酸溶液(5),再加入5.0 g溴化钾(3),溶解后用水稀释至刻度,混匀。
8.溴酸钾标准贮备液:c(l/6KBro3)=1.41×l0-1mol/L。
称取1.9627g滇酸钾(4),用少量水溶解,移入500ml容量瓶中,加水稀释至刻度,混匀。
此漠酸钾标准贮备溶液每毫升相当于5.00mg氯。
放置暗处,可保存半年。
固定污染源排气中氯气的测定HJ/T 30-1999甲基橙分光光度法验证报告1、目的通过对实验人员、设备、物料、方法,环境的能力确认,验证实验室均已达到各种要求,具备开展此实验的能力。
2、方法简介含溴化钾、甲基橙的酸性溶液和氯气反应,氯化钾将溴离子氧化为溴,溴能在酸性溶液中将甲基橙溶液的红色退去,用分光光度法测定其褪色的程度来测定氯的含量。
3、仪器设备及药品验证情况3.1使用仪器设备:SP-722分光光度计、比色管10ml、移液管1 ml/5ml/10ml/25ml、容量瓶1000ml/500ml/250ml/100ml、烧杯100ml/500ml、具塞筒量50ml、电子天平。
3.2设备验证情况设备验收合格。
4、环境条件验证情况4.1本方法对环境无特殊要求。
4.2目前对环境的设施和监控情况天平室环境指标:温度:℃;湿度%。
4.3环境验证条件符合要要求5、人员能力验证5.1该项目人员配备情况有二名以上符合条件的实验人员。
5.2人员培训及考核情况通过培训,考核合格,相关记录见人员技术档案。
6、标准物质及试剂验证情况6.1方法所需标准(物质)溶液及试剂情况6.1表6.2配备情况6.2表7、方法验证情况7.1方法要求7.11检出限:采样体积为30L的时候,方法检出限0.03mg/m3,;当采气体积为5L的时候,检出限为0.2mg/m3.7.12 精密度:方法无要求。
7.13 准确度:测定加标回收了。
7.2目前该项目本实验的精密度、检出限、准确度的实际水平。
7.21精密度精密度情况表7.21测得实验室内相对标准偏差为3.09%。
7.22准确度向空白此溶液中加入5ml的1ug/mL的溴酸钾溶液,加标后测得含量为mg/l。
情况表7.2 2测得加标回收率为97.3%,符合方法要求。
7.23检出限7.23空白测定结果表测出实验室检测限为0.017mg/L,符合方法要求。
8、结论仪器设备验证合格、环境条件验证合格、人员能力验证合格、试剂验证合格、方法验证合格,即设备、环境、人员、物料均符合实验方法要求,实验室具备开展此项目的条件。
固定污染源排气中氯气的测定甲基橙分光光度法
HJ/T 30-1999 1.适用范围
1.1 本方法适用于固定污染源有组织排放和无组织排放的氯气测定。
1.2 当采集无组织排放样品体积为30L时,方法的检出限为0.03mg/m3,定量测定的浓度范围为0.086~3.3mg/m3,当采集有组织排气样品体积为5.0L时,方法的检出限为0.2mg/m3,定量测定的浓度范围为0.52~20mg/m3。
1.3 游离溴有和氯相同的反应而产生正干扰,微量二氧化硫对测定有明显负干扰。
2. 方法原理
含溴化钾、甲基橙的酸性溶液和氯气反应,氯气将溴离子氧化成溴,溴能在酸性溶液中将甲基橙溶液的红色减退,用分光光度法测定其退色的程度来确定氯气的含量。
3. 试剂和材料
除非另有说明,分析过程中均使用符合国家标准的分析纯试剂和蒸馏水。
3.1 浓硫酸:ρ=1.84g/ml。
3.2 甲基橙。
3.3 溴化钾。
3.4 溴酸钾:基准试剂。
3.5 硫酸溶液:1+6。
量取100ml浓硫酸,缓慢地、边倒边搅拌加入到600ml水中
3.6 甲基橙吸收贮备液
称取0.1000 g甲基橙,溶解于100ml 40~50℃的水中,冷却至室温,加无水乙醇20ml,移入1000ml容量瓶中,加水稀释至刻度,混匀。
此溶液放置暗处可保存半年。
3.7 甲基橙吸收使用液
用吸管移取甲基橙吸收储备液250ml,置于1000ml容量瓶中,加入500ml 1+6硫酸溶液,再加入5.0g溴化钾,溶解后用水稀释至刻度,混匀。
3.8 溴酸钾标准贮备液:c(l/6KBrO3)1.41×10-1mol/L。
称取1.9627g溴酸钾,用少量水溶解,移入500ml容量瓶中,加水稀释至刻度,混匀。
此溴酸钾标准贮备溶液每毫升相当于5.00mg氯。
放置暗处,可保存半年。
3.9 溴酸钾标准使用液:c(l/6KBrO3)1.41×10-3mol/L。
用吸管移取溴酸钾标准贮备液10ml,移入1000ml容量瓶中,加水稀释至刻度,混匀。
此溴酸钾标准使用液每毫升相当于50.0µg氯。
4. 仪器
4.1 分光光度计:具1cm比色皿。
4.2 采样仪器
4.2.1 有组织排放监测采样仪器
参照GB 16157—1996中9.3有关部分配置采样仪器。
4.2.1.1 采样管
以硬质玻璃、氟树脂或氯乙烯树脂为材质,具有适当尺寸的管料为采样管。
4.2.1.2 取样装置
25ml多孔玻板吸收管。
4.2.1.3 流量计量装置
按GB 16157—1996中9.3.6配置流量计量装置。
4.2.1.4 抽气泵
按GB 16157—1996中9.3.7配置抽气泵。
4.2.1.5 连接管
聚四氟乙烯软管或内衬聚四氟乙烯薄膜的硅橡胶管。
4.2.2 无组织排放监测采样仪器
4.2.2.1 引气管
以聚四氟乙烯或聚乙烯软管作引气管,在其头部接一玻璃漏斗。
4.2.2.2 取样装置
25ml多孔玻板吸收管。
4.2.2.3 流量计量装置
按GB 16157—1996中9.3.6配置流量计量装置。
4.2.2.4 抽气泵
按GB 16157—1996中9.3.7配置抽气泵。
4.2.2.5 连接管
聚四氟乙烯软管或内衬聚四氯乙烯薄膜的硅橡胶管。
5. 样品采集和保存
5.1 有组织排放样品采集
5.1.1 采样位置和采样点
按GB 16157—1996中9.1.1和9.1.2确定采样位置和采样点。
5.1.2 采样装置的连接
参考GB 16157—1996中9.3图28,按采样管、样品吸收装置、流量计量装置和抽气泵的顺序连接好采样系统,连接管要尽可能短。
按GB 16157—1996中9.4的要求检查采样系统的气密性和可靠性。
5.1.3 样品采集
将采样管头部塞适量玻璃棉后,插入排气筒采样点,用两支串联,内装10.0ml 甲基橙吸收液的多孔玻板吸收管,以0.2L/min的流量采样。
当吸收液颜色有明显减退时,即可停止采样。
如不退色,采样时间选择60min。
5.2 无组织排放样品采集
5.2.1 采样位置和采样点
按GB 16297—1996附录C的规定确定无组织排放监控点的位置,或按其他特定要求确定环境空气采样点。
5.2.2 采样装置的连接
按引气管、样品吸收装置、流量计量装置和抽气泵的顺序连接采样装置。
按GB 16157—1996中9.4 的要求检査采样系统的气密性和可靠性。
5.2.3 样品采集
串联两支内装l0.0ml甲基橙吸收液的多孔玻板吸收管,以0.6L/min的流量采样。
当甲基橙吸收液颜色明显减退时,即可停止采样。
如不退色,采样时间选择60min。
5.3 样品的保存
采样后,将两管样品溶液全部转移到100ml容量瓶中,用水洗涤吸收管,合并转移到此容量瓶中。
用水稀释至标线,混匀,待测定。
该样品显色完成后溶液颜色稳定,常温下至少可保存15天。
6. 分析步骤
6.1 校准曲线的绘制
取7只100ml容量瓶,各加入20.0ml甲基橙吸收液,并按次序分别移入溴酸钾标准使用溶液0.00、0.20、0.40、0.80、1.20、1.60、2.00ml (即相当于含氯量为0、10、20、40、60、80、100µg),用水稀释至刻度,混匀。
放置40min后,用lcm比色皿,在波长507nm处,以水为参比,测定吸光度。
以吸光度对氯含量(µg)绘制校准曲线,并计算得到校准曲线的线性回归方程。
6.2 样品测定
采样后转移到100ml容量瓶中的溶液,放置40min后,用lcm比色皿,在波长507nm处,以水为参比,测定吸光度。
7. 计算和结果表示
7.1 样品中氯气浓度的计算:
测得样品吸光度后,在校准曲线上读得其对应的氯含量x;或根据回归直线方程:y=a+bx来计算求得氯含量x。
即:
x= (Y-a) /b
式中:
Y——吸光度;
a——截距;
b——斜率,1/µg;
x——氯含量,µg。
结果计算的公式为:c=x/V nd。
式中:
c——样品气体的含氯浓度,mg/m3;
x——样品溶液中测得的含氯量,µg;
V nd——换算成标准状态下的干采气体积,L。
按GB 16157—1996 中10.1 或10.2 计算V nd。
7.2 氯气有组织排放的“排放浓度”计算
按GB 16157 —1996中11.1.2或11.1.4计算氯气的“排放浓度”。
7.3 氯气有组织排放的“排放速率(kg/h)”计算
按GB 16157—1996中11.4计算氯气的“排放速率”。
7.4 氯气的“无组织排放监控浓度值”计算
7.4.1 按下式计算一个无组织排放监控点的氯气平均浓度
式中:
c——一个无组织排放监控点的氯气平均浓度;
c i——一个样品中的氯气浓度;
n——一个无组织排放监控点采集的样品数目。
7.4.2 “无组织排放监控浓度值”的计算
按GB 16297—1996附录C中C2.3计算氯气的“无组织排放监控浓度值”。
8. 说明
8.1 温度低于20℃时,校准曲线绘制和样品测定都必须延长反应显色时间;或将反应后的吸收液置于20~30℃恒温水浴中40min。
8.2 在现场采样时,如氯气浓度较高,则操作人员应在上风向并戴好防毒口罩操作,严防氯气中毒。