print 第3章.双原子分子结构
- 格式:pdf
- 大小:2.50 MB
- 文档页数:11

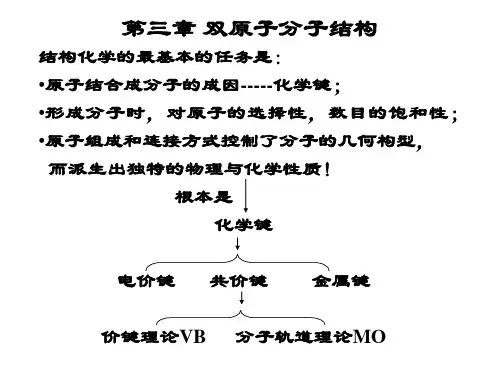
第三章双原子分子的结构⑴研究原子或分子间相互作用力的化学键理论可分为三大流派:一是分子轨道理论;二是价键理论;三是密度泛函理论。
⑵变分法解H2+体系,并讨论共价键。
⑶形成分子轨道必须满足对称性匹配、能级相近和轨道最大重叠三个条件;σ、π、δ轨道的特点。
⑷同核、异核双原子分子的分子轨道表示、能级示意图。
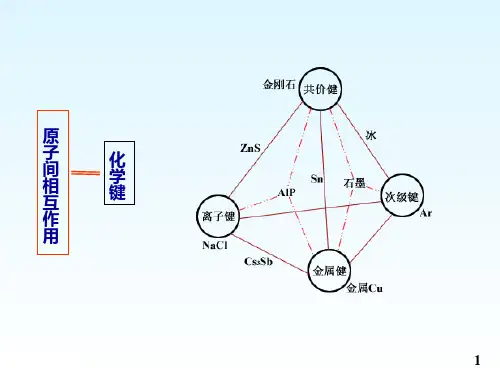
§3.1 化学键理论简介(chemical bond theory)一、原子间相互作用力(1)两个闭壳层的中性原子,例如 He-He,它们之间是van der Waals(范德华)引力作用。
(2)两个开壳层的中性原子,例如H-H,它们之间靠共用电子对结合称为“共价键”。
(3)一个闭壳层的正离子与一个闭壳层的负离子,例如Na+-Cl-,它们之间是静电相互作用,称之为“离子键”。
(4)一个开壳层离子(一般是正离子)与多个闭壳层离子(或分子),例如过渡金属配合物M n+(X-)m,它们之间形成配位键(属共价键范围)。
(5)许多金属原子聚集在一起,最外层价电子脱离核的束缚,在整个金属固体内运动——金属键。
讨论这些成键原理的理论称化学键理论。
二、化学键理论- 分子轨道理论(Molecular Orbital)、- 价键理论(Valence Bond)和- 密度泛函理论(Density Functional Theory)。
§3.2 变分法与H2+的结构一、H2+的结构和共价键的本质+的Schrödinger方程H2H2+的座标的方程以原子单位表示为二、变分法解Schrödinger方程变分法的原理:对任一个品优函数,用体系的算符求得的能量平均值,将),即大于或接近于体系基态的能量(E令得对ca 和cb偏微商求极值,得得久期方程为了使久期方程ca 和cb有不完全为零的解,须满足久期行列式解此行列式(展开行列式,得E的一元二次方程),得E的两个解求得三、等积分的意义和H2+的结构称为库仑积分EH代表基态氢原子的能量叫交换积分,或积分。