设计实验:微生物菌种的分离纯化、培养、、鉴定 以及保藏技术
- 格式:doc
- 大小:33.00 KB
- 文档页数:2

实验室常用微生物菌种的分离和纯化方法发布日期:2010-03-01 浏览次数:18从混杂微生物群体中获得只含有某一种或某一株微生物的过程称为微生物分离与纯化。
在分子生物学的研究及应用中,不仅需要通过分离从混杂微生物群体中获得只含有某一种或某一株微生物的过程称为微生物分离与纯化。
在分子生物学的研究及应用中,不仅需要通过分离纯化技术从混杂的天然微生物群中分离出特定的微生物,而且还必须随时注意保持微生物纯培养物的“纯洁”,防止其他微生物的混入。
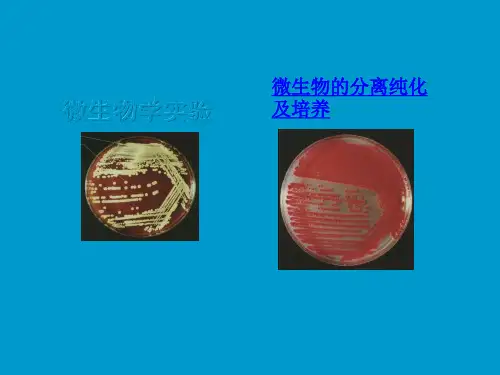
1、用固体培养基分离和纯化单个微生物在适宜的固体培养基表面或内部生长、繁殖到一定程度可以形成肉眼可见的、有一定形态结构的子细胞生长群体,称为菌落。
当固体培养基表面众多菌落连成一片时,便成为菌苔。
不同微生物在特定培养基上生长形成的菌落或菌苔一般都具有稳定的特征,可以成为对该微生物进行分类、鉴定的重要依据。
大多数细菌、酵母菌、以及许多真菌和单细胞藻类能在固体培养基上形成孤立的菌落,采用适宜的平板分离法很容易得到纯培养。
所谓平板,即培养平板的简称,它是指固体培养基倒入无菌平皿,冷却凝固后,盛固体培养基的平皿。
这方法包括将单个微生物分离和固定在固体培养基表面或里面。
固体培养基用琼脂或其它凝胶物质固化的培养基,每个孤立的活微生物体生长、繁殖形成菌落,形成的菌落便于移植。
最常用的分离、培养微生物的固体培养基是琼脂固体培养基平板。
这种由Kock建立的采用平板分离微生物纯培养的技术简便易行,100多年来一直是各种菌种分离的最常用手段。
1.1 稀释倒平板法首先把微生物悬液作一系列的稀释(如1:10、1:100、1:1000、1:10000),然后分别取不同稀释液少许,与已熔化并冷却至50℃左右的琼脂培养基混合,摇匀后,倾入灭过菌的培养皿中,待琼脂凝固后,制成可能含菌的琼脂平板,保温培养一定时间即可出现菌落。
如果稀释得当,在平板表面或琼脂培养基中就可出现分散的单个菌落,这个菌落可能就是由一个细菌细胞繁殖形成的。

细菌分离纯化实验报告本次实验的目的是通过细菌分离纯化的方法,从混合菌液中分离出目标菌株,并进行纯化,以获得纯净的目标菌株用于后续实验。
实验设备和试剂:1. 细菌培养平板:含有选择性抑制其他细菌生长的培养基。
2. 培养基:适用于目标菌株的培养基,如营养琼脂培养基。
3. 微量离心管:用于样品的处理和离心。
4. 恒温恒湿箱:调节实验环境的湿度和温度。
5. 显微镜:观察细菌形态和数量。
6. 干燥箱:用于处理培养平板和培养皿。
7. 试剂:如无菌生理盐水、酒精,用于消毒和处理细菌样品。
实验步骤:1. 预处理培养基和培养皿:将培养基热解,倒入无菌培养皿中,待凝固。
2. 提取目标菌株:取一定量的混合菌液,加入微量离心管中,并在1000rpm条件下离心10分钟。
3. 厌氧处理(如需要):若目标菌株是厌氧菌,则在无氧条件下进行操作。
4. 稀释样品:取离心后的上清液,逐渐进行稀释,直至可以观察到单个菌落形成的板。
5. 涂布培养:取少量稀释液,利用无菌培养棒均匀涂布在固体培养基上,避免菌落交叉生长。
6. 培养和筛选:将涂布好的培养皿面朝下放入恒温恒湿箱中,以适当的温度和时间进行培养。
根据菌落形态进行初步筛选,挑选出目标菌落。
7. 细菌分离:用无菌培养棒或酒精灯消过菌的鉴别针,在富含目标菌株的培养基上从相应菌落上轻轻刮取少量菌液,涂布于无菌培养基上。
8. 纯化:再次进行培养,重复步骤7直至获得明显的单菌落。
根据菌落形态和生理特性进行进一步鉴定,如果需要较纯净的目标菌株,可进行多次次传代。
9. 存储:将纯化的目标菌株进行保存,可在干燥箱中以适当的温度和湿度保存,或使用冰冻保存。
实验结果与讨论:通过上述实验步骤,我们成功地从混合菌液中分离出了目标菌株,并对其进行了纯化。
在筛选过程中,我们根据菌落形态和生理特性来初步判断目标菌株。
而通过细菌分离和纯化,我们能够获得更纯净的目标菌株。
然而,在实验中可能会遇到一些困难和问题。
例如,在筛选过程中,可能会出现非目标菌落过多的情况,导致目标菌株的分离速度较慢。


《发酵工程》课程实验教学大纲(生物制药方向)《发酵工程》课程实验教学大纲(生物制药方向)1. 实验教学目的:本课程旨在通过实验教学,使学生通过参与实际的发酵工程操作,了解发酵过程的基本原理与技术,并培养其实验操作、数据处理、问题解决和团队合作等能力,为将来从事相关生物制药工作做好准备。
2. 实验教学内容:(1)发酵工艺基础实验:学生学习发酵基本原理、发酵微生物筛选与培养方法、介质配方与调控策略等。
实验内容包括发酵微生物的分离与纯化、菌种的培养与保藏、生物酶的筛选与鉴定、酵母菌的发酵与调控等。
(2)发酵设备与控制实验:学生学习发酵设备的结构与工作原理、发酵过程的监测与控制方法等。
实验内容包括发酵设备的组装与调试、发酵过程中的参数监测与控制、发酵设备的日常维护与管理等。
(3)发酵工程实验:学生参与真实的发酵工程项目,掌握从发酵微生物的分离与培养到产品的提取与纯化的整个流程。
实验内容包括发酵工艺的设计与优化、发酵过程的实时监测与控制、产品的提取与纯化等。
3. 实验教学安排:(1)实验前准备:学生提前学习与准备实验所需的理论知识,包括发酵工艺原理、发酵微生物的特性、发酵设备的工作原理等。
(2)实验讲解与指导:教师进行实验讲解,包括实验目的、操作步骤与注意事项等,并指导学生进行实验操作,确保实验工作的安全与顺利进行。
(3)实验数据处理与报告撰写:学生对实验数据进行整理与分析,并撰写实验报告,包括实验目的、方法、结果与讨论等,培养学生的科学研究与论文写作能力。
4. 实验成果评价:(1)实验报告:根据实验报告的完整性、准确性、逻辑性和深度等维度对学生进行评价,并根据评价结果进行成绩评定。
(2)实验操作:根据学生在实验过程中的操作规范性、技术熟练度和实验结果的准确性等维度进行评价,并根据评价结果进行成绩评定。
(3)实验问题解决与团队合作:根据学生在实验中遇到问题的解决能力和与同学协作的团队精神进行评价,并根据评价结果进行成绩评定。

可编辑修改精选全文完整版植物病原微生物的分离与纯化一、实验目的1、掌握培养基的制备方法,学习灭菌与消毒的操作方法2、掌握分离与纯化病原微生物的基本原理与方法二、实验原理植物病原微生物的分离培养是植物病理学实验最基本的操作技术之一,它对原害鉴定,病原形态观察、植物病害接种体的培养等方面都是经常使用的研究手段。
植物患病组织内的微生物,如果给予适宜的环境条件,除个别种类外,一般都能恢复生长和繁殖。
植物病原微生物的分离就是指通过人工培养,从染病植物组织中将病原真微生物与其它微生物相分开,并从寄主植物中分离出来,再将分离到的病原微生物于适宜环境内纯化,这个过程总称植物病微生物的分离培养。
植物病原真微生物的分离一般都是采用组织分离法,就是切取小块病组织,经表面消毒和灭菌水洗过后,移到人工培养基上培养。
三、实验材料、试剂芒果炭疽病叶、酒精灯,剪子,镊子,牛肉膏蛋白胨,培养皿,小烧杯,大烧杯,灭菌水,75%酒精瓶、0.1%升汞瓶四、实验步骤1、培养基的配置取无菌平皿,将已熔化并冷却至50℃左右的牛肉膏蛋白胨琼脂培养基按无菌操作法倒入平皿中,使冷凝成平板。
2、植株挑选用新发病的植株、器官或组织做为分离材料,可以减少腐生菌的污染。
任何植物坏死部分的内部或表面,都可能有腐生微生物的孽生,所以一般斑点病害应从邻近健全组织,即从病、健组织交界处获得分离材料。
3、分离①病叶或病枝经自来水冲洗,从病斑周转1-2毫米处的健组织部位剪下②取10毫升小烧杯经酒带消毒,放入分离材料,倒入0.1%升汞液适量作表面消毒一分钟。
③消毒后倾出消毒液,用无菌水冲洗2——3,最后一次无菌水不要倒掉。
④用灭菌镊,剪在无菌水中将分离材料剪成2——3毫米大小的方块,每块组织均应为病健相间组织。
用灭菌镊子夹取剪好的材料,放入培养基平板上,轻轻按压。
每皿4——5块,排放均匀。
⑤将培养皿倒置,于23—25℃培养⑥3——4日后挑选由分离材料上长出的典型而无杂菌的菌落,在菌落边缘用移菌针挑取带有菌丝的培养基一小块,转入试管斜面培养基中央,于25℃温箱中培养。

实验四微生物的分离、纯培养与菌种保藏一、基础知识(一)微生物的分离自然界中各种微生物混杂生活在一起,即使取很少量的样品也是许多微生物共存的群体。
人们要研究某种微生物的特性,首先须使该微生物处于纯培养状态,也就是说培养物中所有细胞只是微生物的某一个种或株,它们有着共同的来源,是同一细胞的后代。
使用显微操作器单细胞挑取法可以直接得到纯培养。
稀释涂布平板法、稀释浇注平板法或平板划线法是分离和纯化微生物的常规方法。
后几种方法不需要特殊的仪器设备,一般情况下都能顺利进行,达到好的效果。
微生物的平板分离纯化技术自1880年Koch发明以来已有100多年的历史。
该技术的建立和发展为人类获得丰富的微生物资源以及在工、农、医、环境、动植物细胞培养等方面的应用作出了巨大贡献。
由此可见,一项新的重大的微生物学实验技术的建立会对整个生命科学带来革命性的变化。
从混杂的微生物群体中获得只含有某一种或某一株微生物的过程称为微生物的分离与纯化。
常用的方法有:平板分离法,该方法操作简便,普遍用于微生物的分离与纯化。
其基本原理包括两方面:(1)选择适合于待分离微生物的生长条件,如营养、酸碱度,温度和氧等要求或加入某种抑制剂造成只利于该微生物生长,而抑制其他微生物生长的环境,从而淘汰一些不需要的微生物。
(2)微生物在固体培养基上生长形成的单个菌落可以是由一个细胞繁殖而成的集合体。
因此可通过挑取单菌落而获得一种纯培养。
获取单个菌落的方法可通过解释涂面平板或平板划线等技术完成。
值得指出的是从微生物群体中经分离生长在乎板上的单个菌落并不一定保证是纯培养。
因此,纯培养的确定除观察其菌落特征外,还要结合显微镜检测个体形态特征后才能确定,有些微生物的纯培养要经过一系列的分离与纯化过程和多种特征鉴定方能得到。
(二)微生物的纯培养不同的微生物在固体、半固体和液体培养基中能表现出各自特有的培养特征,这些特征可以作为不同种类微生物的鉴别特征之一。
了解它们的培养特征、掌握其生长规律对识别、控制和利用微生物具有重要价值。


设计实验:微生物菌种的分离纯化、培养、、鉴定以及保藏技术一.实验目的1.学习大肠菌群分离纯化、鉴定的原理。
2.掌握平板表面涂布法、平板划线法的分离技术。
3.学习掌握菌种保藏的原理和方法。
二.实验原理菌种的分离纯化从混杂微生物群体中获得只含有某一种或某一株微生物的过程称为微生物分离与纯化。
在分子生物学的研究及应用中,不仅需要通过分离纯化技术从混杂的天然微生物群中分离出特定的微生物,而且还必须随时注意保持微生物纯培养物的“纯洁”,防止其他微生物的混入。
1.涂布平板法因为将微生物悬液先加到较烫的培养基中再倒平板易造成某些热敏感菌的死亡,且采用稀释倒平板法也会使一些严格好氧菌因被固定在琼脂中间缺乏氧气而影响其生长,因此在微生物学研究中常用的纯种分离方法是涂布平板法。
2.平板划线法最简单的分离微生物的方法是平板划线法,其原理是将微生物样品在固体培养基表面多次作“由点到线”稀释而达到分离目的的。
划线的方法很多,常见的比较容易出现单个菌落的划线方法有斜线法、曲线法、方格法、放射法、四格法等。
大肠菌群的培养鉴定大肠菌群能在乳糖胆盐液体培养液中生长,并且产气产酸,使培养液变色。
还能在伊红美兰固体培养上生长,形成黑紫色的菌落,有的还有金属光泽。
其他病原菌的菌落呈粉红色。
再做镜检观察是无芽孢的革兰氏阴性杆菌(呈红色)。
即可鉴定是有大肠菌群的菌存在。
菌种保藏菌种保藏是将微生物的菌种经长时间的保存,不污染其它杂菌,及可保持其形态特征和生理性状,减少变异,防止衰老,以便于将来使用。
保藏菌种一般是选用它的休眠休,如孢子;芽孢等等,并且要创造一个低温;干燥;缺氧;避光和缺少营养的环境条件,以利于休眠体能长期地处于休眠状态。
对于不产孢子的微生物,应使其新陈代谢处于最低状态,又不会死亡,从而达到长期保存的目的三.实验器材1.菌种:污水中的大肠菌群、酵母菌和霉菌2、培养基:乳糖胆盐液体培养基、伊红美蓝琼脂(EMB)、营养琼脂培养基、麦芽汁固体斜面培养基和马铃薯固体斜面培养基。

Sdu微生物大实验土壤微生物的分离纯化与鉴定【实验目的】1、从各地区土壤中筛选含几丁质酶的真菌及含果胶酶的菌株;2、通过从土壤中分离纯化菌株,掌握培养基的制备与灭菌技术、微生物的筛选、分离纯化方法和无菌操作技术。
3、复习以前学过的各种染色方法,掌握生理生化试验的原理与方法。
4、掌握微生物的鉴定技术、菌种保藏技术。
【实验原理】1、微生物的分离与纯化:从混杂的微生物群体中获得只含有某一种或某一株微生物的过程称为微生物的分离与纯化。
此次实验采取平板分离法,该方法操作简便,普遍用于微生物的分离与纯化,其基本原理主要包括两个方面:a.选择适合于待分离微生物的生长条件或加入某种抑制剂造成只利于待分离微生物生长,而抑制其它微生物生长的环境,从而淘汰大部分不需要的微生物。
b.微生物在固体培养基上生长形成的单个菌落可以是由一个细胞繁殖而成的集合体,因此可通过挑取单菌落而获得一种纯培养。
获得单菌落的方法可通过稀释涂布平板法或平板划线法等技术来完成。
微生物的观察可以用显微镜观察其细胞形态,也可以用肉眼观察其菌落形态。
前者是微生物的显微镜观察技术,后者是微生物的肉眼观察技术。
2、霉菌:霉菌可产生复什分枝的菌丝体,分基内菌丝和气生菌丝,气生菌丝生长到一定阶段分化产生繁殖菌丝,由繁殖菌丝产生孢子。
霉菌菌丝体(尤其是繁殖菌丝)及孢子的形态特征是识别不同种类霉菌的重要依据。
霉菌菌丝和孢子的宽度通常比细菌和放线菌粗得多(约 3-10μm ),常是细菌菌体宽度的几倍至几十倍,因此,用低倍显微镜即可观察。
观察霉菌的形态有多种方法,常用的有直接制片观察法、载玻片培养观察法和玻璃培养观察法三种方法,本实验采用载玻片培养观察法。
3、果胶酶筛选培养基:配制以果胶为唯一碳源的筛选培养基,在该培养基上,只有能分解利用果胶的菌株才能够生长,依此来从土壤中筛选出能够产果胶酶的菌株。
刚果红(Congo Red,简称CR)是一种染料,它可与果胶形成红色复合物,但并不和果胶水解后的产物发生这种显色反应,在含有果胶的培养基中加入刚果红时,刚果红能与培养基中的果胶形成红色复合物。
实验报告:细菌的分离培养与纯培养一、背景细菌是一类微生物,是生命中最简单的有细胞结构的生物。
它们广泛存在于自然界的各个环境中,包括水体、土壤、空气和人体等。
为了了解细菌的性质、研究其生物学特性以及开发应用价值,分离培养并得到纯培养的细菌菌株是必不可少的步骤。
本次实验旨在通过分离培养的方法,从样本中分离出单一种类的细菌,然后进行纯培养,最终得到该细菌的纯培养物。
二、实验方法和步骤1. 实验材料准备•细菌样本:采集自自然环境或已知细菌株。
•培养基:根据细菌的特性选择适当的培养基,如营养琼脂平板。
•培养基成分:包括葡萄糖、氯化钠、琼脂等。
•培养基容器:如琼脂平板、试管等。
•实验器材:消毒锅、试管架、涂布棒等。
•实验仪器:恒温培养箱、显微镜等。
2. 分离培养实验步骤步骤1:样品的采集和制备从自然环境中采集待研究的细菌样品,例如土壤、水样等。
将样品收集在无菌容器中,并在实验室内进行处理。
步骤2:样品的稀释取一定量的培养基,根据需要的适宜稀释倍数(一般为10-1~10-5),将样品和培养基按比例混合,制成一系列不同稀释度的样品溶液。
使用无菌滴管,分别取适量的样品溶液接种到对应的琼脂平板上。
步骤3:平板涂布使用消毒好的涂布棒,将样品溶液均匀涂抹在琼脂平板上,然后用标签标记每个平板。
涂布完毕后,将平板倒置放在无菌培养箱中,孵育一段时间。
步骤4:单菌落的分离观察培养箱中的平板,找出生长菌落较少、分散且各不相连的菌落。
使用无菌的细胞刮取棒在菌落边缘轻轻划线,然后用刮取棒将菌落刮移到另一块琼脂平板上。
此时,细菌已被成功分离。
3. 纯培养实验步骤步骤1:选取单菌落进行培养从分离得到的细菌菌落中挑选出一个单菌落,利用无菌的细胞刮取棒将其转移到新的琼脂平板中。
步骤2:液体培养将得到的单菌落转移到含有适宜培养基的液体培养基中,如含有营养成分和抗生素的葡萄糖盐水。
利用无菌的试管,接种适量的菌落,并在恒温培养箱中以适当条件培养。
实验:微生物的分离、纯化和培养一、目的要求掌握倒平板的方法和几种常用的分离纯化物的基本操作技术。
二、基本原理从混杂的微生物群体中获得只含有某一种或某一株微生物的过程称为微生物的分离与纯化。
本实验采用平板分离法:该方法操作简便,普遍用于微生物的分离与纯化,其包括两个方面:1、选择适合于待分离微生物的生长条件等要求或者加入某种抑制剂造成只利于该微生物生长,而抑制其它微生物生长的环境,从而淘汰一些不需要的微生物;2、微生物在固体培养基生长形成的单个菌落可以是一个细胞繁殖而成的集合体,因此可通过挑取单菌落而获得一种纯培养。
获得单个菌落的方法可通过稀释涂布平板或平板划线等技术完成。
纯培养的确定:1.确定其菌落观察特征;2.结合显微镜检测个体形态特征的确定。
三、器材1、菌种米曲霉;2、培养基高氏Ⅰ号培养基,牛肉膏蛋白胨培养基,马丁氏琼脂培养基,查氏琼脂培养基;3、溶液或试剂10%酚盛9mL无菌水的试管盛90mL无菌水并带有玻璃珠的三角烧瓶,4%水琼脂;4、仪器或者其他用具无菌玻璃涂棒,无菌吸管,接种环,无菌培养皿,链霉素和土样,显微镜,血细胞计数板等。
四、操作步骤1、稀释涂布平板法(1) 倒平板将肉膏蛋白胨琼脂培养基,高氏Ⅰ号琼脂培养基;马丁氏琼脂培养基加热溶化,待冷至55~60℃,高氏Ⅰ号琼脂培养基加入10%酚数滴,马丁氏琼脂培养基加入链霉素溶液。
混匀后分别倒平板,每种培养基倒三皿;(2) 制备土壤稀释溶液称取土样10g,放入盛有90mL无菌水并带入玻璃珠的三角烧瓶,振动约20min,使土样与水分混合,将细胞分散。
用一支1mL无菌吸管从中吸取1mL土壤悬液加入盛有9mL 无菌水的大试管中充分混匀,然后用无菌吸管从此试管中吸取1mL 加入另一个盛有9mL 无菌水的试管中,混合均匀,以此推制成10-1,10-2,10-3,10-4,10-5,10-6不同稀释的土壤溶液;(3) 涂布 将上述每种培养基的三个平板地面分别用记号笔写上10-4,10-5,10-6三种稀释度,然后用无菌吸管分别由10-4,10-5,10-6三管土壤稀释液中各取0.1mL 对号放入已写好的培养皿中, 用无菌玻璃涂棒,右手拿无菌涂棒平放在平板培养基表面上,将菌悬液先沿同心圆方向轻轻地向外扩展,使之分布均匀。
设计实验:微生物菌种的分离纯化、培养、、鉴定以及保藏技术
一.实验目的
1.学习大肠菌群分离纯化、鉴定的原理。
2.掌握平板表面涂布法、平板划线法的分离技术。
3.学习掌握菌种保藏的原理和方法。
二.实验原理
菌种的分离纯化
从混杂微生物群体中获得只含有某一种或某一株微生物的过程称为微生物分离与纯化。
在分子生物学的研究及应用中,不仅需要通过分离纯化技术从混杂的天然微生物群中分离出特定的微生物,而且还必须随时注意保持微生物纯培养物的“纯洁”,防止其他微生物的混入。
1.涂布平板法
因为将微生物悬液先加到较烫的培养基中再倒平板易造成某些热敏感菌的死亡,且采用稀释倒平板法也会使一些严格好氧菌因被固定在琼脂中间缺乏氧气而影响其生长,因此在微生物学研究中常用的纯种分离方法是涂布平板法。
2.平板划线法
最简单的分离微生物的方法是平板划线法,其原理是将微生物样品在固体培养基表面多次作“由点到线”稀释而达到分离目的的。
划线的方法很多,常见的比较容易出现单个菌落的划线方法有斜线法、曲线法、方格法、放射法、四格法等。
大肠菌群的培养鉴定
大肠菌群能在乳糖胆盐液体培养液中生长,并且产气产酸,使培养液变色。
还能在伊红美兰固体培养上生长,形成黑紫色的菌落,有的还有金属光泽。
其他病原菌的菌落呈粉红色。
再做镜检观察是无芽孢的革兰氏阴性杆菌(呈红色)。
即可鉴定是有大肠菌群的菌存在。
菌种保藏
菌种保藏是将微生物的菌种经长时间的保存,不污染其它杂菌,及可保持其形态特征和生理性状,减少变异,防止衰老,以便于将来使用。
保藏菌种一般是选用它的休眠休,如孢子;芽孢等等,并且要创造一个低温;干燥;缺氧;避光和缺少营养的环境条件,以利于休眠体能长期地处于休眠状态。
对于不产孢子的微生物,应使其新陈代谢处于最低状态,又不会死亡,从而达到长期保存的目的
三.实验器材
1.菌种:污水中的大肠菌群、酵母菌和霉菌
2、培养基:乳糖胆盐液体培养基、伊红美蓝琼脂(EMB)、营养琼脂培养基、麦芽汁固体斜面培养基
和马铃薯固体斜面培养基。
3.器材:接种环、安培瓶、干燥器、冰箱、产气管、试管、培养皿、无菌平皿、无菌玻璃涂棒移液管、电炉、双目显微镜、恒温培养箱、无菌操作台、高压灭菌锅、恒温干燥箱等。
4.试剂:革兰氏一(草酸铵结晶紫)、革兰氏二(路哥氏碘液) 、革兰氏三(95%乙醇)、
革兰氏四(蕃红);试剂:医用液体石腊(比重0.83~0.89)。
四.试验方法及步骤
1.大肠菌群的分离纯化
第一天
a.涂布平板法:将已熔化的营养琼脂培养基倒入无菌平皿,制成无菌平板,冷却凝固后,将一定量的含大肠菌群的污水滴加在平板表面,再用无菌玻璃涂棒将菌液均匀分散至整个平板表面,置培养箱中37℃培养24小时。
经培养后挑取单个菌落。
第二天
b.平板划线法:经培养后挑取单个菌落,接种环以无菌操作沾取少许菌落,在无菌伊红美兰琼脂培养基平板表面进行连续划线,微生物细胞数量将随着划线次数的增加而减少,并逐步分散开来,如果
划线适宜的话,微生物能一一分散。
在37℃经培养24小时后,可在平板表面得到单菌落。
(有时这种单菌落并非都由单个细胞繁殖而来的,故必须反复分离多次才可得到纯种.)
2.大肠菌群的培养鉴定
第三天
a观察固体培养基菌落
a将菌落转入装有玻璃珠的灭菌锥形瓶中调节酸碱度为7,充分摇匀备用。
b液体发酵:取处理好的样品液1mL加入灭菌的乳糖胆盐液体培养基中。
摇匀后置培养箱中37℃培养24小时
第四天
c观察液体培养基菌落
d镜检
3.菌种保藏
一)斜面低温保藏法:
此法为最常用的一种。
一般霉菌;放线菌和有芽孢的细菌可保存2~4个月,酵母菌可保存2个月,无芽孢的细菌最好每周移接一次。
操作过程如下:
1、接种:将要保藏的菌种接入斜面培养基上,试管上贴好标签,写上菌种名称,时间。
2、培养:各类菌按其所需温度和时间进行培养。
3、保藏:选取生长健壮的菌种,于其试管带棉塞的上半部用灭菌的塑料包扎好,以防棉塞受潮感染杂菌。
置于4℃冰箱中保藏。
(二)液体石腊保藏法:
此法可用不分解石腊的菌种保藏。
保存时间是半年至一年。
放线菌;霉菌和产芽孢菌可保藏二年。
液体石腊可防止培养基水分的蒸发,而引起的菌种死亡。
同时可阻止氧气进入,防止好氧菌的生长。
从而延长菌种保藏的时间。
但需注意的是试管必须直立放置,并且不便携带。
操作过程如下:
1、液体石腊的灭菌:将液体石腊装入锥形瓶中,量不超出锥形瓶体积的1/3,塞上棉塞,包扎好后,进行高压蒸汽灭菌二次(120℃30分钟)。
再在110~120℃干燥箱中蒸发掉蒸汽灭菌时带入的水分。
此时石腊透明清亮状。
经检验确定无菌后备用。
2、菌种培养:将所需的菌种经培养后,选取健状的保藏。
3、加石腊油:用无菌管吸取石腊油加入菌种试管中,以高出菌种斜面顶点1cm为宜。
少了会因培养基露出油面,而使培养基变干造成菌死亡。
4、收藏:试管上部用塑料包扎好,垂直立于冰箱中4℃。
5、恢复使用:当要使用菌种时。
倾出石腊油。
此石腊油可再灭菌重复使用。
接种培养。
由于菌体外粘有油。
第一次的菌生长缓慢,性状恢复不是很好。
所以要再移植一次才能得到良好的菌种。
五.实验记录及数据处理
1.分离后的大肠菌群固液培养基的菌落状态
2.镜检结果
六、实验结果分析及问题讨论。